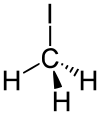
Iodmethan
Iodmethan, veraltet Methyliodid, ist eine organische Halogenverbindung.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Iodmethan | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH3I | |||||||||||||||
| Kurzbeschreibung |
farblose, stechend etherisch riechende Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 141,94 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
2,28 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
42 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schlecht in Wasser (8,66 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Dipolmoment | ||||||||||||||||
| Brechungsindex |
1,5304[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−13,6 ± 0,5 kJ·mol−1[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung
Iodmethan entsteht in einer exothermen Reaktion, wenn Iod zu einem Gemisch von Methanol und rotem Phosphor gegeben wird.[7] Das iodierende Reagenz ist Phosphortriiodid, das in situ gebildet wird:
Alternativ kann Iodmethan durch Reaktion von Dimethylsulfat mit Kaliumiodid in Gegenwart von Calciumcarbonat hergestellt werden:[7]
Methyliodid/CH3I kann durch Destillation und nachfolgendes Waschen mit Na2S2O3 von Iod gereinigt werden.
Physikalische Eigenschaften
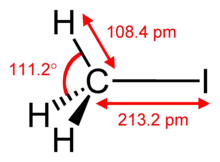
Iodmethan ist bei Umgebungstemperatur und Normaldruck eine farblose, etherisch riechende Flüssigkeit. Bei Normaldruck siedet die Verbindung bei 42,44 °C.[8] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,1554, B = 1177,78 und C = −32,058 im Temperaturbereich von 218 bis 315,6 K[9] bzw. mit A = 4,14897, B = 1223,831 und C = −20.179 im Temperaturbereich von 315,6 bis 521 K.[9] Die Verbindung ist schwer brennbar. Der Explosionsbereich liegt zwischen 8,5 Vol.‑% (500 g/m3) als untere Explosionsgrenze (UEG) und 66 Vol.‑% (3870 g/m3) als obere Explosionsgrenze (OEG).[10] Die Zündtemperatur beträgt 355 °C.[10] Der Stoff fällt somit in die Temperaturklasse T2.
Chemische Eigenschaften
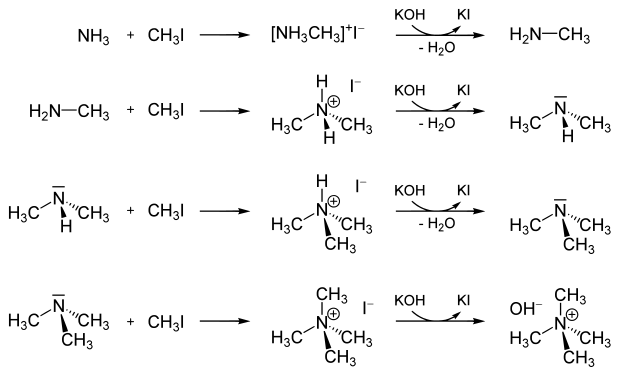
Iodmethan reagiert mit Alkali- und Erdalkalimetallen und wird zur Methylierung (Einführung einer Methylgruppe) von organischen Substanzen verwendet. Ammoniak und Amine reagieren mit Iodmethan unter Bildung von Methylammoniumiodiden. Durch Wiederholung dieser Reaktion können quartäre Ammoniumionen erzeugt werden (sog. erschöpfende Methylierung), wobei nach jedem Schritt das Amin mit einer Base freigesetzt wird:
Quartäre Ammoniumionen können nicht mehr durch Laugen deprotoniert werden. Ihre Salze sind vollständig dissoziiert.
Toxische Eigenschaften
Iodmethan hat sich im Tierversuch als krebserregend erwiesen.[3]
Physiologische Wirkung
Iodmethan ist wie andere Methylierungsreagenzien (Beispiel: Dimethylsulfat) krebserregend und sehr toxisch. Die karzinogene Wirkung ist ursächlich verbunden mit der methylierenden Wirkung. Methyliodid ist ein sehr gutes Elektrophil und geht somit leicht nucleophile Substitutionsreaktionen mit körpereigenen Nucleophilen ein. Dadurch kommt es zu einer Methylierung der DNA, die dann bei der Zellteilung nicht mehr korrekt von der DNA-Polymerase abgelesen werden kann.[11]
Reaktionen
Monsanto-Prozess
Iodmethan ist Bestandteil des katalytischen Zyklus des Monsanto-Prozess zu Herstellung von Essigsäure.[12]
Verwendung
Durch Reaktion mit Natriumarsenit in Gegenwart von Natriumhydroxid kann Dinatriummethylarsonat gewonnen werden.[13]
Einzelnachweise
- Eintrag zu Iodmethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 15. Mai 2019. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- Eintrag zu Iodmethan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. September 2014.
- Eintrag zu Iodomethane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 74-88-4 bzw. Iodmethan), abgerufen am 2. November 2015.
- A. S. Carson, P. G. Laye, J. B. Pedley, Alison M. Welsby: The enthalpies of formation of iodomethane, diiodomethane, triiodomethane, and tetraiodomethane by rotating combustion calorimetry, in: The Journal of Chemical Thermodynamics, 1993, 25 (2), S. 261–269; doi:10.1006/jcht.1993.1025.
- C. S. King, W. W. Hartman: Methyl Iodide In: Organic Syntheses. 13, 1933, S. 60, doi:10.15227/orgsyn.013.0060; Coll. Vol. 2, 1943, S. 399 (PDF).
- Boublik, T.; Aim, K.: Heats of Vaporization of Simple Non-spherical Molecule Compounds in Collect. Czech. Chem. Commun.37 (1972) 3513.
- Stull, D.R.: Vapor Pressure of Pure Substances. Organic and Inorganic Compounds in Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen – Band 1: Brennbare Flüssigkeiten und Gase, Wirtschaftsverlag NW – Verlag für neue Wissenschaft GmbH, Bremerhaven 2003.
- Carsten Schmuck, Bernd Engels, Tanja Schirmeister, Reinhold Fink: Chemie für Mediziner, Pearson Studium, S. 457, ISBN 978-3-8273-7286-4.
- Greener Industry: Ethanoic Acid - Production Method: The Monsanto Process. Abgerufen am 14. Mai 2019 (englisch).
- P. H. List, L. Hörhammer: Chemikalien und Drogen Teil A: N-Q. Springer-Verlag, 2013, ISBN 978-3-642-65035-2, S. 108 (eingeschränkte Vorschau in der Google-Buchsuche).