Chlorpentafluorid
Chlorpentafluorid ist eine gasförmige Interhalogenverbindung, die aus den Elementen Chlor und Fluor besteht.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Chlorpentafluorid | |||||||||||||||
| Andere Namen |
Chlor(V)-fluorid | |||||||||||||||
| Summenformel | ClF5 | |||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 130,45 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
5,987 kg·m−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−13,2 °C[1] | |||||||||||||||
| Dampfdruck |
3,253 bar (20 °C)[1] | |||||||||||||||
| Löslichkeit |
Hydrolyse in Wasser (es bildet sich Fluorwasserstoff)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−255 kJ/mol[2] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Chlorpentafluorid kann hergestellt werden, indem man Chlortrifluorid unter hohem Druck in Fluor erhitzt.[3]
Eigenschaften
Chlorpentafluorid ist ein farbloses, stechend riechendes Gas, welches sich in der Hitze zersetzt.[1] Die Standardbildungsenthalpie beträgt −255 kJ·mol−1.[4]
Molekülgeometrie
Chlorpentafluorid besitzt gemäß dem VSEPR-Modell eine quadratisch-pyramidale Molekülgeometrie. Die vier FClF-Winkel betragen dabei ungefähr 90°. Die axiale Cl–F-Bindung, welche die Spitze der quadratischen Pyramide bildet, besitzt eine Länge von 162 pm. Die vier planaren Cl–F-Bindungen, welche die quadratische Grundfläche der Pyramide bilden, haben eine Länge von 172 pm. Das freie Elektronenpaar am Chlor-Atom ist dabei axial angeordnet, um einen möglichst großen Abstand zu den Fluor-Atomen zu gewährleisten.[2]
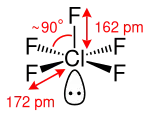
Chlorpentafluorid besitzt als Molekülsymmetrie die Punktgruppe C4v.[2]
Verwendung
Wie Chlortrifluorid ist auch das Pentafluorid, als Oxidator in der Raketentechnik geeignet,[5] zeigt jedoch ähnliche[6] Probleme in der Handhabung[7].
Weblinks
Einzelnachweise
- Eintrag zu Chlorpentafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. Februar 2016. (JavaScript erforderlich)
- A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 1. Band: Grundlagen und Hauptgruppenelemente. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049585-0, S. 508–509 (Leseprobe: Teil A – Grundlagen der Chemie Der Wasserstoff. Google-Buchsuche). (abgerufen über De Gruyter Online)
- D. F. Smith: Chlorine Pentafluoride. In: Science. Band 141, Nummer 3585, September 1963, S. 1039–1040, doi:10.1126/science.141.3585.1039. PMID 17739492.
- Riedel, E.; Janiak, C.: Anorganische Chemie, 9. Auflage, 2015 Walter de Gruyter GmbH & Co. KG, Berlin/Boston, ISBN 978-3-11-035528-4, S. 432, (abgerufen über De Gruyter Online).
- Eintrag zu Chlorfluoride. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2014.
- John D. Clark: Ignition! An Informal History of Liquid Rocket Propellants. Rutgers University Press, Piscataway, NJ 1972, ISBN 0-8135-0725-1, S. 88.
- John D. Clark: Ignition! An Informal History of Liquid Rocket Propellants. Rutgers University Press, Piscataway, NJ 1972, ISBN 0-8135-0725-1, S. 73–75.



