Herdenschutz (Epidemiologie)
Herdenschutz[1][2], auch Herdeneffekt[3] genannt, bezeichnet in der Epidemiologie im engeren Sinn den Effekt, dass ein bestimmter Anteil von Individuen innerhalb einer Population, die – zum Beispiel infolge einer durchgemachten Infektion oder durch Impfung – immun sind, auch nichtimmunen Individuen einen relativen Schutz vor einer ansteckenden Krankheit bietet. Der Anteil der Individuen mit Immunität in einer bestimmten Population (der „Herde“) wird auch als Herdenimmunität bezeichnet. Der Herdenschutz ist demnach das Ergebnis einer hohen Herdenimmunität in der Population. Neben der Herdenimmunität wird der Herdenschutz auch durch den Infektionsdruck der entsprechenden Infektion bestimmt. Teilweise werden die Begriffe Herdenimmunität, Herdeneffekt und Herdenschutz auch synonym verwendet.
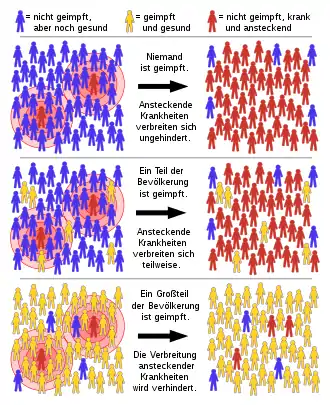
Definition
Herdenschutz bezeichnet im engeren Sinn den Effekt, dass ein bestimmter Anteil immuner Individuen innerhalb einer Population (entstanden durch Impfung oder durchgemachte Infektionen) auch nichtimmunen Individuen einen relativen Schutz vor einer ansteckenden Krankheit bietet.[4] Mit steigendem Anteil der Immunisierten (Individuen mit Immunität) in der Bevölkerung sinkt die Infektionswahrscheinlichkeit, weil Infektionsketten unterbrochen werden. Dieser Anteil der Immunisierten in einer bestimmten Population (der „Herde“) wird auch als Herdenimmunität bezeichnet.[5] Die Herdenimmunität beschreibt daher eine Verteilung von Immunität (pattern of immunity), die eine Population vor neuen Infektionen schützt.[6][7][8]
Der Herdenschutz ist demnach das Ergebnis einer hohen Herdenimmunität in der Population. Neben der Herdenimmunität wird der Herdenschutz auch durch den Infektionsdruck der entsprechenden Infektion bestimmt.[5] Teilweise werden die Begriffe Herdenimmunität, Herdeneffekt und Herdenschutz auch synonym verwendet.
Ein Verständnis der immunologischen Phänomene bei umfassender Durchimpfung von Populationen hilft, das Design von Impfkampagnen zu verbessern, sodass übertragbare Infektionskrankheiten nicht nur theoretisch, sondern auch in der Realität besser kontrolliert, begrenzt oder ausgerottet werden können.[5] Nachstehend wird der Definition von Herdenimmunität als „Anteil der Individuen mit Immunität“ und Herdeneffekt bzw. Herdenschutz als indirektem Schutz gefolgt.[5]
Bezeichnungsproblematik
Kritiker weisen darauf hin, dass die Bezeichnung Herdenimmunität von verschiedenen Autoren verwendet wurde, um unterschiedliche Konzepte zu beschreiben. Herdenimmunität sei zum einen als der „Anteil der Individuen mit Immunität in einer Bevölkerung“ und zum anderen als „Effekt, dass ein gewisser Anteil immuner Individuen innerhalb einer Population auch nichtimmunen Individuen einen relativen Schutz bietet“ definiert worden. Die Verwendung des Ausdrucks in der zweiten Bedeutung sei laut Kritikern irreführend: Zwar sei der Begriff Immunität früher für einen allgemeinen Schutzzustand verwendet worden, beschreibe heute aber einen Zustand, in dem das Immunsystem des Körpers spezifisch auf definierte Immunogene reagiert hat. Somit sei Immunität ein Attribut des Individuums und nicht einer Gruppe. Aus diesem Grund solle die Bezeichnung Herdenimmunität für „den Anteil der Individuen mit Immunität in einer Bevölkerung“ verwendet werden und die Bezeichnung Herdeneffekt oder Herdenschutz für den „Effekt, dass ein gewisser Anteil immuner Individuen innerhalb einer Population auch nichtimmunen Individuen einen relativen Schutz bietet“.[5]
Nach dieser Definition führt eine gewisse Herdenimmunität in der Bevölkerung somit durch Unterbrechen der Infektkette zu Herdenschutz. Auch das Robert Koch-Institut spricht an einigen Stellen von Herdenschutz statt Herdenimmunität.[9] Da das Wort Herde teilweise negativ konnotiert ist, wird zunehmend auch die Bezeichnung Gemeinschaftsschutz[10] (englisch community protection[11]) statt Herdenschutz verwendet.
Einflussgrößen
Das Phänomen des Herdenschutzes ist komplex. Die einfache („krude“) Schwellen-Theorie, also das Basis-Modell zur Wechselwirkung von Transmission und Immunitätsschwelle, ist „naiv“, denn sie basiert auf etlichen Annahmen, die in der Realität nicht gegeben sind, und auf Faktoren, die bisher nicht ausreichend verstanden oder quantifizierbar oder noch unbekannt sind.[6][11][12][13]
Zu den Größen mit Einfluss auf die tatsächlich erzielte Wirksamkeit (efficiency) von Impfungen gehören:
- Immunität der Mutter mit ihrer Auswirkung auf die Leih-Immunität von Neugeborenen und die Immunogenität der Impfungen von Neugeborenen
- Alter vor allem bei der ersten Impfung
- Alter mit Auswirkung auf Art und Häufigkeit des Kontakts zu Keimträgern
- Jahreszeit mit Auswirkung auf Art und Häufigkeit des Kontakts zu Keimträgern und Vermehrungsfähigkeit von Keimen
- Dauer der Infektiosität
- Dauer und Ausmaß der Immunität
- anatomischer Ort der Immunität (zum Beispiel humoral oder zellulär, mukosal oder systemisch, oral oder enteral)
- Wirkung der Immunität (zum Beispiel gegen Symptome, Aufnahme und/oder Vermehrung der Erreger, Weitergabe der Erreger, Toxine)
- Homogenität der Population oder von Teilpopulationen hinsichtlich der Art und Häufigkeit des Kontakts (abgeschottet oder durchlässig) und der Infektweitergabe zwischen Infizierten und nicht Immunisierten
- Homogenität der Population oder von Teilpopulationen hinsichtlich der Einstellung zu und regelkonformen Durchführung von Impfungen, im ungünstigen Fall kollektives Impfversagen in Teilpopulationen (beispielsweise durch hygienische Verhältnisse, Ernährungszustand, ethnisch-genetische Unterschiede)
- Verteilung der Impfstoffe (zufällig oder gezielt, homogen oder inhomogen)
- individuell beeinträchtigte Immunkompetenz (beispielsweise durch Immundefekte oder Impfversagen)
Der zur Berücksichtigung dieser Einflussgrößen in das mathematische Modell eingeführte Effizienzfaktor E beruht seinerseits auf Annahmen dazu, wie sich vorgenannte Einflussgrößen im Einzelnen und in gegenseitiger Wechselwirkung quantitativ auswirken.
In der Regel führt Faktor E zu einer Erhöhung der in der Realität notwendigen Durchimpfungsrate im Vergleich zu den idealisierten Annahmen des mathematischen Modells. Sofern allerdings Teilpopulationen bekannt sind, die ein besonders hohes Infektrisiko haben, kann deren gezielte Durchimpfung die insgesamt nötige Impfquote (overall vaccine coverage) absenken, also zu einer durchschnittlich höheren tatsächlichen Wirksamkeit der Impfkampagne führen.
Eigenschaften
Der Herdeneffekt wirkt ähnlich wie eine Brandschneise bei einem Feuer, indem die Infektionskette eines Krankheitserregers dank der Immunität unterbrochen oder mindestens verlangsamt wird. In der Folge kann sich die Krankheit nicht mehr epidemisch ausbreiten, insofern die Krankheitserreger nur zwischen Menschen übertragen werden (Anthroponose). Oberhalb eines bestimmten Schwellenwerts der Immunität in einer Bevölkerung verringert sich die Weitergabe des Erregers immer mehr, schließlich reißt die Infektkette ab, es kommt in dieser Population nicht mehr zu Infektionen. Dieser Schwellenwert ist im Wesentlichen abhängig von der Basisreproduktionszahl des jeweiligen Krankheitserregers. Selbst wenn der Krankheitserreger Rückzugsräume in anderen Populationen hat, kann er nicht mehr von diesen aus Populationen mit ausreichender Herdenimmunität infizieren.
| Krankheit | Übertragungsweg | R0 | Mindestanteil Immunisierter |
|---|---|---|---|
| Masern | Tröpfcheninfektion | 12–18 | 92–94 % |
| Mumps | Tröpfcheninfektion | 4–7 | 75–86 % |
| Polio | fäkal-orale Infektion | 5–7 | 80–86 % |
| Röteln | Tröpfcheninfektion | 5–7 | 80–86 % |
| Pocken | Tröpfcheninfektion | 6–7 | 83–86 % |
| Die Basisreproduktionszahl R0 gibt an, wie viele weitere Personen eine infizierte Person durchschnittlich ansteckt, falls die sie umgebende Population oder Teilpopulation weder durch Impfung noch durch frühere Infektion geschützt ist. | |||
Das Basis-Modell
Ausgehend von der Basisreproduktionszahl ist die unter idealen Umständen für einen Herdeneffekt mindestens erforderliche Impfabdeckung gegeben durch:[15]
und in Prozentangaben:
- .
Der Wert wird auch als Herdenimmunitätsschwelle (englisch herd immunity threshold, kurz HIT) bezeichnet.
Die in der Tabelle aufgeführte Herdenimmunitätsschwelle (HIT) ist nicht identisch mit der mindestens notwendigen Durchimpfungsrate:
Effizienzfaktor E
Abweichend vom Basis-Modell hängt das tatsächlich erreichbare Ausmaß von Herdenimmunität und Herdeneffekt von vorgenannten Einflussgrößen ab. Daher sind in der Realität meist höhere Durchimpfungsraten für einen Herdeneffekt als unter idealen Bedingungen erforderlich. Um dies zu berücksichtigen, wird die Gleichung um die Größe E, den Faktor der Wirksamkeit ( für Effizienz), erweitert:
Somit ist die mindestens notwendige Durchimpfungsrate meist höher als die in der Tabelle aufgeführte mindestens notwendige Herdenimmunität (HIT).[6] Sowohl eine Zunahme in der Durchimpfungsrate als auch eine Zunahme in der Wirksamkeit der Impfung erleichtern das Erreichen eines Herdeneffekts. Der günstige Fall, dass die im Durchschnitt (für eine Gesamtpopulation) nötige mindestens notwendige Durchimpfungsrate kleiner ist als die in der Tabelle (für die Gesamtpopulation) aufgeführte mindestens notwendige Herdenimmunität, tritt selten ein, beispielsweise bei gezielter Impfung von Teilpopulationen mit besonders hohem Risiko der Infektion und/oder Transmission. Herdenschutz ist kein statisches Phänomen. So sind beispielsweise bei Impfungen mit Abnahme (engl. „waning“) der Immunität im Lauf der Zeit Auffrischungsimpfungen erforderlich, um einen Herdeneffekt aufrechtzuerhalten.[6][16]
Natürlicher Herdenschutz
Eine mittels durchgemachter Infektion erworbener Herdenschutz spielte in der Ära, bevor es Impfungen gab, eine bedeutende Rolle. Sie konnte große Seuchen zurückdrängen, bis die Krankheitserreger größtenteils eliminiert waren. Wenn die immune Bevölkerung dann aus anderen Gründen verstarb, breiteten sich die Seuchen erneut zu einer Epidemie aus. Oder aber es entwickelten sich die Kinderkrankheiten, gegen die die Erwachsenen Immunität aufwiesen, die sie entweder durch frühere Erkrankung oder unbemerkt nach einem symptomlosen Verlauf einer Infektion (klinisch inapparente Infektion → stille Feiung) natürlich erworben hatten, wie typisch bei Polio. Man nennt diesen Zustand endemischen Status, welcher theoretisch durch die Formel (S = Suszeptibilität/Empfänglichkeit) beschrieben wird. Eins bedeutet: Nur ein Mensch steckt einen anderen an.
Natürliche Immunität als Prädiktor für die Möglichkeit von Impfungen
Wenn eine Seuche nach der Erkrankung Genesene hinterlässt, die lebenslang immun sind, dann ist ein Impfstoff fast immer möglich (“Natural infection is the mother of all vaccines”, Antony Fauci). Solche Krankheiten sind die Pocken und die Kinderlähmung (Poliomyelitis); jedoch gehören AIDS, Malaria, Tuberkulose und Hepatitis C nicht dazu. Bei letzteren gibt es allenfalls eine Teilimmunität, oder nur ein Teil der Erkrankten kann, wie bei der Hepatitis C (30 %), das Virus eliminieren, oder es gibt wegen häufiger Mutationen (beim AIDS-Erreger HIV fast täglich) praktisch keine Immunität. Bei der Influenza ereignen sich Mutationen etwa jährlich; in dieser Zeit sind Impfstoffanpassungen möglich.[17]
Selektionsdruck
Der Herdenschutz selbst wirkt als Selektionsdruck auf einige Viren und beeinflusst die virale Evolution, indem sie die Produktion neuer Stämme, in diesem Fall als „Escape-Mutanten“ bezeichnet, fördert. Sie sind so der Lage, einem Herdenschutz zu „entkommen“ und sich leichter zu verbreiten.[18][19]
Auf molekularer Ebene entgehen Viren der Immunität durch Antigendrift, d. h. es entstehen Mutationen in dem Teil des viralen Genoms, der für das Oberflächenantigen des Virus kodiert, typischerweise einem Protein im Viruskapsid, was zu einer Veränderung des viralen Epitops führt.[20][21] Alternativ kann auch ein Reassortment separater Segmente des viralen Genoms oder ein Antigenshift, der häufiger auftritt, wenn mehrere Stämme im Umlauf sind, neue Serotypen hervorbringen.
Wenn eines dieser Phänomene auftritt, erkennen die T-Zellen das Virus nicht mehr und die Menschen sind nicht immun gegen den dominanten zirkulierenden Stamm.[21][22] Sowohl bei der Influenza als auch beim Norovirus, einer häufigen Ursache für Gastroenteritis, induzieren Ausbrüche eine vorübergehende Immunität, bis ein neuer dominanter Stamm auftaucht, der nachfolgende Wellen von Ausbrüchen verursacht.[20][22]
Da diese mögliche Entwicklung eine Herausforderung für Impfstrategien darstellt, werden derzeit (2021) „universelle“ Impfstoffe entwickelt, die einen Schutz über einen bestimmten Serotyp hinaus bieten.
Schutz besonderer Personengruppen
Personen, die nicht wirksam geimpft werden können
Besondere Bedeutung besitzt Herdenschutz für Personen, die nicht mit ausreichender Wirksamkeit geimpft werden können, beispielsweise Personen mit Immunsuppression (Erkrankung des Immunsystems wie HIV-Infektion, Lymphom, Knochenmarkkrebs oder Leukämie; Chemotherapie oder Strahlentherapie; Einnahme von Immunsuppressiva nach Organtransplantation).[23][24][25][26] Daneben können Kontraindikationen zu einer mangelnden Immunität beitragen.[23][23][26][27] Die fehlende Immunität in diesen Personengruppen kann teilweise auch zu schwereren Krankheitsverläufen führen, die durch einen Herdeneffekt vermieden werden können.[23][26][27]
Personen, die noch nicht geimpft werden können
Beispielsweise können bei Neugeborenen Nebenwirkungen (vor allem von Impfstoffen mit lebenden Erregern) oder eine Unwirksamkeit durch passive Immunität von den Antikörpern der Mutter Gründe gegen die Verabreichung einzelner Impfstoffe sein.[14][23][28][29] Schwangere, die noch nicht vor Röteln durch Infektion oder Impfung geschützt sind, werden nicht mit den derzeit üblichen Kombinations-Impfstoffen gegen Röteln geimpft, weil diese lebende Erreger enthalten, deren Unbedenklichkeit für die Ungeborenen nicht gesichert ist. Dem Schutz solcher Schwangeren und ihrer Ungeborenen dient Herdenschutz ihrer Kontaktpersonen.
Schutz anderer Altersgruppen
Hohe Durchimpfungsraten in einer Altersgruppe können auch Personen in anderen Altersgruppen vor Erkrankung an diesem Krankheitserreger schützen,[30] beispielsweise ungeimpfte Säuglinge und Kleinkinder[30][26][31][32][33] oder ältere Menschen.[30][34]
Sexuell übertragbare Krankheiten
Hochrisikoverhalten beim Geschlechtsverkehr führt zu einer hohen Übertragungsrate (englisch transmission rate) der betreffenden Erreger, was die Eradikation von Geschlechtskrankheiten erschwert.[35][36] Bei Geschlechtskrankheiten kann sich der Herdeneffekt von einem Geschlecht auf das andere Geschlecht erstrecken.[35][37][36][38]
Eradikation

Im günstigsten Fall kann eine Krankheit so durch ausreichend hohe Impfquoten in einer Bevölkerung sogar ausgerottet (Eradikation) werden, d. h., der Krankheitserreger kommt endemisch nicht mehr vor. Die Eradikation von Infektionskrankheiten ist ein Ziel der Gesundheitspolitik.[30] Bei den Pocken wurde dies durch ein konsequentes, weltweites Impf- und Bekämpfungsprogramm erreicht, so dass 1980 die Welt von der WHO für pockenfrei erklärt werden konnte.[40] Gleiches wurde global inzwischen für Polio nahezu erreicht. Bei nachlassenden Impfbemühungen in den Nachbarländern kommt es zwar immer wieder zu Ausbrüchen der Poliomyelitis durch Re-Importe, so 2006 in Namibia.[41] Aber 2008 galten nur noch wenige Länder als endemisch für Polioviren (Nigeria, Indien, Pakistan, Afghanistan).[42] Die wegen Nebenwirkung der oralen Polioimpfung (OPV) mit abgeschwächten Erregern inzwischen bevorzugte Nadelimpfung mit inaktivierten Erregern (IPV) hat ihrerseits den Nachteil, dass sie keine sterile Immunität erzeugt, wie 2013 der Ausbruch einer Polio-Epidemie in Israel zeigte.[43]
Die globale Eliminierung der Masern, ebenfalls von der WHO als Ziel vorgegeben, konnte jedoch bislang nur auf den Kontinenten Amerika und Australien sowie in Skandinavien erreicht werden, da im Rest der Welt die Durchimpfungsraten zu gering sind. In der Folge brechen immer wieder lokale Masernepidemien aus, auch beispielsweise in Deutschland die regional begrenzten Masernepidemien in Hessen, Bayern, Baden-Württemberg und Nordrhein-Westfalen inklusive schwerer Komplikationen und Todesfälle in den Jahren 2005/2006.[44]
Negative epidemische Effekte
In der Regel bewirken hohe Durchimpfungsraten eine Herdenimmunität und einen Herdeneffekt. So sind weltweit große Populationen vor gefährlichen übertragbaren Infektionskrankheiten geschützt worden. Allerdings gilt auch für Impfstoffe die Erkenntnis des Pharmakologen Gustav Kuschinsky: „Ein Arzneimittel, von dem behauptet wird, daß es keine Nebenwirkungen habe, steht im dringenden Verdacht, auch keine Hauptwirkung zu besitzen.“[45] Nebenwirkungen von Impfungen sollen gemäß WHO gezielt erfasst und systematisch klassifiziert werden.[46] Zusätzlich zu individuellen Nebenwirkungen bei manchen Geimpften (beispielsweise Schmerzen an der Einstichstelle, Allergie gegen Bestandteile des Impfstoffes) sind auch Nebenwirkungen epidemischer Art bekannt. Das Robert Koch-Institut bezeichnet sie als „unerwünschte negative Effekte einer Impfstrategie auf Bevölkerungsebene“ und hat ihre Aufklärung zu einer seiner Aufgaben erklärt.[47] Zu den negativen epidemischen Effekten von Impfungen auf Bevölkerungsebene gehören beispielsweise:[47][11]
- Änderungen vorherrschender Serotypen (Serotypen-Replacement). Die Folge kann beispielsweise sein, dass die Wirksamkeit bisheriger Impfstoffe abnimmt.
- Altersverschiebungen der Krankheitslast. Dadurch kann beispielsweise die Wahrscheinlichkeit und/oder Schwere von Komplikationen der Infektionskrankheit zunehmen.
- Rückmutation attenuierter Lebendimpfstoffe. Sie kann zur Bildung humanpathogener Erreger in der geimpften Person und zur Infektion von Dritten durch diese Erreger führen.
- Änderungen vorherrschender Erreger-Species. Die häufiger gewordene Erreger-Art kann beispielsweise zusätzlich zum Menschen auch andere Lebewesen („hosts“) als Reservoire haben und sich insoweit der Eradikation entziehen.
Serotypen-Replacement
Durch Impfungen kann es zu einer Änderung der relativen und/oder absoluten Häufigkeit der Serotypen des Krankheitserregers kommen (engl. vaccine-induced pathogen strain replacement).[48] Soweit die Zunahme Serotypen betrifft, die nicht vom Impfstoff erfasst werden, kann der Effekt der Impfung geringer sein als aufgrund der Vakzine-Effektivität gegen die im Impfstoff enthaltenen Serotypen zu erwarten war.[49] Ein Serotypen-Replacement erfordert den Austausch oder eine Erweiterung der Antigene im Impfstoff. Ein bedeutendes Beispiel hierfür ist der Pneumokokkenimpfstoff.[49][50]
Altersverschiebungen der Krankheitslast
Durch den Herdeneffekt kann es zur Häufung von Personen in Teilpopulationen kommen, die selbst weder durch Infektion noch Impfung gegen die Erreger übertragbarer Infektionskrankheiten immun sind. Falls in diese Gruppe beispielsweise durch Reisen in Endemiegebiete oder Immigration aus solchen Gebieten Keimüberträger gelangen und der Herdeneffekt für diese Gruppe unzureichend ist, riskieren sie eine Erkrankung, die bisher als Kinderkrankheit üblich war.[6][51] Solche Altersverschiebungen sind beispielsweise für Masern dokumentiert. In höherem Alter werden Masern schwerer erkannt, sodass beispielsweise Masernpneumonien verspätet angemessen behandelt werden. Außerdem treten Masern bei Neugeborenen in der Zeit bis zur ersten Impfung (empfohlen zwischen dem vollendeten 11. und 14. Lebensmonat) etwas häufiger dann auf, wenn ihre Mütter gegen diese Erreger geimpft wurden, als wenn die Mütter die Masern als Infektion durchgemacht hatten, weil die über die Plazenta bewirkte Leihimmunität nach Impfung schneller abklingt als nach Infektion.[52]
Bei Mumps verläuft der Großteil der Infektionen bei Kindern ohne oder mit nur geringen Symptomen. In den letzten Jahren sind aber in Deutschland wie auch in vielen anderen europäischen Ländern vermehrt Mumps-Ausbrüche unter Jugendlichen und jungen Erwachsenen aufgetreten. In diesem höheren Alter wird die Symptomatik deutlicher, bei männlichen Erkrankten umfasst sie das Risiko der Sterilität durch Mumps-Orchitis.[53][51]
Auch bei Röteln kommt es mit zunehmendem Lebensalter der erkrankten Person häufiger zu Komplikationen.[54] Auch Windpocken und Hepatitis A treten dank regelkonformer Impfungen seltener im Kindesalter auf. Lässt der Herdeneffekt aber nach, werden nicht Geimpfte oft erst in höherem Alter infiziert. Dann kommt es durchschnittlich zu häufigeren und ernsthafteren Komplikationen als bei Kindern.[51]
Nach der Impfung gegen Keuchhusten treten zwar über die Plazenta Antikörper auf die Neugeborenen über. Die Pertussis-Antikörper allerdings schützen einerseits die Neugeborenen in den ersten beiden Monaten vor dann lebensgefährlichen Erkrankung, sie behindern andererseits (anders als gelegentlich Leihantikörper gegen Röteln) nicht den Aufbau eigener Antikörper als Reaktion auf die regelkonform ab dem Ende des zweiten Monats beginnenden Neugeborenen-Impfungen.[55][56]
Rück-Mutation attenuierter Lebendimpfstoffe
Das wichtigste Beispiel für diese Art von negativen Effekten von Bevölkerungsimpfungen ist die Rückmutation des Erregers im oralen Polio-Impfstoff (OPV) in eine wieder humanpathogene Variante, die dem Wild-Virus ähnelt und Erkrankungen Dritter durch dieses Virus (engl. circulating vaccine-derived poliovirus, cVDPV) hervorrufen kann. Die WHO empfiehlt daher, die „Schluckimpfung“ mit OPV schrittweise überlappend auf den inaktivierten Polioimpfstoff (IPV) umzustellen.
Zunahme anderer Erreger-Species
Durch die DTP-Impfungen wird mittlerweile die Mehrzahl der gemeldeten Diphtheriefälle in Westeuropa durch Corynebakterium ulcerans verursacht (Hautdiphtherie) und nicht mehr durch den bisher klassischen Diphtherie-Erreger C. diphtheriae (Rachendiphtherie).[57][58] C. ulcerans ist in der Lage, das Diphtherie-Toxin zu bilden und damit die systemischen Symptome der Erkrankung auszulösen. Zwar wirkt der übliche Diphtherieimpfstoff auch gegen C. ulcerans.[59] Aber C. ulcerans hat anders als C. diphtheriae sein Reservoir in Tieren (auch Haustieren), was seine Eradikation erschwert.
Probleme
Impfungen ohne Aussicht auf Herdenschutz
- Impfungen, die keine sterile Immunität hervorrufen. Dies ist beispielsweise von epidemiologischer Bedeutung bei Impfungen gegen bakterielle Toxine wie Diphtherie und Keuchhusten, bei der Nadelimpfung mit IPV gegen Kinderlähmung sowie auch gegen Covid-19.[60][61][62]
- Impfungen gegen Krankheitserreger, die außerhalb ihres Wirts überleben, beispielsweise das im Boden vorkommende Bakterium Clostridium tetani als Auslöser von Tetanus oder das von Zecken übertragene FSME-Virus. Schutz bietet hier nur die individuelle Prophylaxe.[13]
Impfmüdigkeit
Eine Gefahr für das Erreichen von Herdenschutz stellt insbesondere die Impfmüdigkeit dar. Impfkampagnen, die die notwendige Herdenimmunität nicht erreichen, können unter Umständen die Häufigkeit von Krankheitskomplikationen bei Nicht-Geimpften erhöhen. Wird ein zu geringer Anteil der Bevölkerung geimpft, senkt dies „nur“ die Wahrscheinlichkeit einer Ansteckung bei den Nicht-Geimpften, statt eine Infektion über Herdenschutz zu verhindern. Dies bedeutet, dass die Ansteckung, falls sie dann stattfindet, oft nicht mehr im Kindesalter erfolgt, was bei einigen Krankheiten, wie etwa Mumps, Röteln, Polio, Windpocken, gefährlicher ist. Beispielsweise wurde in Griechenland in den frühen 1990er Jahren von einer Zunahme der Fälle von Rötelnembryofetopathie berichtet, nachdem in den gesamten 1980er Jahren die Durchimpfungsrate unter 50 % lag.[63] Aus diesem Grund sollte jede Impfkampagne nicht nur einen Teilschutz der Bevölkerung anstreben, sondern auch Herdenschutz sicherstellen. Auch ist es wichtig, dass die Verantwortlichen, welche Impfkampagnen planen, mathematische und epidemiologische Modelle der Medizin verstehen.[64] In einer US-amerikanischen Studie erhöhte eine Aufklärung über den Herdeneffekt die Bereitschaft, sich gegen Influenza impfen zu lassen.[65] Bei Polio wird die Eradikation durch politisch bedingte Unruhen und Misstrauen gegenüber der modernen Medizin verzögert.[6][66] Eine Impfpflicht könnte die Eradikation beschleunigen.[67][68][69][70]
COVID-19-Pandemie
Die COVID-19-Pandemie nahm Ende 2019 in Wuhan durch ein bis dahin unbekanntes Virus SARS-CoV-2 ihren Ursprung. Die WHO erklärte die weltweite Verbreitung des Virus am 11. März 2020 zur „Gesundheitlichen Notlage internationaler Tragweite“. Das Virus wurde als hoch infektiös beschrieben. Da alle bisher nicht mit dem Virus in Kontakt gekommenen Menschen grundsätzlich anfällig für das Virus sind, entstanden so Bedingungen für eine schnelle und endemische Ausbreitung in der Gesellschaft. Infolgedessen verhängten viele Länder einen Lockdown, um die Ausbreitung des Virus zu verlangsamen und eine Überlastung des Gesundheitssystems zu verhindern.[71]
Herdenschutz als Folge von Infektion mit SARS-CoV-2 oder durch eine Impfung gegen diesen Erreger wurde erforscht, diskutiert und angestrebt.[72][73][74]
Viele Wissenschaftler beschrieben eine Herdenimmunität mit Hilfe einer Impfung als einzigen realistischen und ethisch verantwortbaren Weg, um die Pandemie zu beenden.[75][71] Ende Juli 2021 stellte das Robert Koch-Institut dazu fest: „Die Vorstellung des Erreichens einer ‚Herdenimmunität‘ im Sinne einer Elimination oder sogar Eradikation des Virus ist jedoch nicht realistisch.“[76]
Daneben gab es auch eine Debatte um einen durch natürliche Infektionen erworbenen Herdenschutz.[77]
Debatte um Herdenschutz durch natürliche Durchseuchung
Eine auf natürlichem Herdenschutz basierende Strategie zur Bekämpfung der COVID-19-Pandemie (wie z. B. in der Great Barington Declaration gefordert) wurde von vielen Wissenschaftlern abgelehnt, da sie zu hohe Risiken berge und viele vermeidbare Todesfälle verursache. Ihre Bedenken formulierten sie im Oktober 2020 im John Snow Memorandum. Ein Schutz durch Immunität könne auf ethisch vertretbare Weise nur durch einen Impfstoff erreicht werden, und bis dieser zur Verfügung steht, müssten Maßnahmen zur Eindämmung des Virus aufrechterhalten werden.[75] Auch die WHO sieht eine auf natürlicher Immunität basierende Strategie als wissenschaftlich problematisch und unethisch an.[78]
Der Epidemiologe Kin On Kwok betont darüber hinaus die Abhängigkeit der Schwelle, bei der ein Herdenschutz erreicht wird, von den getroffenen Interventionsmaßnahmen gegen das Virus. Werde der R0-Wert durch Interventionsmaßnahmen gesenkt, könnte sich Herdenschutz bereits bei niedrigen Durchseuchungsraten ausbilden. Der Herdenschutz verschwinde jedoch, sobald die Maßnahmen gelockert werden und sich die Übertragungsrate wieder erhöht.[75]
Im British Medical Journal wiesen Gesundheitsforscher im Dezember 2020 auf eine mögliche Unzuverlässigkeit der serologischen Antikörpernachweise hin und warnten davor, individuelle und politische Entscheidungen basierend auf einer möglicherweise inakkurat ermittelten Durchseuchungsrate zu treffen. Zudem wiesen sie auf die vielen komplexen Einflussgrößen hin, wodurch nicht genau bestimmt werden könne, ab wann Herdenschutz erreicht sei.[79]
Die Regierung des Vereinigten Königreichs unter Boris Johnson sprach sich anfänglich für eine Strategie des Herdenschutzes durch natürliche Durchseuchung aus. Nach Warnungen der Wissenschaft ließ sie aber davon ab.[80][81] Schweden wurde in Medienberichten ebenfalls zugeschrieben, eine solche Strategie des Herdenschutzes zu verfolgen; jedoch wurde dies in den Medien missverständlich dargestellt. Die schwedische Regierung verfolgte ähnlich wie andere Länder Strategien zur Eindämmung des Virus, die Maßnahmen basierten jedoch mehr auf Freiwilligkeit.[75]
Vermuteter natürlicher Herdenschutz in einzelnen Ländern
Die brasilianische Stadt Manaus wurde von der COVID-19-Pandemie schwer getroffen und wies eine hohe Übersterblichkeitsrate auf. Studien aus Brasilien vom September 2020 behaupteten, dass in Manaus über 66 % der Bevölkerung bereits mit dem Virus infiziert gewesen seien und es daher zum Herdenschutz gekommen sei, da die Fallzahlen sich im August entspannten. Einen später im September 2020 stattfindenden Anstieg der Fallzahlen hat der Immunologe Kristian Andersen als ein Indiz dafür bewertet, dass sich diese Hoffnung nicht bewahrheitet habe.[75] Als Mitursache für den Wiederanstieg der Fallzahlen wurde im Februar 2021 eine möglicherweise dem Immunsystem ausweichende Virusmutante vermutet.[82]
In Ischgl, wo sich das Virus anfangs unkontrolliert vermehrte, fanden Untersuchungen der Medizinischen Universität Innsbruck einen hohen Anteil (45,4 Prozent im November 2020) von Personen mit Antikörpern gegen SARS-CoV-2 und es wurde vermutet, dass in Kombination mit allgemeinen Hygienemaßnahmen ein Wiederanstieg der Fallzahlen Ende 2020 verhindert worden sei. Dieser „Schutzwall“ stehe jedoch durch neue Virusmutationen unter Druck.[83]
Es wird auch diskutiert, dass höhere Immunitätsraten einen Selektionsdruck erzeugen könnten, der impfresistente Mutanten begünstige.[84]
Weblinks
- Interaktive Simulation mit den Variablen Impfbereitschaft (Neugeborene) und Ansteckungsgefahr (Basisreproduktionszahl) von der Humboldt-Universität zu Berlin
- Infografiken, Animation und interaktive Simulation zur Herdenimmunitä am Beispiel Masern mit variabel einstellbarer Impfquote von der BZgA
- Lars Fischer: Infektionen bei Geimpften sicher verhindern. Spektrum.de, 7. Juli 2021.
- Mathias Tertilt: Herdenimmunität – Wann die Corona-Pandemie endet. Quarks.de, 9. Februar 2021, aktualisiert am 3. Mai 2021.
Einzelnachweise
- Wolfgang Kiehl: Infektionsschutz und Infektionsepidemiologie. Fachwörter – Definitionen – Interpretationen. Hrsg.: Robert Koch-Institut, Berlin 2015, ISBN 978-3-89606-258-1, S. 51, Stichwort Herdenschutz.
- Antworten des Robert Koch-Instituts und des Paul-Ehrlich-Instituts zu den 20 häufigsten Einwänden gegen das Impfen. Der Rückgang von Erkrankungen ist eine Folge verbesserter Hygiene und Ernährung und hat nichts mit Impfungen zu tun. In: RKI. 22. April 2016, abgerufen am 29. Juli 2021.
- Effektivität, Populationseffekte und Gesundheitsökonomie der Impfungen gegen Masern und Röteln. (PDF) RKI, 2013, abgerufen am 29. Juli 2021.
- Wolfgang Kiehl: Infektionsschutz und Infektionsepidemiologie. Fachwörter – Definitionen – Interpretationen. Hrsg.: Robert Koch-Institut, Berlin 2015, ISBN 978-3-89606-258-1, S. 51, Stichwort Herdenschutz.
- John T. Jacob, Samuel Reuben: Herd immunity and herd effect: new insights and definitions. In: Eur J Epidemiol., 2000, 16(7), S. 601–606, doi:10.1023/a:1007626510002, JSTOR 3582376
- Paul E.M. Fine, K. Eames, D. L. Heymann: “Herd immunity”: a rough guide. In: Clinical Infectious Diseases. Band 52, Nummer 7, April 2011, S. 911–916, doi:10.1093/cid/cir007, PMID 21427399.
- L. Gordis: Epidemiology. Elsevier Health Sciences, 14 November 2013, ISBN 978-1-4557-4251-6, S. 26–27 (Abgerufen am 29 March 2015).
- L. Gordis: Epidemiology. Elsevier Health Sciences, 14 November 2013, ISBN 978-1-4557-4251-6, S. 26–27 (Abgerufen am 29 March 2015).
- Wolfgang Kiehl: Infektionsschutz und Infektionsepidemiologie. Fachwörter – Definitionen – Interpretationen. Hrsg.: Robert Koch-Institut, Berlin 2015, ISBN 978-3-89606-258-1, S. 51, Stichwort Herdenschutz.
- C. Betsch, Jan Oude-Aost, Nicola Kuhrt: Fakten-Check Impfen. Gräfe und Unzer, München 2021, ISBN 978-3-8338-7772-8, S. 14.
- Paul E.M. Fine u. a.: Community Protection. In: Stanley A. Plotkin u. a.: Vaccines. 7. Ausgabe. 2017, ISBN 978-0-323-35761-6.
- J.P. Fox: Herd Immunity and Measles. In: Rev Infect Dis., 1983 May-Jun, 5(3), S. 463–466, PMID 6879000
- E.M. Paul: Fine: Herd Immunity – History, Theory, Practice. In: Epidemiol Rev., 29. Juli 1993, 15, S. 265–302, PMID 8174658, doi:10.1093/oxfordjournals.epirev.a036121
- History and Epidemiology of Global Smallpox Eradication. (Memento vom 15. Juli 2007 im Internet Archive; PDF; 1,5 MB) From the training course Smallpox: Disease, Prevention, and Intervention. CDC and WHO. Slide 16–17.
- Gregg N. Milligan, Alan D. T. Barrett: Vaccinology. Wiley, 2015, ISBN 978-1-118-63628-2, S. 313.
- A. McGirr, D. N. Fisman: Duration of pertussis immunity after DTaP immunization: a meta-analysis. In: Pediatrics. Band 135, Nummer 2, Februar 2015, S. 331–343, doi:10.1542/peds.2014-1729, PMID 25560446.
- Donald G. McNeil Jr.: Why Don’t We Have Vaccines Against Everything? The New York Times, 19. November 2018.
- Patsarin Rodpothong, Prasert Auewarakul: Viral evolution and transmission effectiveness. In: World Journal of Virology. Band 1, Nr. 5, 12. Oktober 2012, S. 131–134, doi:10.5501/wjv.v1.i5.131.
- Davide Corti, Antonio Lanzavecchia: Broadly Neutralizing Antiviral Antibodies. In: Annual Review of Immunology. Band 31, Nr. 1, 21. März 2013, S. 705–742, doi:10.1146/annurev-immunol-032712-095916.
- Rowena A. Bull, Peter A. White: Mechanisms of GII.4 norovirus evolution. In: Trends in Microbiology. Band 19, Nr. 5, Mai 2011, ISSN 0966-842X, S. 233–240, doi:10.1016/j.tim.2011.01.002.
- Sasirekha Ramani et al.: Epidemiology of human noroviruses and updates on vaccine development. In: Current Opinion in Gastroenterology. Band 30, Nr. 1, Januar 2014, S. 25–33, doi:10.1097/MOG.0000000000000022.
- Stephan Pleschka: Overview of Influenza Viruses. In: Swine Influenza (= Current Topics in Microbiology and Immunology). Springer, Berlin/Heidelberg 2013, ISBN 978-3-642-36871-4, S. 1–20.
- S. Cesaro, M. Giacchino, F. Fioredda, A. Barone, L. Battisti, S. Bezzio, S. Frenos, R. De Santis, S. Livadiotti, S. Marinello, A. G. Zanazzo, D. Caselli: Guidelines on vaccinations in paediatric haematology and oncology patients. In: BioMed research international. Band 2014, 2014, S. 707691, doi:10.1155/2014/707691, PMID 24868544, PMC 4020520 (freier Volltext)
- R. M. Wolfe: Update on adult immunizations. In: Journal of the American Board of Family Medicine: JABFM. Band 25, Nummer 4, 2012 Jul-Aug, S. 496–510, doi:10.3122/jabfm.2012.04.100274, PMID 22773718
- S. Esposito, S. Bosis, L. Morlacchi, E. Baggi, C. Sabatini, N. Principi: Can infants be protected by means of maternal vaccination? In: Clinical microbiology and infection: the official publication of the European Society of Clinical Microbiology and Infectious Diseases. Band 18 Suppl 5, Oktober 2012, S. 85–92, doi:10.1111/j.1469-0691.2012.03936.x, PMID 22862749
- D. Rakel, R. E. Rakel: Textbook of Family Medicine. Elsevier Health Sciences, 2015, ISBN 978-0-323-31308-7, S. 99, 187 (Abgerufen am 30 March 2015).
- T. H. Tulchinsky, E. A. Varavikova: The New Public Health: An Introduction for the 21st Century. Academic Press, 26. März 2014, ISBN 978-0-12-415767-5, S. 163–182 (Abgerufen am 30. März 2015).
- F. M. Munoz: Maternal immunization: an update for pediatricians. In: Pediatric annals. Band 42, Nummer 8, August 2013, S. 153–158, doi:10.3928/00904481-20130723-09, PMID 23910028.
- General recommendations on immunization – recommendations of the Advisory Committee on Immunization Practices (ACIP). In: MMWR. Recommendations and reports: Morbidity and mortality weekly report. Recommendations and reports. Band 60, Nummer 2, Januar 2011, S. 1–64, PMID 21293327.
- T. H. Kim, J. Johnstone, M. Loeb: Vaccine herd effect. In: Scandinavian journal of infectious diseases. Band 43, Nummer 9, September 2011, S. 683–689, doi:10.3109/00365548.2011.582247, PMID 21604922, PMC 3171704 (freier Volltext).
- L. F. Pittet, K. M. Posfay-Barbe: Pneumococcal vaccines for children: A global public health priority. In: Clinical Microbiology and Infection. 18 Suppl 5, 2012, S. 25–36. doi:10.1111/j.1469-0691.2012.03938.x. PMID 22862432.
- O. Nakagomi, M. Iturriza-Gomara, T. Nakagomi, N. A. Cunliffe: Incorporation of a rotavirus vaccine into the national immunisation schedule in the United Kingdom: A review. In: Expert Opinion on Biological Therapy. 13, Nr. 11, 2013, S. 1613–1621. doi:10.1517/14712598.2013.840285. PMID 24088009.
- B. A. Lopman, D. C. Payne, J. E. Tate, M. M. Patel, M. M. Cortese, U. D. Parashar: Post-licensure experience with rotavirus vaccination in high and middle income countries; 2006 to 2011. In: Current Opinion in Virology. 2, Nr. 4, 2012, S. 434–442. doi:10.1016/j.coviro.2012.05.002. PMID 22749491.
- T. H. Kim: Seasonal influenza and vaccine herd effect. In: Clinical and Experimental Vaccine Research. 3, Nr. 2, 2014, S. 128–132. doi:10.7774/cevr.2014.3.2.128. PMID 25003085. PMC 4083064 (freier Volltext).
- G. P. Garnett: Role of herd immunity in determining the effect of vaccines against sexually transmitted disease. In: The Journal of Infectious Diseases. Band 191 Suppl 1, Februar 2005, S. S97–106, doi:10.1086/425271, PMID 15627236.
- A. Lenzi, V. Mirone, V. Gentile, R. Bartoletti, V. Ficarra, C. Foresta, L. Mariani, S. Mazzoli, S. G. Parisi, A. Perino, M. Picardo, C. M. Zotti: Rome Consensus Conference – statement; human papilloma virus diseases in males. In: BMC Public Health. 13, 2013, S. 117. doi:10.1186/1471-2458-13-117. PMID 23391351. PMC 3642007 (freier Volltext).
- D. R. Lowy, J. T. Schiller: Reducing HPV-associated cancer globally. In: Cancer Prevention Research. 5, Nr. 1, 2012, S. 18–23. doi:10.1158/1940-6207.CAPR-11-0542. PMID 22219162. PMC 3285475 (freier Volltext).
- S. M. Garland, S. R. Skinner, J. M. Brotherton: Adolescent and young adult HPV vaccination in Australia: Achievements and challenges. In: Preventive Medicine. 53 Suppl 1, 2011, S. S29–35. doi:10.1016/j.ypmed.2011.08.015. PMID 21962468.
- F. Njeumi, W. Taylor, A. Diallo, K. Miyagishima, P. P. Pastoret, B. Vallat, M. Traore: The long journey: a brief review of the eradication of rinderpest. In: Revue scientifique et technique. Band 31, Nummer 3, Dezember 2012, S. 729–746, doi:10.20506/rst.31.3.2157, PMID 23520729.
- F. Fenner: The global eradication of smallpox. In: Med J Aust., 1980 Mai 17,1(10), S. 455. PMID 7412674
- Poliomyelitis in Namibia. In: WHO – Disease Outbreak News, 6. Juni 2006
- Polio situation worldwide in 2008 – update on the progress towards global eradication. In: Eurosurveillance, 2009 Apr 16;14(15), pii: 19178. PMID 19371512
- ECDC: Epidemiological update: Polio virus in sewage and human faecal samples in Israel, August 2013, online 20. August 2013, Abruf am 20. September 2019
- Masern im Jahr 2005 und Ausbrüche in Baden-Württemberg und Nordrhein-Westfalen in der ersten Hälfte des Jahres 2006. (PDF) Robert Koch-Institut: Epidemiologisches Bulletin, Nr. 27, 7. Juli 2006.
- Kein Medikament ohne Nebenwirkungen. Hrsg. Verband Forschender Arzneimittelhersteller e. V., online 1. Februar 2018, abgerufen am 10. Oktober 2019.
- Adverse Events Following Immunization (AEFI): Causality Assessment. (PDF) WHO, 2005, RHO Cervical Cancer – rho.org; abgerufen am 10. Oktober 2019.
- Methoden zur Durchführung und Berücksichtigung von Modellierungen zur Vorhersage epidemiologischer und gesundheitsökonomischer Effekte von Impfungen für die Ständige Impfkommission: Abs. 1.2.9: Indirekte Impfeffekte. (PDF; 1,5 MB) Robert Koch-Institut, Stand 16. März 2016
- Maia Martcheva u. a.: Vaccine-induced pathogen strain replacement: what are the mechanisms? In: J R Soc Interface, 2008 Jan 6, 5(18), S. 3–13, doi:10.1098/rsif.2007.0236, PMID 17459810, PMC 2405901 (freier Volltext)
- Wissenschaftliche Begründung zur Änderung der Pneumokokken-Impfempfehlung für Säuglinge. (PDF; 881 kB) Mitteilung der Ständigen Impfkommission (STIKO) am RKI, 7. September 2015
- Impfplan Österreich 2019, Version 1. (PDF) Sozialministerium der Republik Österreich, Stand Jänner 2019; abgerufen am 18. Oktober 2019.
- Manuel Battegay: Herdimmunität: Schütze deinen Nächsten – Impfe dich selbst. Vortrag im Kantonsspital St. Gallen, Mai 2003, infekt.ch (PDF; 2,1 MB)
- Pink Book – Measles. Centers for Disease Control and Prevention, 15. April 2019, abgerufen am 10. Oktober 2019, cdc.gov (PDF; 112 kB)
- Geänderte Impfempfehlung für Mumps. (PDF; 133 kB) In: Epidemiologisches Bulletin, 6. August 2012 / Nr. 31, Robert Koch-Institut
- RKI-Ratgeber Röteln, Stand 26. März 2018
- Centers for Disease Control and Prevention: Pregnancy and Whooping Cough, 28. September 2017, abgerufen am 10. Oktober 2019.
- Romesa Ibrahim u. a.: Impact of maternally derived pertussis antibody titers on infant whole-cell pertussis vaccine response in a low income setting. In: Vaccine, 2018 Nov 12; 36(46), S. 7048–7053, doi:10.1016/j.vaccine.2018.09.045, PMID 30297122, PMC 6219892 (freier Volltext)
- Diphtherie: Erkrankung durch toxigene Corynebacterium ulcerans nach Katzenkontakt – Fallbericht. (PDF; 123 kB) In: Epidemiologisches Bulletin, Robert Koch-Institut, 2011(27), S. 245–248.
- Hautdiphtherie: Zunahme von Infektionen mit Corynebacterium ulcerans. Deutsches Ärzteblatt, 15. März 2018, abgerufen am 4. November 2019.
- Lauren M. Weil: Notes from the Field: Conjunctivitis Caused by Toxigenic Corynebacterium ulcerans – Missouri, 2018. In: WHO Morbidity and Mortality Weekly Report (MMWR), 68(27), 12. Juli 2019, S. 615–616.
- Jennifer Juno, Adam Wheatley: Mounting evidence suggests COVID vaccines do reduce transmission. How does this work? Gavi, 11. Mai 2021 (“… immunisation with either the Pfizer or AstraZeneca vaccine reduced the chance of onward virus transmission by 40–60 %. This means that if someone became infected after being vaccinated, they were only around half as likely to pass their infection on to others compared to infected people who weren’t vaccinated.”)
- Lars Fischer: „Infektionen bei Geimpften sicher verhindern“. In: Spektrum.de, Medizin. 7. Juli 2021, abgerufen am 21. Juli 2021.
- Robert Koch-Institut: „Die Vorstellung des Erreichens einer Herdenimmunität im Sinne einer Elimination oder sogar Eradikation des Virus ist jedoch nicht realistisch.“ In: Vorbereitung auf den Herbst/Winter 2021/22 (PDF, 501 KB), 22. Juli 2021.
- Takis Panagiotopoulos, Ioanna Antoniadou, Eleni Valassi-Adam: Increase in congenital rubella occurrence after immunisation in Greece: retrospective survey and systematic review. In: BMJ, 319, 1999, S. 1462–1467.
- W. John Edmunds: Health professionals do not understand mathematical models. In: BMJ, 320, 2000, S. 581
- J. Logan, D. Nederhoff, B. Koch, B. Griffith, J. Wolfson, F. A. Awan, N. E. Basta: What have you HEARD about the HERD? Does education about local influenza vaccination coverage and herd immunity affect willingness to vaccinate? In: Vaccine. Band 36, Nummer 28, 06 2018, S. 4118–4125, doi:10.1016/j.vaccine.2018.05.037, PMID 29789242, PMC 6008254 (freier Volltext).
- K. A. Smith: Smallpox: can we still learn from the journey to eradication? In: The Indian journal of medical research. Band 137, Nummer 5, Mai 2013, S. 895–899, PMID 23760373, PMC 3734679 (freier Volltext).
- A. Perisic, C. T. Bauch: Social contact networks and disease eradicability under voluntary vaccination. In: PLoS Computational Biology. 5, Nr. 2, 2009, S. e1000280. doi:10.1371/journal.pcbi.1000280. PMID 19197342. PMC 2625434 (freier Volltext).
- F. Fu, D. I. Rosenbloom, L. Wang, M. A. Nowak: Imitation dynamics of vaccination behaviour on social networks. In: Proceedings of the Royal Society B: Biological Sciences. 278, Nr. 1702, 2011, S. 42–49. doi:10.1098/rspb.2010.1107. PMID 20667876. PMC 2992723 (freier Volltext).
- S. Wicker, H. C. Maltezou: Vaccine-preventable diseases in Europe: Where do we stand?. In: Expert Review of Vaccines. 13, Nr. 8, 2014, S. 979–987. doi:10.1586/14760584.2014.933077. PMID 24958075.
- E. Fukuda, J. Tanimoto: Impact of Stubborn Individuals on a Spread of Infectious Disease under Voluntary Vaccination Policy. Springer, 2014, ISBN 978-3-319-13359-1, S. 1–10 (Abgerufen am 30 March 2015).
- Nisreen A Alwan, Rochelle Ann Burgess, Simon Ashworth, Rupert Beale, Nahid Bhadelia: Scientific consensus on the COVID-19 pandemic: we need to act now. In: The Lancet. Band 396, Nr. 10260, Oktober 2020, ISSN 0140-6736, doi:10.1016/s0140-6736(20)32153-x, PMID 33069277, PMC 7557300 (freier Volltext).
- Gareth Davies: What is herd immunity and will it stop coronavirus in the UK? The Telegraph, 16. März 2020, abgerufen am 16. März 2020.
- Corona-Impfung: Wann sind genügend Menschen geimpft? In: ZDF, online 29. November 2020.
- Roy M. Anderson u. a.: Challenges in creating herd immunity to SARS-CoV-2 infection by mass vaccination. In: The Lancet, Band 396, Ausgabe 10263, 21. November 2020.
- Christie Aschwanden: The false promise of herd immunity for COVID-19. In: Nature. Band 587, Nr. 7832, 21. Oktober 2020, S. 26–28, doi:10.1038/d41586-020-02948-4.
- Robert Koch-Institut: Vorbereitung auf den Herbst/Winter 2021/22 (PDF; 501 KB), 22. Juli 2021.
- Fünf Gründe, warum Herdenimmunität vielleicht nie kommt – aber Impfen trotzdem hilft. spiegel.de, 26. März 2021.
- Coronavirus disease (COVID-19): Herd immunity, lockdowns and COVID-19. In: WHO. 31. Dezember 2020, abgerufen am 24. Februar 2021 (englisch).
- Nadav Davidovitch et al.: Natural herd immunity should not be used as a means of pandemic control. In: The BMJ. 17. Dezember 2020, abgerufen am 25. Februar 2021 (amerikanisches Englisch).
- U.K. resists coronavirus lockdowns, goes its own way on response. Washington Post, 16. März 2020, abgerufen am 16. März 2020.
- Johnson verzichtet auf die harte Tour. Tagesspiegel, 15. März 2020, abgerufen am 16. März 2020.
- Luke Taylor: Covid-19: Is Manaus the final nail in the coffin for natural herd immunity? In: BMJ. 12. Februar 2021, ISSN 1756-1833, S. n394, doi:10.1136/bmj.n394 (bmj.com [abgerufen am 23. Februar 2021]).
- Immunität gegen SARS-CoV-2 in Ischgl stabil. In: Deutsches Ärzteblatt. 18. Februar 2021, abgerufen am 24. Februar 2021.
- Christie Aschwanden: Fünf Gründe, warum Covid-Herdenimmunität wahrscheinlich unmöglich ist. In: spektrum.de. 30. März 2021, abgerufen am 1. April 2021.