Gespenstschrecken
Die Gespenstschrecken oder Phasmiden (Phasmatodea, Syn.: Phasmida) sind eine Ordnung pflanzenfressender Insekten. Oft wird die Ordnung, bezugnehmend auf die verschiedenen Körperformen, auch als Stab- und Gespenstschrecken angesprochen. Bereits in der im Jahre 1758 erschienenen 10. Auflage von Carl von Linnés „Systema Naturae“ wurden die ersten drei Arten zunächst unter dem Gattungsnamen Gryllus beschrieben. Bis März 2021 waren 3396 valide Arten beschrieben. Insbesondere seit Ende des 20. Jahrhunderts werden jährlich mehrere Arten entdeckt bzw. neubeschrieben.[1] Fast alle Vertreter leben in tropischen und subtropischen Gebieten, vor allem in der orientalischen Region, in Europa kommen 17 Arten vor.[2] Charakteristisch für die Gespenstschrecken ist ihre im Vergleich zu allen anderen Insektenordnungen überdurchschnittliche Größe und die oft bizarre, an Pflanzenteile erinnernde Körperform. Im Vergleich zu anderen Insekten mit ähnlicher Gestalt fällt die sehr kurze Vorderbrust (Prothorax) auf. Die Mittelbrust (Mesothorax) ist dagegen stets sehr lang. Zu den ursprünglichen Merkmalen der Phasmiden gehört auch das Vorhandensein von paarigen Wehrdrüsen, deren Öffnungen sich im Prothorax befinden.
| Gespenstschrecken | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Gespenstschrecken (Phasmatodea) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Phasmatodea | ||||||||||||
| Jacobson & Bianchi, 1902 | ||||||||||||
| Unterordnungen | ||||||||||||
|
Namensgebung

Den Namen Gespenstschrecken, vom wissenschaftlichen Namen Phasmatodea (griechisch: Phasma = Gespenst) abgeleitet, erhielten diese Insekten aufgrund ihres Aussehens. Je nach Körperform und Größe werden bestimmte Arten auch „Stabschrecken“, „Wandelnde Blätter“ oder „Wandelnde Äste“ genannt,[3] wobei nur die Wandelnden Blätter eine taxonomische Einheit bilden, nämlich die Phyllioidea. Vielfach werden die Gespenstschrecken in der deutschen Sprache auch „Stabheuschrecken“ oder „Gespenstheuschrecken“ genannt, obwohl als Heuschrecken üblicherweise nur Vertreter der Langfühlerschrecken (Ensifera) und der Kurzfühlerschrecken (Caelifera) verstanden werden. Letztendlich gehören Gespenstschrecken nicht einmal im wörtlichen Sinn zu den Schrecken (= Springer), da sie nicht springen können und zur Fortbewegung meist nur langsam laufen oder klettern.[3]
Die wissenschaftliche Bezeichnung der Ordnung lautet Phasmatodea und geht auf Jacobson und Bianchi 1902 zurück. Bis heute findet man besonders im englischen Sprachraum und im Amateurbereich die Bezeichnung Phasmida Leach, 1815, welche aber als falsche Ableitung des oben erwähnten Wortes Phasma gilt und in Phasmatodea korrigiert werden musste. Außerdem ist auch der 1915 von Crampton erstmals verwendete Name Cheleutoptera ein Synonym zu Phasmatodea.[1][4]
Besonders schwierig ist die Verwendung von Trivialnamen für einzelne Arten. Während im englischen Sprachraum meist sehr einheitliche Namen für die jeweiligen Arten verwendet werden, sind im Deutschen häufig Fantasienamen und Sammelbezeichnungen im Umlauf. So werden mit dem Namen „Riesengespenstschrecke“ verschiedene Arten bezeichnet, die häufig nur die Größe gemeinsam haben. Gleiches gilt für viele große stabförmige Arten, die meist als „Riesenstabschrecken“ angesprochen werden. Mit dem Namen „Dorngespenstschrecke“ ist in der Regel Eurycantha calcarata gemeint. Aber auch dieser Name wird gelegentlich für ganz andere Arten verwendet, so etwa für Heteropteryx dilatata, Aretaon asperrimus oder gar Extatosoma tiaratum. Ebenso problematisch kann die Verwendung von Landes- oder Regionsnamen in der Artbezeichnung sein, da in bestimmten Verbreitungsgebieten dutzende oder gar hunderte Arten vorkommen können.[5] Oft wird sehr oberflächlich mit der Zuordnung von Namen zu Arten oder höheren Taxa umgegangen. So geht beispielsweise aus dem Vergleich verschiedener Publikationen nicht hervor, ob mit „Baumhummer“ nur die Art Dryococelus australis gemeint ist oder ob auch andere Vertreter der Eurycanthini so angesprochen werden.[6][7]
Merkmale
Körperform, Färbung und Größe

Gespenstschrecken können extrem lange und dünne (Stabschrecken), blattartig verbreiterte (Wandelnde Blätter) oder anders geformte Körper haben. Mit ihrem Habitus ahmen sie fast immer Pflanzenteile, wie Rinde, Zweige, Äste oder Blätter in ihrer Umgebung nach (Phytomimese). Durch diese Tarnung sind sie insbesondere für ihre Fressfeinde nur schwer zu entdecken. Die Beine sind im Gegensatz zu denen der Heuschrecken nicht zu Sprungbeinen umgebildet, werden aber häufig in die Tarnung einbezogen. Der Körper ist oft mit Dornen, Stacheln oder Tuberkeln bedeckt. Die Grundfarbe von Gespenstschrecken ist meist braun oder grün, wobei neben allen Übergängen auch weiße, gelbe, rote, blaue und schwarze Körperzeichnungen auftreten können. Die Körperlänge von Gespenstschrecken-Arten kann zwischen 15 und 328 Millimetern betragen. Damit sind selbst die kleinsten Vertreter verglichen mit denen anderer Insektenordnungen relativ groß. Die bisher kleinste bekannte Art ist Miniphasma prima, von der bisher nur ein 17,5 Millimeter langes Weibchen bekannt ist. Die Männchen dürften noch etwas kleiner sein. Weitere klein bleibende Arten finden sich in den Gattungen Grylloclonia und Ommatopseudes.[8] Als längste Gespenstschrecke und damit auch als die längste rezente Insektenart galt bis 2014 die im Jahre 2008 von Philip Bragg beschriebenen Art Phobaeticus chani. Das beschriebene Weibchen dieser Art hat eine Körperlänge von 328 bzw. 357 Millimetern und eine Gesamtlänge von 570 bzw. 567 Millimetern (Angaben variieren je nach Quelle). Auch die Weibchen verschiedener anderer Phobaeticus-Arten erreichen über 300 Millimeter Länge. Die Männchen bleiben bei diesen Arten deutlich kleiner. Im Falle von Phobaeticus chani ist das beschriebene Männchen lediglich 132 Millimeter lang. Das größte bekannte Phasmidenmännchen, und somit auch das längste rezente männliche Insekt, ist Phryganistria heusii, bei welchem eine maximale Körperlänge von 250,5 Millimetern und eine Gesamtlänge von mehr als 470 Millimetern ermittelt wurde.[9][10][11]
2014 wurde vom chinesischen Forscher Zhao Li in der Region Guangxi ein Insekt mit einer Länge von 62,4 cm entdeckt und Phryganistria chinensis Zhao genannt.[12] Eine wissenschaftliche Beschreibung steht allerdings noch aus.
Kopf (Caput) und Fühler
Der Kopf der Phasmiden ist nach vorn gerichtet und meist so beweglich, dass nur er bei der Nahrungsaufnahme am Blattrand entlang bewegt wird, während der Körper in Ruhe verharrt. Ihre Mundwerkzeuge sind vom kauend-beißenden Typ. Diese sind charakterisiert durch je ein Paar Oberkiefer (Mandibeln) und ein Paar Unterkiefer (Maxillen), die von den Seiten her zugreifen. Unpaarig ist dagegen die Unterlippe (Labium) und die darüber liegende Zunge (Glossa) mit den beiden Nebenzungen (Paraglossae) sowie die Oberlippe (Labrum). Die Antennen sind, wie die aller Insekten, als Geißelantennen ausgebildet. Das erste Glied, welches als Basal- oder Schaftglied (Scapus) bezeichnet wird, besitzt als einziges Muskulatur. Es ist häufig verbreitert und deutlich von allen anderen Fühlergliedern zu unterscheiden. Das zweite, sogenannte Wendeglied (Pedicellus), ist zusammen mit allen anderen Gliedern (Flagellomere), die die Geißel bilden, gegenüber dem Scapus beweglich. Die Geißel kann in ihrer Länge und der Anzahl der Glieder sehr stark variieren. Das Spektrum reicht von sehr kurzen Antennen mit acht Gliedern bis hin zu langen Antennen mit etwa 100 Gliedern. Eine Ausnahme hinsichtlich des Fühlerbaus bilden die beiden Vertreter der Gattung Paragongylopus, deren Fühler aus nur drei Gliedern bestehen. Während die ersten beiden Glieder sehr klein sind, ist das dritte stark vergrößert.[13] Die Facettenaugen sind meist klein bis mittelgroß. Bei einigen Vertretern, insbesondere bei flugfähigen Männchen, sind zwischen diesen noch bis zu drei Einzelocellen zu finden (wie bei den Männchen der Wandelnden Blätter). Auf dem Kopf können sich verschiedenste Strukturen befinden. Häufig sind zwei Dornen oder Stacheln vorhanden, die wie Hörner wirken können. Sind es mehr als zwei, können sie wie regelrechte Dornenkronen erscheinen. Gelegentlich sind zwei senkrecht stehende, halbrunde, ohrförmige Strukturen, sogenannte Aurikel vorhanden.
Brust (Thorax) mit Flügeln
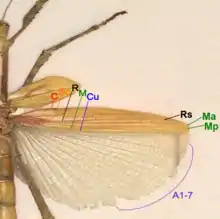
Die Vorderbrust (Prothorax) der Phasmiden ist stets sehr kurz. Dieses Merkmal ist so charakteristisch, dass andere phytomimetische Insekten, die ebenfalls stabförmig sind, auf den ersten Blick von den Phasmiden zu unterscheiden sind. So sind etwa die langgestreckten, stabförmigen Fangschrecken der Gattungen Thesprotia und Brunneria oder die ebenso gestalteten Kurzfühlerschrecken der Familie Proscopiidae (Pferdekopfschrecken) anhand der deutlich längeren Vorderbrust als Vertreter anderer Ordnungen zu erkennen. Im Prothorax befinden sich die Öffnungen der bei vielen Phasmiden voll funktionsfähigen Wehrdrüsen. Die Mittelbrust (Mesothorax) ist das mit Abstand längste Körpersegment. Auch die Hinterbrust (Metathorax) kann insbesondere bei stabförmigen Arten sehr lang sein.
Gespenstschrecken gehören zwar zu den Fluginsekten (Pterygota), bei denen die Imagines am Meso- und Metanotum je ein Paar Flügel haben, können aber auch ungeflügelt oder unvollständig geflügelt sein. Bei der Ausbildung der Flügel sind alle Varianten möglich. Sowohl die Vorder- als auch die Hinterflügel können reduziert sein oder vollständig fehlen. Sind Vorderflügel vorhanden, sind sie stets als Tegmina ausgebildet, also vollständig sklerotisiert und mit erkennbarer Aderung. Sie können sehr klein sein (wie z. B. bei Pseudophasma acanthonotum) oder auch so groß wie der Hinterleib (wie z. B. bei den Weibchen der Wandelnden Blätter). Wenn Hinterflügel (Alae) vorhanden sind, können sie ebenfalls reduziert sein und wie bei Hypocryrtus scythrus auch ohne das Vorhandensein von Vorderflügel ausgebildet sein. Vollständig ausgebildete Hinterflügel können komplett häutig, also wenig sklerotisiert sein. Häufiger sind die vorderen Felder (zwischen Costa und Cubitus) stärker sklerotisiert. Sie bedecken ähnlich den Elytren der Käfer das Abdomen. Ihr hinterer Bereich, das Analfeld, ist stets häutig und ermöglicht einigen Arten zu fliegen.
Die Flügel sind wie folgt aufgebaut: Die erste Längsader (Costa) ist unverzweigt und bildet den Außenrand (Vorderrand) der Hinterflügel. Sie fehlt an den Vorderflügeln. Die zweite Längsader (Subcosta) ist ebenfalls unverzweigt. Die dritte Längsader (Radius) verzweigt sich an den Hinterflügeln in Richtung Radialsector, bleibt aber an den Vorderflügeln unverzweigt. Die vierte Längsader verzweigt sich an der Basis zu zwei Längsadern, der Media anterior und der Media posterior. Die fünfte Längsader (Cubitus) ist wieder unverzweigt. Dahinter finden sich in den Vorderflügeln zwei Analadern und deutlich mehr in den Hinterflügeln. Dort sind die ersten sieben Adern in einer Gruppe angeordnet, alle restlichen in einer weiteren Gruppe. Dieser Flügelaufbau ist funktionell vergleichbar mit dem der Hemielytren der Wanzen. Sind Flügel vorhanden, können diese entweder zum Fliegen dienen, die Mimese ergänzen oder werden in die Feindabwehr miteinbezogen. Dabei können sie je nach Bau und Größe zur Abwehrstridulation genutzt werden oder sollen durch das Zeigen von grellen Farben oder das Vergrößern des Körperumrisses potentielle Feinde abwehren.
Hinterleib (Abdomen)
Der Hinterleib (Abdomen) besteht aus elf Gliedern, wobei das erste, Mediansegment genannte, immer mit dem letzten Brustsegment, dem Metathorax, verwachsen ist, was auf der Rückenseite in den meisten Fällen an einer Fuge zwischen dem Metanotum und dem ersten Abdominalsegment zu erkennen ist, während auf der Bauchseite eine nahtlose Verschmelzung vorliegt. Die Rückenplatte (Tergit) des elften Abdominalsegments kann stark zurückgebildet oder verlängert sein und wird Epiprokt oder Supraanalplatte genannt. Auf ihrer ventralen Seite haben die paarigen Paraprocten ihren Ursprung, neben welchen die Cerci entspringen. Die Cerci dienen als Tast- oder Klammerorgane bei der Paarung oder Eiablage. Bei den Männchen einiger Vertreter sind Dornenfelder auf dem ventralen Epiprokt oder zu Klammerorganen umgebildete, nach ventral gebogene Ränder der zehnten Rückenplatte zum Fixieren des Weibchens bei der Paarung vorhanden. Außerdem findet sich unter dem zehnten Tergum bei vielen Arten eine Platte mit nach hinten gerichtetem Haken (Vomer), welche zum Verankern am siebten Abdominalsternum des Weibchens dient. Das Abdomen besteht auf der ventralen Seite bei den Männchen aus nur neun und bei den Weibchen aus acht Bauchplatten (Sterna). Das achte Sternum der Weibchen ist oft vergrößert und wird als Subgenitalplatte oder Operculum bezeichnet. Es verdeckt die Geschlechtsorgane einschließlich des aus Anhängen des achten und neunten Abdominalsegments bestehenden Ovipositors. Der Ovipositor ist somit nicht wie bei den Langfühlerschrecken ein funktioneller Legestachel. Dieser wird bei vielen Arten als sekundärer Legestachel auf der Bauchseite aus dem Operculum und auf der Rückenseite entweder aus dem verlängerten Epiprokt (beispielsweise bei den Heteropteryginae) oder dem verlängerten zehnten Abdominaltergum (beispielsweise bei den Eurycanthini) gebildet.
Geschlechtsdimorphismus

Bei Phasmiden ist fast immer ein ausgeprägter Sexualdimorphismus anzutreffen. Häufig sind die Unterschiede im Habitus zwischen den Geschlechtern so groß, dass Männchen und Weibchen als unterschiedliche Arten, oft sogar in unterschiedlichen Gattungen beschrieben worden sind, so z. B. bei Phobaeticus serratipes geschehen. Die Männchen der Gespenstschrecken sind durchweg kleiner und schlanker als die Weibchen. Selbst bei Arten, bei denen die Geschlechter annähernd die gleiche Größe erreichen, sind eierlegende Weibchen noch deutlich am aufgedunsenen Hinterleib von den Männchen zu unterscheiden. Weitere Unterschiede bestehen oft auch in der Ausbildung der Flügel. Neben Arten mit identischer Flügelausbildung gibt es hier solche, bei denen die Weibchen keine oder stark reduzierte Flügel haben, während die Männchen derselben Art Flügel haben können. Diese können nicht nur größer sein, sondern teilweise sogar das Fliegen ermöglichen. Insbesondere eierlegende Weibchen sind dazu selbst bei voll entwickelten Flügeln fast nie in der Lage. Auch die Färbung kann sehr unterschiedlich sein. Die Nymphen besonders stark geschlechtsdimorpher Arten ähneln meist stärker den Weibchen. Die Männchen zeigen die für ihr Geschlecht typische Färbung meist erst nach der Häutung zur Imago.
Lebensweise
Ernährung
Alle Gespenstschrecken sind phytophag, also Pflanzenfresser. Während es zum einen monophage Arten gibt, die auf bestimmte Pflanzenarten oder -gruppen spezialisiert sind, wie die auf Farne angewiesene Farn-Stabschrecke (Oreophoetes peruana), sind andere sehr unspezialisiert und gelten als polyphage Pflanzenfresser. Zur Nahrungsaufnahme wandeln sie meist nur träge auf den Nahrungspflanzen umher. Vorwiegend sind sie nachtaktiv. Tagsüber bleiben sie am gleichen Ort und verstecken sich in den Nahrungspflanzen oder am Boden in der Laubschicht.[3]
Passive Verteidigung
Die Hauptstrategie bei der Feindabwehr besteht bei den meisten Arten in der Tarnung, genauer in der Nachahmung von toten oder lebenden Pflanzenteilen (Phytomimese). Neben Körperbau und Färbung hat sich bei vielen Arten auch ein entsprechendes Verhalten entwickelt. So verharren viele Arten selbst bei Berührung und unternehmen keine Flucht- oder Gegenwehrversuche. Andere schaukeln bei der Fortbewegung, bei aufkommendem Wind oder Berührung hin und her, um dadurch sich im Wind bewegende Pflanzenteile nachzuahmen. Einige Gespenstschrecken sind in der Lage, durch Hormonausschüttungen ihre tagsüber hellere Farbe in der Nacht in eine dunklere zu ändern (physiologischer Farbwechsel). Durch die Wirkung der Hormone können sich orange-rote Farbkörnchen in den Farbzellen der Haut zusammenballen beziehungsweise ausdehnen und erzeugen dadurch den Farbwechsel. Viele Vertreter lassen sich einfach mit längs angelegten Beinen fallen und verharren dann in dieser Schreckstarre am Boden, wo sie zwischen anderen Pflanzenteilen schwer zu erkennen sind. Andere lassen sich ebenfalls fallen und laufen dann am Boden angekommen schnell davon.

Um Fressfeinden zu entkommen, können viele Arten einzelne Extremitäten an dafür vorgesehenen Bruchstellen zwischen Schenkel und Schenkelring abwerfen (Autotomie) und diese bei den nächsten Häutungen fast vollständig ersetzen (Regeneration). Vor allem bei Stabschrecken, insbesondere bei deren Nymphen, ist dieses Verhalten zu beobachten.[3]
Abwehrverhalten
Zu den Merkmalen der Gespenstschrecken gehört das Vorhandensein von Wehrdrüsen. Arten mit funktionsfähigen Wehrdrüsen versprühen ihr Wehrsekret durch Öffnungen im Prothorax, die sich oberhalb der Vorderbeine befinden. Das Sekret kann entweder stark und meist unappetitlich riechen oder sogar sehr aggressive chemische Substanzen enthalten. Meist sind es kaum getarnte, teilweise tagaktive Arten, die über die wirkungsvollsten Sekrete verfügen. Ihre oft auffällige Färbung ist dann auch eher als Warntracht zu verstehen. Besonders Vertreter der Familie Pseudophasmatidae haben aggressive Sekrete, die oft ätzend wirken und insbesondere die Schleimhäute angreifen. Teilweise wurden die enthaltenen Substanzen nach den sie produzierenden Gespenstschrecken benannt, wie etwa Anisomorphal nach der Gattung Anisomorpha oder Peruphasmal nach der Gattung Peruphasma.
Neben der Körperfarbe warnen oder erschrecken einige Arten ihre Angreifer auch, indem sie ihre Flügel aufspannen, um größer zu erscheinen oder Warnfarben zu zeigen. Andere erzeugen Geräusche (Abwehrstridulation) mit den Flügeln oder den Fühlern. Eine andere verbreitete Strategie größerer, meist gut bedornter Arten (z. B. Eurycanthini, Extatosomatinae und Heteropteryginae) ist das Schlagen mit den Beinen nach Feinden. Dazu strecken die Tiere ihre Hinterbeine aufgeklappt in die Luft und verharren, bis sich der Feind nähert. Dann schlagen sie Schenkel und Schienen ihrer Hinterbeine zusammen. Diesen Vorgang wiederholen sie in unregelmäßigen Abständen, bis der Feind aufgibt oder eingeklemmt wurde, was durch die Dornen der Hinterbeine recht schmerzhaft sein kann.[14]
Fortpflanzung und Entwicklung
Fortpflanzungsstrategien

Ein großer Teil der Gespenstschreckenarten ist neben der geschlechtlichen Fortpflanzung auch zur Jungfernzeugung fähig (fakultative Parthenogenese).[3] Sie sind also nicht zwingend auf Männchen angewiesen, da eine Befruchtung nicht erforderlich ist. Bei der automiktischen Parthenogenese wird der durch die Meiose zwischenzeitlich haploide Chromosomensatz der Eizelle wieder verdoppelt (z. B. bei Leptynia-Arten und einigen Arten der Gattung Bacillus). Während bei der apomiktische Parthenogenese die Eizellen durch eine mitotische Teilung erzeugt werden (z. B. bei Timema-Arten und einigen anderen Bacillus-Arten). Die Jungfernzeugung wird in der Natur von den meisten Arten lediglich genutzt, wenn geschlechtsreife Weibchen gerade keine Männchen finden. Aus den unbefruchteten Eiern schlüpfen dann fast immer Weibchen. Durch die höhere Zahl der weiblichen Nachkommen wird die Wahrscheinlichkeit erhöht, in der nächsten Generation Männchen zu finden oder von einem Männchen gefunden zu werden. Zur Erhaltung der Art in einem bestimmten Teil des Verbreitungsgebietes wird also lediglich ein Zeitraum überbrückt, in dem hier keine oder nicht genug Männchen zur Verfügung stehen.
Bei einigen, wenigen Arten wird von einer obligatorischen Parthenogenese ausgegangen, also einer rein parthenogenetischen Fortpflanzung. Trotzdem können sich aus den unbefruchteten Eiern dieser Arten gelegentlich Tiere entwickeln, die dem Phänotyp nach Männchen sind und teilweise auch funktionsfähige Geschlechtsorgane haben. Da die Geschlechtsdetermination der meisten Gespenstschrecken durch das XX/X0-System erfolgt, führen Non-Disjunctions der Gonosomen XX bei der Bildung der Eizellen zur Entstehung von Weibchen mit trisomalen X-Chromosomen (XXX) und Männchen mit einem X-Chromosom (X0). Bei diesen parthenogenetisch entstandenen Männchen sind phänotypisch alle Zellen männlich. Da sie aber genotypisch aufgrund der Chromosomenverteilung nicht identisch mit echten Männchen sind, sind diese intersexuellen Männchen zwar fertil, bringen allerdings keine männlichen Nachkommen hervor.[15] So treten beim Großen Wandelnden Blatt (Phyllium giganteum)[14][16] oder bei der Indischen Stabschrecke (Carausius morosus) gelegentlich Männchen auf, die aber trotz Paarung nicht zu einem anderen, höheren Anteil an Männchen in der Nachkommenschaft führen. Von vielen Arten sind bisher nur Weibchen bekannt. Es wird davon ausgegangen, dass sich unter diesen ebenfalls einige finden, die auch in der Natur rein parthenogenetisch auftreten. Unter den Vertretern mit obligatorischer Parthenogenese sind vermehrt Arten mit polyploiden, meist triploiden Chromosomensätzen zu finden.
Neben der Parthenogenese findet bei einigen Vertretern der Gattung Bacillus auch Hybridogenese statt. Da die entstehenden Exemplare quasi einen Chromosomensatz der Elternart „gestohlen“ haben, werden sie auch nicht als Art, sondern als Klepton (Partizip neutrum zu griech. κλέπτω – klepto = stehlen) bezeichnet. Dies äußert sich entweder in der Abkürzung „kl.“ zwischen dem wissenschaftlichen Gattungs- und Artnamen oder alternativ durch ein in Anführungszeichen gesetztes Artepitheton, etwa Bacillus kl. whitei oder Bacillus „whitei“. Oft werden in Ermangelung eines anderen Namens beide Elternarten bzw. Unterarten im Namen durch einen Bindestrich verbunden aufgeführt, so bei Bacillus kl. rossius-grandii benazzi. Bei einigen dieser Kleptons finden sich außerdem noch Androgenese (Eizelle ohne Chromosomensatz wird durch verdoppelten Chromosomensatz des Spermiums aufgefüllt) oder Gynogenese (in haploider Eizelle erfolgt Verdopplung des Chromosomensatzes). Beide Formen führen zu hoher Sterblichkeit bei den Jungtieren.[5]
Partnersuche und Paarung
Bei der Partnersuche sind die kleineren und wendigeren Männchen aktiver als die Weibchen. Bei vielen, im männlichen Geschlecht geflügelten Arten fliegen diese sogar zu diesem Zweck umher. Zur Orientierung dienen dabei oft Duftstoffe, denen die Männchen folgen. Ist ein Weibchen gefunden, findet die Paarung statt. Dazu steigt das Männchen auf das Weibchen, wobei es oft das hintere Abdomen des Weibchens mit den zangenförmigen oder klammerartigen Cerci oder dem Vomer beziehungsweise anderen Strukturen fixiert. Dann schiebt das Männchen seine äußeren Geschlechtsorgane unter die Subgenitalplatte des Weibchens. Dort wird ein oft rundlicher, mit einer Ableitungsröhre versehener Samenträger (Spermatophore) deponiert, welcher erst nach seiner Entleerung abgeworfen wird. Die darin enthaltenen Spermien werden vom Weibchen in der Samentasche (Receptaculum seminis) bis zur Befruchtung des jeweils heranreifenden Eies gespeichert. Bei manchen Arten, wie den Vertretern der Gattungen Anisomorpha und Peruphasma, lassen sich die Männchen über Wochen oder gar den Rest ihres Lebens von den Weibchen tragen. Dieses als Mate Guarding (engl.: mate = Partner, guarding = bewachen) bezeichnete Verhalten dient dazu, nach der Kopulation anderen Männchen eine weitere Paarung mit dem Weibchen zu erschweren oder unmöglich zu machen. Außerdem sind wiederholte oder entsprechend langandauernde Begattungen beobachtet worden. Bei Anisomorpha paromalus (Syn. Anisomorpha monstrosa) und Malacomorpha guamuhayaense wurden Männchen bei Paarungen mit subadulten Weibchen beobachtet, die nach deren Imaginalhäutung noch einige Zeit weiter mit der Exuvie kopulierten. Gelegentlich versuchen sich auch mehrere Männchen mit einem Weibchen zu paaren. Daneben treten insbesondere bei Vergesellschaftung mehrerer Arten in Terrarien immer wieder Fehlpaarungen auf, bei denen Männchen artfremde Weibchen zu begatten versuchen.[17]
Eier und Eiablage

.jpg.webp)
Die Eier der Gespenstschrecken unterscheiden sich meist so stark voneinander, dass sie zur Bestimmung der Arten teilweise besser geeignet sind als die Tiere selbst. Diese Tatsache wurde schon von John Parkinson honoriert, der bereits bei der Erstbeschreibung der Malaiischen Riesengespenstschrecke als Phasma dilatatum (heute Hetropteryx dilatata) im Jahre 1798 deren Ei mitabbildete. Damit war er der Erste, der die Strukturen eine Phasmideneis detailliert darstellte. Nach ihm beschäftigte sich auch Johann Jakob Kaup eingehender mit diesem Thema und legte mit ersten vergleichenden Betrachtungen die Grundlage für die heutige Ootaxonomie, einem Zweig der speziellen Zoologie, der die Eier insbesondere zur Bestimmung (Determinierung) der Arten heranzieht.[18]
Phasmideneier ähneln oft Pflanzensamen oder dem Kot der Tiere und sind auf oder im Erdboden nur schwer zu entdecken. Die äußere Hülle, das Exochorion, hat in der Regel eine sehr charakteristische Form, Farbe und Oberfläche. Sie kann glatt, porös, stumpf, behaart oder strukturiert sein. Die vorherrschenden Farben sind schwarz und eher unauffällige Grau-, Beige- und Brauntöne. Auf der dorsalen Seite der Eier ist die arttypisch geformte Mikropylarplatte zu finden. Auf dieser liegt die Mikropyle, eine punktförmige Stelle, welche der Eintrittsstelle des Spermiums entspricht und bei ausgehärteten, also bereits abgelegten Eiern dem Gasaustausch dient. Am vorderen Pol der Eier sitzt ein Deckel (Operculum), welcher von der Nymphe beim Schlüpfen aufgedrückt wird. Auf diesem wiederum sitzt bei den Eiern vieler Arten ein mehr oder weniger auffälliges Capitulum.[14] Die Länge der Eier wird vom Operculumrand zum gegenüber liegenden Pol gemessen. Die Breite wird in der Dorsal- und die Höhe in der Lateralansicht ermittelt. Steht das Operculum nicht im rechten Winkel zur Längsachse, sondern sitzt schräg auf dem Ei, wird diese Abweichung als Opercularwinkel bezeichnet und kann ebenfalls zur Artbestimmung herangezogen werden.[19]
Die größten bekannten Gespenstschreckeneier werden von den Vertretern der Unterfamilie Heteropteryginae produziert. Speziell die Eier von Haaniella echinata sind mit einer Länge von bis zu zwölf Millimetern und einem Gewicht von knapp 0,3 Gramm die größten Phasmideneier. Die nur knapp zehn Zentimeter langen Weibchen von Asceles malaccae legen Eier, die mit bis zu 15 Millimetern zwar noch etwas länger werden, diese haben aber nur etwa zwei Millimeter Durchmesser. Die Länge kommt zum einen durch das fast zwei Millimeter hohe, spitze Capitulum, zum anderen aber durch die noch deutlich längere Spitze am unteren Ende des Eies zustande. Mit dieser Spitze werden die Eier in Pflanzenteile eingestochen. Längliche, schlanke und spitze Eier werden auch von anderen Vertretern oft in Pflanzenteile wie Blätter oder auch Borke gestochen. Dabei sind die Eier, welche in Borke abgelegt werden, oft besonders stabil und meißelartig verstärkt. Bei der Fixierung solcher Eier wird das Ei mittels des Abdomens regelrecht in die Borke hineingeschlagen. Bei Arten wie Necroscia annulipes ist dies akustisch als Klopfen wahrnehmbar. Andere Arten kleben ihre Eier einzeln oder in Gruppen an Pflanzenteilen fest. Gelege, die als kompakte Eipakete, also als Oothek, abgelegt werden, sind nur von sehr wenigen Arten bekannt. Die bei weitem meisten Vertreter lassen ihre Eier aber einfach zu Boden fallen oder schleudern sie mit dem Abdomen davon. Dabei werden die Eier jeweils einzeln abgelegt. Unter den Vertretern, die mittels eines Legebohrers (Ovipositor) die Eier in den Boden ablegen (z. B. Heteropteryginae, Obriminae und Eurycanthini), gibt es solche, die mehrere Eier zusammen ablegen, also regelrechte Gelege vergraben.[18]
Einige Gespenstschrecken legen Eier, die in auffallender Weise Pflanzensamen mit Elaiosomen ähneln. Die Capitula dieser Eier üben auf Ameisen die gleiche Anziehungskraft wie die Elaiosomen aus. Die südafrikanische Gespenstschrecke Phalces brevis (Syn. Phalces coccyx) kommt häufig im Heideland der östlichen Kapprovinz vor, in dem myrmekochore Pflanzen vorherrschen. Ameisen unterscheiden nicht zwischen Elaiosomen und Capitula und tragen Samen und Eier in gleicher Weise in ihre Nester, wo die Capitula ebenso wie die Elaiosomen verzehrt werden, ohne die Eier zu beschädigen.[20] Auch die wie Pflanzensamen aussehenden Eier der Gattung Extatosoma werden von den Feuerameisen der Gattung Leptomyrmex eingesammelt und in die Speicherkammern des Ameisennestes gebracht. Sehr wahrscheinlich wird auch hier das Capitulum der Eier verzehrt. Durch das Klima in diesen Bauten können sich die Nymphen sehr gut entwickeln und schlüpfen dort aus. In den ersten zwei bis drei Tagen ist ihr Körper schwarz und der Kopf rot. So sehen sie den Feuerameisen sehr ähnlich und können unversehrt den Ameisenbau verlassen.[21]
Die Produktivität der einzelnen Arten ist sehr unterschiedlich und steht oft im umgekehrten Verhältnis zur Lebenserwartung. So legen die meist sehr langlebigen Vertreter der Unterfamilie Dataminae oft nur ein bis zwei Eier pro Woche. Die produktivsten Arten sind nicht nur deutlich kurzlebiger, sondern legen verglichen mit der Körpergröße auch wesentlich kleinere Eier. Mit bis zu 2500 Eiern, bei zeitweise 21 Eiern am Tag, finden sich hier Vertreter der Familie Phasmatidae wie etwa Acrophylla titan, Anchiale briareus und Hermarchus leytensis.[18]
Entwicklung


Gespenstschrecken sind hemimetabole Insekten. Die Entwicklungsdauer der Embryos im Ei beträgt je nach Art etwa drei bis zwölf Monate, in Ausnahmefällen bis zu drei Jahren. Die Nymphen wachsen in drei bis zwölf Monaten zu adulten Insekten heran. Besonders bei bunten Arten unterscheiden sie sich in ihrer Färbung oft von ihren Eltern. Dabei zeigen Arten ohne oder mit weniger aggressivem Wehrsekret die leuchtenden Farben der Eltern oft erst nach der Imaginalhäutung, wie etwa bei Paramenexenus laetus oder Mearnsiana bullosa zu beobachten. Wehrhafte Arten, deren Nymphen schon über funktionstüchtige Wehrdrüsen verfügen, wie die Farn-Stabschrecke (Oreophoetes peruana) oder die Samtschrecke (Peruphasma schultei), zeigen schon früh eine den Eltern ähnelnde Warnfärbung. Weibchen häuten sich während des Heranwachsens sechsmal, während die Männchen bereits nach fünf, seltener schon nach vier Häutungen (z. B. bei den Wandelnden Blättern) adult sind. Nach der Häutung wird die Haut insbesondere wegen der darin enthaltenen Spurenelemente verzehrt.
Die Festlegung des Geschlechts (Geschlechtsdetermination) erfolgt wie bei allen Insekten als Vorgang, der während der Embryogenese in jeder Zelle unabhängig abläuft (zellautonom). So können sich gelegentlich Tiere entwickeln, bei denen Bereiche mit männlichen und weiblichen Zellen mosaikartik im Körper verteilt sind. Unter diesen selten auftretenden Gynandern oder Mosaikzwittern finden sich häufig die Merkmale des Männchens in der einen und die des Weibchens in der andern Körperhälfte konzentriert. Derartige Tiere werden als Halbseitenzwitter oder Halbseitengynander bezeichnet. Sie haben stets eine geringere Lebenserwartung als Männchen oder Weibchen der jeweiligen Art. Gynander sind dokumentiert für die Indische Stabschrecke (Carausius morosus), die Malaiische Riesengespenstschrecke (Heteropteryx dilatata), die Farn-Stabschrecke (Oreophoetes peruana), die Kleine Dornschrecke (Aretaon asperrimus), die Australische Gespenstschrecke (Extatosoma tiaratum), die Wandelnde Bohne (Diapherodes gigantea), die Vietnam-Stabschrecke (Ramulus artemis), die Gallische Mittelmeerstabschrecke (Clonopsis gallica), das Große Wandelnde Blatt (Pulchriphyllium giganteum) sowie für Pulchriphyllium bioculatum, Cryptophyllium westwoodii, Trolicaphyllium sarrameaense, Ocnophiloidea regularis und Tropidoderus childrenii.
Bei den Phasmiden leben die erwachsenen Weibchen im Durchschnitt deutlich länger als die Männchen, nämlich zwischen drei Monaten und einem Jahr. Die Männchen werden meist nur drei bis fünf Monate alt; die einiger Wandelnder Blätter leben nur einen knappen Monat. Das höchste registrierte Alter erreichte ein Wildfangweibchen von Haaniella scabra aus Sabah, das Oskar V. Conle mehr als fünf Jahre hielt. Überhaupt sind viele Vertreter der Familie Hetropterygigae ausgesprochen langlebig.[5][14][16][18]
Verbreitung und Lebensräume
Gespenstschrecken sind in allen tropischen und subtropischen Gebieten der Erde zu finden. Die größte Artenvielfalt erreichen sie in der orientalischen Region mit etwa 1.500 bekannten Arten, gefolgt von der Neotropis mit über 1.000 Arten und der Australis mit mehr als 440 Arten. Im restlichen Verbreitungsgebiet nimmt die Anzahl der Arten von Madagaskar über Afrika und die Nearktis zur Paläarktis hin ab. Im Mittelmeerraum und in Vorderasien sind nur wenige Arten beheimatet. Lediglich im Gebiet der Großen Seen in Nordamerika kommen Gespenstschrecken nördlich des 45. Breitengrades natürlich vor. Allerdings gibt es in England einige Populationen, die auf entwichene Terrarientiere zurückgehen. So konnten im milden englischen Klima Acanthoxyla prasina, Clitarchus hookeri, die Mittelmeerstabschrecke (Bacillus rossius) und die Indische Stabschrecke (Carausius morosus) überleben.[18]
In Südeuropa kommen die Spanische Stabschrecke (Pijnackeria hispanica), die Gallische Mittelmeerstabschrecke (Clonopsis gallica), vier Arten der Gattung Leptynia, sowie sechs Arten der Gattung Bacillus, z. B. die Mittelmeerstabschrecke (Bacillus rossius), natürlich vor.[2]
In Habitaten mit üppiger Vegetation gibt es die größte Artendichte. An erster Stelle sind hier Wälder und von diesen besonders die verschiedenen Formen der tropischen Regenwald zu nennen. In trockneren Gebieten nimmt die Artenzahl ebenso ab wie in höheren und dadurch kühleren Regionen. Das höchste Verbreitungsgebiet bewohnen die Vertreter der Gattung Monticomorpha. So ist Monticomorpha flavolimbata auf dem ecuadorianischen Vulkan Cotopaxi noch in 5.000 Metern Höhe nahe der Schneefallgrenze zu finden.[5][18]
Systematik
Äußere Systematik
Die Stellung der Phasmatodea innerhalb der Überordnung der Neuflügler (Neoptera) ist teilweise umstritten. Sie werden in dieser Überordnung zwar stets den Polyneoptera, einer systematisch noch nicht geklärten Gruppe zugeordnet. Ihre Einordnung in diese Gruppe wird durch jüngere, auf Genanalysen basierende Untersuchungen gestützt und konkretisiert. So ergeben sich nach Misof et al. (2014) folgende verwandtschaftliche Verhältnisse, nach welcher die Schwestergruppe der Gespenstschrecken die der Tarsenspinner (Embioptera) ist und die Notoptera mit den Gladiatorschrecken (Mantophasmatodea) und den Grillenschaben (Grylloblattodea) in deren gemeinsame Verwandtschaft zu stellen sind:[22]
| Polyneoptera |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Die von Oliver Zompro in der Vergangenheit vorgeschlagene Abspaltung der Timemas (Timematodea) von den Phasmatodea wird allgemein nicht anerkannt.[23][1][24]
Innere Systematik

Familie Timematidae


.jpg.webp)
Familie Agathemeridae






(Extatosoma tiaratum), ♂
Familie Phasmatidae,
Unterfamilie Extatosomatinae

Familie Phasmatidae,
Unterfamilie Phasmatinae
Die Systematik der Gespenstschrecken unterliegt häufigen Änderungen und ist teilweise sehr umstritten. In der klassischen Taxonomie wurden die Vertreter der Euphasmatodea in die Teilordnungen der Areolatae und der Anareolatae eingeteilt. Die Vertretern der Areolatae haben an den distalen Innenseiten der Mittel- und Hinterschienen (Tibien) eine dreieckige Vertiefung, die die Area apicalis. Diese fehlt den Anareolatae. Bei der Unterteilung in diese beiden Teilordnungen wurde davon ausgegangen, dass es sich dabei um ein ursprüngliches Merkmal handelt. Da dem nicht so ist, wurde diese Einteilung aufgegeben und die Teilordnungen mit den Euphasmatodea synonymisiert. Weitere Veränderungen in der Systematik der Ordnung sind unter anderem darin begründet, dass ständig neue Arten und weitere Taxa beschrieben werden. Durchschnittlich gab es seit dem Ende des 20. Jahrhunderts einige Dutzend Neubeschreibungen pro Jahr. Gleichzeitig werden aber viele Arten oder Taxa als synonym erkannt und wieder eingezogen. Die unter anderem daraus resultierenden Erkenntnisse schlagen sich in häufigen Revisionen nieder.[23][25][26] Seit etwa 2014 dominieren auf genanalytische Untersuchung basierende Arbeiten.[22] Die hier bis auf Tribus-Ebene dargestellte Systematik folgt dem Phasmida Species File Online (Stand März 2021). Weiterhin wurde die fossile und deshalb mit „†“ gekennzeichnete Familie Archipseudophasmatidae ergänzt:[1]
Synonyme zu Phasmatodea sind:
- Cheleutoptera Crampton, 1915
- Phasmida Leach, 1815
- Phasmatoptera Parker, S.F., 1982
- Anareolatae Redtenbacher, 1906
- Areolatae Redtenbacher, 1906
Als Nomen dubium gilt die Unterordnung Agathemerodea
Unterordnung Timematodea
- Timematidae Caudell, 1903
- Timematinae Caudell, 1903
- Timematini Caudell, 1903
- Timematinae Caudell, 1903
Unterordnung Euphasmatodea
(Syn. = Verophasmatodea)
Überfamilie Aschiphasmatoidea Brunner von Wattenwyl, 1893
- Aschiphasmatidae Brunner von Wattenwyl, 1893
- Aschiphasmatinae Brunner von Wattenwyl, 1893
(Syn. = Xylobistini Zompro, 2004)- Aschiphasmatini Brunner von Wattenwyl, 1893
(Syn. = Xylobistini) - Dajacini Bragg, 2001
- Aschiphasmatini Brunner von Wattenwyl, 1893
- Aschiphasmatinae Brunner von Wattenwyl, 1893
- Damasippoididae Zompro, 2004
- Damasippoidinae Zompro, 2004
- Damasippoidini Zompro, 2004
- Damasippoidinae Zompro, 2004
- Prisopodidae Brunner von Wattenwyl, 1893
- Korinninae Günther, 1953
- Korinnini Günther, 1953
- Prisopodinae Brunner von Wattenwyl, 1893
- Prisopodini Brunner von Wattenwyl, 1893
- Korinninae Günther, 1953
Überfamilie Bacilloidea Brunner von Wattenwyl, 1893
- Anisacanthidae Günther, 1953
- Anisacanthinae Günther, 1953
- Anisacanthini Günther, 1953
- Leiophasmatinae Cliquennois, 2008
- Xerantherinae Cliquennois, 2008
- Anisacanthinae Günther, 1953
- Bacillidae Brunner von Wattenwyl, 1893
- Antongiliinae Zompro, 2004
- Antongiliini Zompro, 2004
- Leprodini Cliquennois, 2006
- Pseudodatamini Zompro, 2004
- Tuberculatocharacini Zompro, 2005
- Xylicini Günther, 1953
- Bacillinae Brunner von Wattenwyl, 1893
- Bacillini Brunner von Wattenwyl, 1893
- Phalcini Zompro, 2004
- Macyniinae Zompro, 2004
- Macyniini Zompro, 2004
- Antongiliinae Zompro, 2004
- Heteropterygidae Kirby, 1896
- Dataminae Rehn, J. A. G. & Rehn, J. W. H., 1939
- Datamini Rehn, J. A. G. & Rehn, J. W. H., 1939
- Heteropteryginae Kirby, 1896
- Heteropterygini Kirby, 1896
- Obriminae Brunner von Wattenwyl, 1893
(Syn. = Therameninae Karny, 1923)- Hoplocloniini Bank et al., 2021
- Obrimini Brunner von Wattenwyl, 1893
(Syn. = Eubulidini Zompro, 2004)
(Syn. = Miroceramiini Zompro, 2004)
(Syn. = Tisamenini Hennemann, Conle, Brock & Seow-Choen, 2016)
- Dataminae Rehn, J. A. G. & Rehn, J. W. H., 1939
Überfamilie Phyllioidea Brunner von Wattenwyl, 1893
- Phylliidae Brunner von Wattenwyl, 1893
- Phylliinae Brunner von Wattenwyl, 1893
- Nanophylliini Zompro & Grösser, 2003
- Phylliini Brunner von Wattenwyl, 1893
- Phylliinae Brunner von Wattenwyl, 1893
Überfamilie Pseudophasmatoidea Rehn, J. A. G., 1904
- Agathemeridae Bradler, 2003
- Agathemerinae Bradler, 2003
- Agathemerini Bradler, 2003
- Agathemerinae Bradler, 2003
- Heteronemiidae Rehn, J. A. G., 1904
(Syn. = Bacunculidae)- Heteronemiinae Rehn, J. A. G., 1904
- Heteronemiini Rehn, J. A. G., 1904
- Paraleptyniini Zompro, 2004
- Pygirhynchini Redtenbacher, 1906
- Heteronemiinae Rehn, J. A. G., 1904
- Pseudophasmatidae Rehn, J. A. G., 1904
- Pseudophasmatinae Rehn, J. A. G., 1904
(Syn. = Pseudophasminae Kirby, 1904)
(Syn. = Paraprisopodini Zompro, 2004)- Anisomorphini Redtenbacher, 1906
- Pseudophasmatini Kirby, 1904
- Stratocleinae Günther, 1953
- Stratocleini Günther, 1953
- Xerosomatinae Bradley & Galil, 1977
- Prexaspini Zompro, 2004
- Setosini Zompro, 2004
- Xerosomatini Bradley & Galil, 1977
- Pseudophasmatinae Rehn, J. A. G., 1904
- Diapheromeridae Kirby, 1904
- Diapheromerinae Kirby, 1904
(Syn. = Bacterinae Handlirsch, 1930)- Diapheromerini Kirby, 1904
- Ocnophilini Günther, 1953
- Oreophoetini Zompro, 2001
- Pachymorphinae Brunner von Wattenwyl, 1893
(Syn. = Pachymorphae Brunner von Wattenwyl, 1893)- Gratidiini Cliquennois, 2004
- Hemipachymorphini Günther, 1953
- Pachymorphini Brunner von Wattenwyl, 1893
- Palophinae Kirby, 1896
- Palophini Kirby, 1896
- Diapheromerinae Kirby, 1904
- Lonchodidae Brunner von Wattenwyl, 1893
- Lonchodinae Brunner von Wattenwyl, 1893
(Syn. = Prisomerinae Karny, 1923)- Eurycanthini Brunner von Wattenwyl, 1893
- Lonchodini Brunner von Wattenwyl, 1893
(Syn. = Menexenini)
- Necrosciinae Brunner von Wattenwyl, 1893
(Syn. = Candaulae Brunner von Wattenwyl, 1893)
(Syn. = Necroscidae Brunner von Wattenwyl, 1893)
(Syn. = Neohiraseini Hennemann & Conle, 2008)- Necrosciini Brunner von Wattenwyl, 1893
- Lonchodinae Brunner von Wattenwyl, 1893
- Phasmatidae Gray, G. R., 1835
(Syn. = Lanceocercata)
(Syn. = Phasmidae Leach, 1815)- Cladomorphinae Brunner von Wattenwyl, 1893
(Syn. = Phibalosomini Redtenbacher, 1908)- Cladomorphini Brunner von Wattenwyl, 1893
- Cladoxerini Karny, 1923
(Syn. = Baculini Günther, 1953) - Cranidiini Günther, 1953
(Syn. = Craspedoniini) - Haplopodini Günther, 1953
- Hesperophasmatini Bradley & Galil, 1977
- Pterinoxylini Hennemann, Conle & Perez-Gelabert, 2016
- Teruelphasmini Yong, 2017
- Clitumninae Brunner von Wattenwyl, 1893
- Clitumnini Brunner von Wattenwyl, 1893
(Syn. = Ramulini Günther, 1953) - Medaurini Hennemann & Conle, 2008
- Pharnaciini Günther, 1953
- Clitumnini Brunner von Wattenwyl, 1893
- Extatosomatinae Sellick, 1997
- Extatosomatini Sellick, 1997
- Megacraniinae Hennemann, 2020
- Phasmatinae Gray,G.R., 1835
(Syn. = Acrophyllini Redtenbacher, 1908)- Acanthomimini Günther, 1953
- Acanthoxylini Bradley& Galil, 1977
- Phasmatini Brunner von Wattenwyl, 1893
- Platycraninae Brunner von Wattenwyl, 1893
- Platycranini Brunner von Wattenwyl, 1893
- Stephanacridini Günther, 1953
- Tropidoderinae Brunner von Wattenwyl, 1893
- Gigantophasmatini Hennemann & Conle, 2008
- Monandropterini Brunner von Wattenwyl, 1893
- Tropidoderini Brunner von Wattenwyl, 1893
- Xeroderinae Günther, 1953
- Xeroderini Otte & Brock, 2005
- Cladomorphinae Brunner von Wattenwyl, 1893
- Achriopterini Günther, 1953
Familie †Archipseudophasmatidae Zompro, 2001
Fossile Belege

Die ältesten fossilen Gespenstschrecken stammen aus der Trias von Australien. Jüngere Vertreter der Ordnung finden sich auch in Baltischem, Dominikanischem und Mexikanischem Bernstein (alle Eozän bis Miozän). Zumeist handelt es sich dabei um Larven. Aus der fossilen Familie Archipseudophasmatidae sind etwa die Arten Archipseudophasma phoenix, Sucinophasma blattodeophila und Pseudoperla gracilipes aus dem Baltischen Bernstein beschrieben. Die in manchen Veröffentlichungen erwähnte zweite Art der Gattung Pseudoperla, Pseudoperla lineata, wird heute je nach Quelle entweder als Synonym der vorgenannten Art angesehen oder als Balticophasma lineata in eine eigene Gattung gestellt. Neben diesen Inklusen zeugen auch Versteinerungen davon, dass Gespenstschrecken einst ein deutlich größeres Verbreitungsgebiet hatten. So wurde in der Grube Messel der 47 Millionen Jahre alte Abdruck eines als Eophyllium messelensis beschriebenen Wandelnden Blattes gefunden.[27][28][29][30][31]
Gespenstschrecken und Mensch
Phasmiden erwecken zunehmend das Interesse der Terrarianer. Diese Entwicklung forciert das Einschleppen fremder Arten in klimatisch geeignete Gebiete. Da diese Neozoen, ebenso wie einige endemische Arten, unter bestimmten Umständen zu Schädlingen werden können, kann dies in landwirtschaftlich genutzten Gebieten Probleme bereiten. Andererseits sorgt das gestiegene Interesse für eine Sensibilisierung bezüglich der Gefährdung und eventuell nötiger Schutzmaßnahmen.
Nutzung durch den Menschen

Bisher gibt es nur wenige Beispiele für die Nutzung von Phasmiden durch den Menschen. So ist bekannt, dass die indigene Bevölkerung in Borneo die sehr großen Eier einiger Haaniella-Arten essen. Dabei werden sie nicht nur wegen des hohen Proteingehaltes geschätzt, sondern sollen gekocht auch gegen Durchfall helfen.[18] In Europa wird seit dem Ende des 19. Jahrhunderts die Indische Stabschrecke (Carausius morosus) als Versuchstier an Universitäten und als Demonstrationsinsekt für Tarnung, Fortbewegung, Entwicklung, Sinnesleistung und Stoffwechsel in Schule und Lehre eingesetzt,[32] was ihr auch den Beinamen Laborstabschrecke oder Laboratoriumsstabschrecke eingetragen hat.[14]
Gespenstschrecken als Heimtiere
In jüngerer Zeit erfreuen sich Gespenstschrecken in der Terraristik wachsender Beliebtheit. Allerdings finden sich einige Arten schon länger in menschlicher Obhut. Beispielsweise wurde Eurycnema versirubra (Syn. Eurycnema versifasciata) schon von den Ureinwohnern der Sunda-Inseln als Haustier gepflegt.[33] Die Anzahl der in den Terrarien der Liebhaber in Zucht befindlichen Arten nimmt seit Jahren permanent zu. Ein regelrechter Boom setzte in den 1980er Jahren ein. In diese Zeit fiel auch die Gründung verschiedener Vereine, die sich die Haltung und Zucht der Gespenstschrecken zur Aufgabe gemacht haben. So wurde in England die Phasmid Study Group gegründet, deren größte Errungenschaft die Etablierung einer international einheitlichen Liste ist, auf der ca. 400 bisher in Terrarien gehaltene Gespenstschreckenarten geführt werden (Siehe auch: Liste der PSG-Arten).[34] Auch die niederländisch-belgische PHASMA beschäftigt sich ausschließlich mit Gespenstschrecken und veröffentlicht in unregelmäßigen Abständen die Zeitschrift PHASMA. In Deutschland sind viele Phasmidenliebhaber in der ZAG (Zentrale Arbeitsgemeinschaft) Wirbellose e. V. organisiert.[19]
Gespenstschrecken als Schädlinge

Da alle Vertreter der Ordnung phytophag sind, können einzelne Arten auch als Schädlinge an Kulturpflanzen in Erscheinung treten. So finden sich in den botanischen Gärten Mitteleuropas gelegentlich ausgesetzte oder entflohene Stabschrecken als Schädlinge. Neben der Indischen Stabschrecke (Carausius morosus) haben vor allem die Vietnam-Stabschrecke (Ramulus artemis) und die Rosa Geflügelte Stabschrecke (Sipyloidea sipylus) erhebliche Schäden verursacht, so z. B. im Botanischen Garten München. Da die Gefahr, die von entflohenen Tieren für die Land- und Forstwirtschaft ausgeht, insbesondere in tropischen Regionen recht groß ist, bedarf die Haltung von bestimmten Arten oder ganzen Insektengruppen in einigen Ländern einer Genehmigung oder bleibt ganz auf die Forschung beschränkt. Im Süden der USA ist beispielsweise die Australische Gespenstschrecke (Extatosoma tiaratum) als Schädling in Erscheinung getreten, so dass deren Haltung dort mittlerweile genehmigungspflichtig ist.
Zu gravierenden Schäden in der Forstwirtschaft kann es insbesondere bei Monokulturen kommen. Die aus Australien nach Südamerika eingeschleppte Art Echetlus evoneobertii ist in brasilianischen Eukalyptus-Plantagen zu einem ernst zu nehmenden Forstschädling geworden. In Australien selbst sorgt Didymuria violescens meist alle zwei Jahre für große Schäden in den Bergwäldern von New South Wales und Victoria. So wurden im Jahre 1963 hunderte Quadratkilometer Eukalyptus-Wald komplett entlaubt. Weiterhin werden auch Podacanthus wilkinsoni und Anchiale austrotessulata bei Massenvermehrung zu Schädlingen in den Wäldern Australiens. Die nordamerikanischen Eichenwälder werden im Osten der USA von Megaphasma dentricus und in Texas und Arkansas von Diapheromera femorata heimgesucht. Auch in China haben mehrere Arten immer wieder große Schäden verursacht. Zu nennen ist hier Baculonistria alba, die 2005 ca. 800 Hektar Tränen-Zypresse (Cupressus funebris) entlaubt hat, wobei auf über 40 Hektar die Bäume abstarben. In den Jahren 1989 und 1990 wurden bis zu 3500 Hektar Wald der Scheinkastanie (Castanopsis fissa) von bis zu 450 Tieren der Art Micadina yingdensis je Baum befallen. Von Ramulus minutidentatus wurden weniger als zehn Jahre später sogar 2000 bis 5000 Tiere je Baum auf der Lindenart Tilia mandshurica gezählt. Teilweise waren diese Massenvorkommen nur durch den großflächigen Einsatz von Insektiziden zu regulieren.[5][18][33]
Gefährdung und Schutzmaßnahmen

(Dryococelus australis) galt lange als ausgestorben
Über die Gefährdung von Gespenstschrecken-Arten ist wegen ihrer versteckten Lebensweise nur wenig bekannt. Die Zerstörung von Habitaten und die Einschleppung von Fressfeinden haben aber oft auf Arten, die in sehr kleinen Verbreitungsgebieten wie Inseln oder natürlich begrenzten Lebensräumen vorkommen, ganz besonders massive Auswirkungen. So hat die Einschleppung der Wanderratte auf die Lord-Howe-Insel im Jahr 1918 dazu geführt, dass der gesamte Bestand des endemischen Baumhummers (Dryococelus australis) schon 1930 als ausgestorben galt. Erst die Entdeckung einer weniger als 30 Tiere zählenden Population auf der 23 Kilometer entfernt liegenden Nachbarinsel Ball’s Pyramid bewies ihr Überleben. Wegen der geringen Populationsgröße und weil der Lebensraum der dort gefundenen Tiere nur auf ein Areal von 6 m × 30 m beschränkt war, wurde beschlossen, ein Zuchtprogramm durchzuführen.[35] Der Baumhummer wird auf der Roten Liste der IUCN als vom Aussterben bedroht (Critically Endangered) eingestuft.[36]
Wiederholte Besuche bestimmter Habitate zeigen, dass dies kein Einzelfall ist. So wurde Parapachymorpha spinosa noch Ende der 1980er Jahre im Bereich des Bahnhofs von Pak Chong in Thailand gefunden. Nach der Erweiterung des Bahnhofsgeländes konnte die Art ab Ende der 1990er Jahre weder hier noch in der Umgebung nachgewiesen werden.[19]
Insbesondere für Arten mit kleinem Verbreitungsgebiet werden Schutzmaßnahmen von Spezialisten und Liebhabern initiiert. Die 2004 in der Cordillera del Condor im Norden von Peru entdeckte Samtschrecke (Peruphasma schultei) kommt auf einer Fläche von nur fünf Hektar vor. Da es in diesem Gebiet noch weitere endemische Arten gibt, wurde es von der peruanischen Regierung unter Schutz gestellt. Von der INIBICO NGO (eine peruanische Naturschutzorganisation) wurde im Rahmen eines Benefiz-Projekts für die Bewohner des Cordillera del Condor-Nationalparks außerdem ein Zuchtprogramm für die Samtschrecke gestartet. Das bis Ende 2007 angesetzte Projekt hatte zum Ziel, jeweils die Hälfte der Nachzuchten auszuwildern beziehungsweise zu verkaufen. Dank der Phasmidenliebhaber konnte diese Art so in ihrem Bestand gesichert werden und gehört mittlerweile zu den häufigsten Phasmiden im Terrarium.
Hochspezialisierte, etwa monophage Arten können, gerade wenn sie nur auf bestimmten Inseln verbreitet sind, sogar gänzlich aussterben. Auf der Insel Rodrigues war sowohl die durch ihre grüne Grundfarbe und die roten Antennen recht auffällige Phasmide Xenomaches incommodus als auch deren Nahrungspflanze, die Palme Latania verschaffeltii, endemisch. Nach dem Verschwinden der Palmenart wurde auch die Gespenstschrecke nicht mehr gefunden und gilt als ausgestorben.[18]
Siehe auch
Literatur
- William Forsell Kirby (1904): A synonymic catalogue of Orthoptera. 1. Orthoptera Euplexoptera, Cursoria et Gressoria. (Forficulidae, Hemimeridae, Blattidae, Mantidae, Phasmidae). online (PDF; 71,4 MB)
- Josef Redtenbacher (1906): Die Insektenfamilie der Phasmiden. Vol. 1. Phasmidae Areolatae. pp. 1–180, pls. 1-6. Wilhelm Engelmann, Leipzig. online (PDF; 56,7 MB)
- Karl Brunner-von Wattenwyl (1907): Die Insektenfamilie der Phasmiden. Vol. 2. Phasmidae Anareolatae (Clitumnini, Lonchodini, Bacunculini). pp. 181–340, pls. 7-15. Wilhelm Engelmann, Leipzig. online (PDF; 41,9 MB)
- Josef Redtenbacher (1908): Die Insektenfamilie der Phasmiden. Vol. 3. Phasmidae Anareolatae (Phibalosomini, Acrophyllini, Necrosciini). pp. 341–589, pls. 16-27. Wilhelm Engelmann, Leipzig. online (PDF; 71,4 MB)
- James Abram Garfield Rehn & John W. H. Rehn (1939): Proceedings of The Academy of Natural Sciences (Vol. 90, 1938), Philadelphia online (PDF; 31,9 MB)
- Klaus Günther (1953): Über die taxonomische Gliederung und die geographische Verbreitung der Insektenordnung der Phasmatodea, Beiträge zur Entomologie, Band 3, 1953, Nr. 5, online (PDF; 32,4 MB)
Weblinks
- Phasmida Species File Online – Website mit kompletter Datenbank zu allen Phasmidentaxa u. a. mit Quellenangaben, Infos und Bildern zu Typusmaterial
- www.phasmatodea.com weltweit größte Website zu Stab- und Gespenstschrecken von Frank H. Hennemann, Oskar V. Conle, Bruno Kneubühler und Pablo Valero, u. a. mit Fotos und Zuchtanleitungen
- phasmidstudygroup.org Website der Phasmid Study Group (englisch)
- www.insectissima.de – Website von Sascha Eilmus und Alexander Dernbach u. a. über Gespenstschrecken
Einzelnachweise
- Paul D. Brock, Thies H. Büscher & Edward W. Baker: Phasmida Species File Online. Version 5.0/5.0. (abgerufen am 22. März 2021)
- Phasmatodea in der Fauna Europaea, Stand 19. März 2015.
- Dr. Dr. h. c. Bernhard Grzimek, in Grzimeks Tierleben, Band 2: Insekten (ISBN 3-423-05970-2)
- Oliver Zompro: Stabschrecken, Gespenstschrecken, Wandelnde Blätter – Phasmidensystematik im Überblick I., Arthropoda 17 (1) April 2009, Sungaya-Verlag Kiel. ISSN 0943-7274
- Roy Bäthe, Anke Bäthe & Mario Fuß: Phasmiden, Schüling Verlag, Münster 2009, ISBN 978-3-86523-073-7
- Spiegel Online – Michael Lenz: Rettet den Baumhummer!
- scinexx – Das Wissensmagazin: Baumhummer kennen keine Verwandten
- Oliver Zompro: Zwergformen der Phasmatodea – die Kleinen unter den Riesen, Arthropoda 16 (3) November 2008, Sungaya-Verlag Kiel. ISSN 0943-7274
- Oliver Zompro: Die längste Stabschrecke – das längste lebende Insekt, Arthropoda 16 (4) Dezember 2008, Sungaya-Verlag Kiel. ISSN 0943-7274
- Spiegel Online zur Neubeschreibung von Phobaeticus chani
- Natural History Museum UK über das längste Insekt der Welt (Archiv Oktober 2008)
- China Daily, World's longest insect discovered in China, 5. Mai 2016
- Oliver Zompro: Paragongylopus plaumanni Zompro, 2000 – eine der merkwürdigsten Phasmiden, Arthropoda 17 (1) April 2009, Sungaya-Verlag Kiel. ISSN 0943-7274
- Christoph Seiler, Sven Bradler & Rainer Koch: Phasmiden – Pflege und Zucht von Gespenstschrecken, Stabschrecken und Wandelnden Blättern im Terrarium – bede, Ruhmannsfelden 2000, ISBN 3-933646-89-8
- Thies H. Büscher: Gynandromorphismus – Halb Mann, Halb Frau – kuriose Zwitterwesen; ein Bericht mit besonderem Blick auf Gynander in der Ordnung Phasmatodea (Insecta). Arthropoda Popularis, 3/4 2015, ZAG Wirbellose e.V., Dessau-Roßlau 2015, S. 26–37, ISSN 2190-3476
- Detlef Größer: Wandelnde Blätter, Edition Chimaira, Frankfurt am Main 2008, ISBN 978-3-930612-46-8
- Ingo Fritzsche: Zur Entdeckung von Malacomorpha guamuhayaense Zompro & Fritzsche, 2008, Arthropoda 16 (1) März 2008, Sungaya-Verlag Kiel. ISSN 0943-7274
- Phasmatodea-Seite von Frank H. Hennemann, Oskar V. Conle, Bruno Kneubühler und Pablo Valero
- Ingo Fritzsche: Stabschrecken – Carausius, Sipyloidea & Co., Natur und Tier Verlag, Münster 2007, ISBN 978-3-937285-84-9
- S.G. Compton und A.B. Ware: Ants disperse the elaiosome-bearing eggs of an African stick insect. Psyche Band 98, 1991, S. 207–213.
- Stephan Schorn: Die Australische Riesengespenstschrecke Extatosom tiaratum, Natur und Tier Verlag, Münster 2009, ISBN 978-3-86659-123-3
- Bernhard Misof et al.: Polygenomics resolves the timing and pattern of insects evolution, Science 346, 763, 2014, by the American Association for the Advancement of Science, Washington DC, (print) ISSN 0036-8075, (Online) ISSN 1095-9203
- Oliver Zompro: Revision of the genera of the Areolatae, including the status of Timema and Agathemera (Insecta, Phasmatodea). Goecke & Evers Verlag, Keltern, 2004, ISBN 3-931374-39-4
- Oliver Zompro: Das System der geflügelten Insekte (Pterygota), Arthropoda 16 (1) März 2008, Sungaya-Verlag Kiel. ISSN 0943-7274
- Frank H. Hennemann & Oskar V. Conle: Revision of Oriental Phasmatodea: The tribe Pharnaciini Günther, 1953, including the description of the world's longest insect, and a survey of the family Phasmatidae Gray, 1835 with keys to the subfamilies and tribes (Phasmatodea: Anareolatae: Phasmatidae) (Zootaxa 1906), Magnolia Press, Auckland, New Zealand, 316 pp.; 30 cm. 15 Oct. 2008, ISBN 978-1-86977-271-0 (paperback), ISBN 978-1-86977-272-7 (Online edition) (pdf des Abstracts auf www.mapress.com; PDF; 48 kB)
- Nicolas Cliquennois: 2008. Ann. Soc. entomol. Fr. n.s. 44(1):60
- George O. Poinar, Jr.: Life in Amber. 350 S., 147 Fig., 10 Tafeln, Stanford University Press, Stanford (Cal.) 1992. ISBN 0-8047-2001-0
- Wolfgang Weitschat und Wilfried Wichard: Atlas der Pflanzen und Tiere im Baltischen Bernstein, 256 S., zahlr. Abb., Pfeil-Verlag, München 1998. ISBN 3-931516-45-8
- Oliver Zompro: Ausgestorbene exotische Insekten in Europa, Arthropoda 16 (3) November 2008, Sungaya-Verlag Kiel. ISSN 0943-7274
- Biolib – Taxon profile for Archipseudophasmatidae (engl.)
- Scienceticker – “Wandelnde Blätter” sind lebende Fossilien
- Siegfried Löser: Exotische Insekten, Tausendfüßer und Spinnentiere – eine Anleitung zur Haltung und Zucht. Ulmer Verlag, Stuttgart 1991, ISBN 3-8001-7239-9
- Oliver Zompro: Schon gewusst? – Bemerkenswertes über Phasmiden, Arthropoda 17 (1) April 2009, Sungaya-Verlag Kiel. ISSN 0943-7274
- Phasmid Study Group Culture List (englisch)
- Paul D. Brock & Jack W. Hasenpusch: The complete fiel guide to stick and leaf insects of Australia, Csiro Publishing, Collingwood, Auaralia, 2009, S. 74–75, ISBN 978-0-643-09418-5
- Dryococelus australis in der Roten Liste gefährdeter Arten der IUCN 2017. Abgerufen am 28. Dezember 2020.

