FeLV-Infektion
Eine Infektion mit dem Felinen Leukämie-Virus (FeLV) kann bei Katzen zu schweren Erkrankungen führen. Das Virus aus der Familie der Retroviridae, das vor allem durch den Speichel von Katze zu Katze übertragen wird, verursacht bei einigen der infizierten Tiere schwere Krankheitssymptome, die sehr variabel sein können. Neben Lymphomen, also bösartigen Tumoren des lymphatischen Gewebes, sind die häufigsten Krankheitsanzeichen ein geschwächtes Immunsystem sowie eine Blutarmut.
Nicht alle infizierten Tiere entwickeln klinische Symptome. Katzen, die über eine ausreichende Immunkompetenz verfügen, gelingt es, die Infektion schon in einem frühen Stadium zu überwinden. Bei den anderen Tieren gelangt das Virus nach der Infektion über die Maul- und Nasenschleimhäute zunächst in das lymphatische Gewebe des Nasen-Rachen-Raums, von wo es sich über die Blutbahn bis in das Knochenmark ausbreitet, wo es die blutbildenden Stamm- und Vorläuferzellen infiziert und schließlich mit den Blutzellen über den ganzen Körper verteilt wird. Im Körper dieser als "progressiv infiziert" bezeichneten Katzen kommt es zu einer ständigen Virusvermehrung. Im Blut lassen sich große Mengen an Viruspartikeln nachweisen, die über die Körperflüssigkeiten, vor allem über den Speichel, ausgeschieden werden, so dass diese Katzen eine Infektionsquelle für andere Tiere darstellen.
Als Retrovirus integriert das Feline Leukämie-Virus seine Erbsubstanz in die infizierten Wirtszellen, die damit alle notwendigen Informationen für die Virusvermehrung in Form eines sogenannten Provirus enthalten. Auf diese Weise kann das Virus nicht mehr aus dem Körper einer infizierten Katze eliminiert werden. Eine kausale Behandlung der FeLV-Infektion gibt es deshalb nicht, so dass durch eine palliative Therapie lediglich die Symptome gelindert werden können.
Impfstoffe gegen das Feline Leukämie-Virus sind verfügbar, sie schützen die Katzen zuverlässig vor der Entwicklung einer progressiven Infektion und damit vor der Entwicklung von Krankheitssymptomen, können aber eine Infektion mit dem Virus nicht vollständig verhindern. Die Impfung wird nur für die Katzen empfohlen, die potentiellen Kontakt zu anderen Katzen mit unbekanntem FeLV-Status haben.
Terminologie
Die Infektion mit dem Felinen Leukämie-Virus ist bei Katzen oft mit Tumoren der weißen Blutzellen assoziiert, weshalb die mit einer FeLV-Infektion assoziierten Erkrankungen häufig als feline Leukämie oder Katzenleukämie bezeichnet werden. Da die FelV-Infektion jedoch mit zahlreichen weiteren und sehr variablen Symptomen einhergehen kann, sollte dieser Begriffe nicht synonym für die FeLV-Infektion verwendet werden.[1]
In der deutschsprachigen Veterinärmedizin wird für systemische neoplastische Proliferationen der weißen Blutzellen bzw. deren Vorstufen häufig die Bezeichnung Leukose verwendet. Oft werden auch solide Tumoren der hämolymphatischen Gewebe, wie der Lymphknoten, des Thymus oder der Milz, dazu gerechnet. Sind Tumorzellen im Blut vorhanden, spricht man von einer leukämischen Leukose; können in der Blutbahn dagegen keine Tumorzellen nachgewiesen werden, spricht man von einer aleukämischen Leukose.[2]
Entsprechend dieser Begriffsverwendungen wird die FeLV-Infektion im deutschsprachigen Raum häufig auch als Katzenleukose und das auslösende Virus fälschlicherweise als Felines Leukose-Virus bezeichnet.
Vor allem im englischsprachigen Raum verwendet man für maligne Erkrankungen des Blut bildenden oder des lymphatischen Systems dagegen auch in der Veterinärmedizin den in der Humanmedizin verwendeten Begriff Leukämie (Leucemia). Genau wie bei der Bezeichnung Leukose werden unter diesem Begriff auch solide Tumoren der lymphatischen Gewebe mit erfasst, was die Benennung des Virus als Felines Leukämie-Virus erklärt, obwohl die Entdeckung durch William Jarrett an Katzen erfolgte, die an einem Lymphom und nicht an einer Leukämie erkrankt waren.
Geschichte
Das FeLV-Virus wurde erstmals 1964 durch William Jarrett, einem Veterinärpathologen an der University of Glasgow, isoliert. Dieser wurde von einem Glasgower Tierarzt auf eine hohe Prävalenz von Lymphomen unter den von diesem behandelten Katzen aufmerksam gemacht. Jarrett erkannte, dass es in bestimmten Gruppen von Katzen, die in engem Kontakt zueinander lebten, zu einer Häufung dieser Tumoren kam. So fand er in einer Gruppe von Katzen, die gemeinsam in einem Haushalt lebten, bei acht Tieren eine Leukämie. In einem anderen Haushalt mit mehreren Katzen traten bei den vorher gesunden Tieren gehäuft Tumoren auf, nachdem ein Zuchtkater neu in die Gruppe gebracht worden war. Die Beobachtung, dass gesunde Katzenwelpen, nachdem sie Kontakt zu erkrankten Welpen hatten, ebenfalls erkrankten, ließ ihn schlussfolgern, dass es ein von Tier zu Tier horizontal übertragbares, tumor-auslösende Agens geben müsse.[3]
Das Konzept der Virus-induzierten Tumorentstehung war bereits seit der Beschreibung des Rous-Sarkom-Virus bei Hühnern durch Francis Peyton Rous 1911 bekannt, der für seine Entdeckung 1966 mit dem Nobelpreis für Medizin ausgezeichnet wurde.[4] In den 1930er Jahren waren durch Retroviren induzierte Leukämien bei Mäusen sowie das zur Familie der Poxviridae gehörende Shopsche Fibromvirus (Leporipoxvirus fibromatosis), das bei Kaninchen mesenchymale Tumoren induziert, beschrieben worden
Jarrett und seinen Mitarbeitern gelang es, nachzuweisen, dass Lymphome von einem Tier auf ein anderes übertragbar waren,[5] sowie aus Tumoren der Milz, des Thymus und der Mesenteriallymphknoten einer an einem Lymphosarkom erkrankten Katze Viren zu isolieren und in einer Zellkultur anzuzüchten.[6]
Nach dem Murinen Leukämievirus war das Feline Leukämie-Virus das zweite beschriebene Retrovirus, das bei Säugetieren Tumoren induzieren kann. Nachdem eine ganze Reihe von tierischen Retroviren entdeckt worden waren, die maligne Erkrankungen auslösen (u. a. das Bovine Leukämie-Virus BLV, die Aviären Leukoseviren ALV, Maus-Mammatumorvirus MMTV u. a.), waren viele Humanmediziner der Auffassung, dass es nur noch eine Frage der Zeit sei, bis entsprechende menschliche onkogene Retroviren gefunden werden würden. Als dies jedoch jahrzehntelang nicht eintrat, bzw. es immer wieder Falschmeldungen und Fehlalarme gab, wuchs die Skepsis der Forschergemeinde.[7] Erst Ende der 1970er Jahre gelang der Arbeitsgruppe um den amerikanischen Virologen Robert Gallo die Entdeckung der ersten beiden humanen Retroviren, HTLV-1 und HTLV-2. Als sich Gallo mit der Anfang der 1980er neu auftretenden „Seuche“ AIDS befasste, hielt er zunächst ein FeLV-ähnliches Retrovirus als Auslöser für möglich, da er sich an die manchmal unter FeLV-Infektion auftretende Immunsuppression erinnerte.[8] Letztlich wurde aber ein neues Lentivirus – HIV – als Agens identifiziert.[9]
Felines Leukämie-Virus
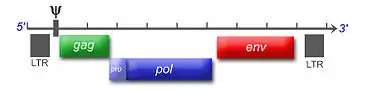
Das Feline Leukämievirus gehört zur Familie der Retroviren. Als Gammaretrovirus enthält es eine einzelsträngige RNA, die bei der Replikation des Virus nach Infektion einer Wirtszelle zunächst durch das virus-eigene Enzym reverse Transkriptase in doppelsträngige DNA umgeschrieben wird, um anschließend in das Genom der Wirtszelle integriert zu werden. Die integrierte Virus-DNA wird als Provirus bezeichnet und stellt die Vorlage für die Synthese neuer Viruspartikel dar. Über diesen Mechanismus ist das Virusgenom und damit die vollständige Information für die Virusreplikation in der Wirtszelle verankert; der Wirtsorganismus kann das Virus damit nicht mehr aus dem Körper eliminieren.
Der Vermehrungszyklus des Virus beinhaltet zahlreiche Möglichkeiten der Entstehung genetischer Variabilität. Der Vorgang der Übersetzung der RNA in DNA ist relativ fehleranfällig, da das Enzym reverse Transkriptase keine Kontrollfunktion besitzt. Dadurch entstehen regelmäßig Mutationen im Virusgenom, die zu neuen genetischen Varianten führen können. Des Weiteren kommt es regelmäßig zur Rekombination mit Genabschnitten des Wirtszellgenoms.[4]
Das als Provirus in das Zellgenom integrierte Virusgenom wird bei der Zellteilung an Tochterzellen weitergegeben. Im Laufe der Evolution haben sich im Genom der Hauskatze an verschiedenen Loci vollständige endogene FeLV-Proviren etabliert, die über die Keimbahn an folgende Generationen vererbt werden. In verschiedenen Organen der Katze konnten Transkriptionsprodukte dieser endogenen Viren nachgewiesen werden, so dass es bei einer Infektion der Zelle mit FeLV-A zu einer Rekombination zwischen dem exogenen FeLV-A und dem endogenen FeLV-Transkriptionsprodukten kommen kann.[9]
Durch die hohe Rate von Mutationen und Rekombinationen bei der Virusreplikation stellt das FeLV eine Gruppe genetisch sehr eng verwandter Viren dar, die sich durch eine hohe genetische Variabilität auszeichnen. Dabei unterscheidet man die vier Subtypen FeLV-A, FeLV-B, FeLV-C und FeLV-T, die sich in der Sequenz des env-Gens, den bei der Infektion von Wirtszellen verwendeten Rezeptoren und ihrem Zell-Tropismus unterscheiden.[4]
Von den vier Subtypen ist FeLV-A die übertragbare und infektiöse Form des Felinen Leukämie-Virus und der einzige per se ansteckende Subtyp. Er kann bei allen natürlich infizierten Katzen nachgewiesen werden, wobei bisher zahlreiche verschiedene genetische Varianten isoliert wurden.[4]
Der Subtyp FeLV-B entsteht de novo in mit FeLV-A infizierten Katzen durch eine Rekombination zwischen FeLV-A und Sequenzen des endogenen FeLV-env-Gens der Wirtszelle. Er kann nur gemeinsam mit dem Subtyp FeLV-A von Katze zu Katze übertragen werden. Katzen, die mit dem Subtyp FeLV-B infiziert sind, entwickeln häufiger Lymphome als Tiere, die nur mit FeLV-A infiziert sind. Die Prognose ist deutlich schlechter.[9]
Der Subtyp FeLV-C entsteht de novo in FeLV-A infizierten Katzen durch eine Mutation. Infektionen mit dem Subtyp FeLV-C verursachen schwere, tödlich verlaufende nicht-regenerative Anämien. Er entsteht allerdings selten und kann nicht von Katze zu Katze übertragen werden. Infektionen mit dem vierten Subtyp FeLV-T gehen mit einer starken Schwächung des Immunsystems und körperlichem Verfall einher.[4]
Verbreitung und Epidemiologie
Wirtsspektrum
Die FeLV-Infektion ist weltweit verbreitet. Das Feline Leukämie-Virus weist eine relativ strenge Wirtsspezifität für Spezies aus der Familie der Katzen (Felidae) auf.[1] Neben der Hauskatze (Felis catus) wurden bisher auch FeLV-Infektionen bei Wildkatzen (Felis silvestris), beim Eurasischen Luchs (Lynx lynx), beim Iberischen Luchs (Lynx pardinus), beim Puma (Puma concolor) sowie bei der Chilenischen Wildkatze (Leopardus guigna) nachgewiesen.[10] Für Nicht-Feliden ist es nicht infektiös, so dass auch für den Menschen kein Infektionsrisiko besteht.[1]
FeLV-Infektionen kommen bei nicht-domestizierten Spezies der Felidae-Familie allerdings nur selten vor. Die meisten bisher beschriebenen Infektionen von Wildtieren wurden bei Tieren in Gefangenschaft nachgewiesen und konnten auf einen direkten Kontakt mit FeLV-infizierten Hauskatzen zurückgeführt werden. In fast allen nachkontrollierten Fällen waren die infizierten Tiere in der Lage, das Virus vollständig zu eliminieren, weshalb das Virus hier nicht auf andere Artgenossen übertragen wurde.
Da bisher auch bei keiner anderen Katzenart als der Hauskatze endogene FeLV-Viren nachgewiesen werden konnten, wurde postuliert, dass das FeLV zwar verschiedene Spezies aus der Familie der Katzen infizieren kann, aber nur für die Hauskatze pathogen ist. Diese Hypothese musste nach einem FeLV-Ausbruch in der Population der Florida-Panther (Puma concolor coryiin) in den Jahren 2001–2006 sowie dem Nachweis von FeLV-infizierten Iberischen Luchsen in Spanien in den Jahren 2004 bis 2007 revidiert werden, nachdem in beiden Fällen mehrere Tiere nachweislich an der Infektion verstorben waren.[11][12] Da bei beiden Ausbrüchen jeweils Populationen einer hochgradig vom Aussterben bedrohten Spezies betroffen waren und jeweils bei mehreren klinisch erkrankten und verendeten Tieren eine FeLV-Virämie nachgewiesen wurde, wird die FeLV-Infektion mittlerweile auch als Gefahr für den Erhalt bedrohter Arten angesehen, besonders wenn nur noch kleine Restpopulationen in begrenzten geographischen Gebieten und mit engem Kontakt der Tiere untereinander leben.[11]
Prävalenz
In Europa, den USA und Kanada sind etwa 1 % – 10 % der Hauskatzen mit dem Virus infiziert. Dabei wird die Prävalenz vor allem von der Dichte einer Katzenpopulation sowie den konkrekten Haltungsbedingungen der Katzen beeinflusst, so dass große geographische und lokale Unterschiede bestehen.[13] So sind in den meisten Ländern unter 1 % der einzeln gehaltenen Katzen mit dem Virus infiziert. In Haushalten, in denen mehrere Katzen mit engem Kontakt untereinander gehalten werden und in denen keine besonderen Vorsorgemaßnahmen gegen die Übertragung der Infektion getroffen werden sowie in Gruppen von verwilderten Hauskatzen kann die Prävalenz dagegen 20 % übersteigen.[13] Bei Katzen, die während einer Erkrankung getestet wurden, konnten Infektionsraten von bis zu 30 % nachgewiesen werden, was auf die besondere Bedeutung des Virus als Krankheitserreger hinweist.[14]
Bis in die 1990er-Jahre konnte etwa ein Drittel aller tumor-assoziierten Todesfälle bei Katzen auf eine FeLV-Infektion zurückgeführt werden. Da zusätzlich auch zahlreiche Tiere an FeLV-assoziierten Anämien und an durch das geschwächte Immunsystem bedingten Sekundärinfektionen starben, war die FeLV-Infektion in dieser Zeit für den überwiegenden Teil der krankheits-bedingten Todesfälle bei Katzen verantwortlich.[14]
In den letzten Jahrzehnten hat die Prävalenz und damit auch die Bedeutung des Felinen Leukämie-Virus als Krankheitserreger deutlich abgenommen. Dies ist auf die Verfügbarkeit zuverlässiger diagnostischer Tests und Impfstoffe, umfangreiche Test- und Eliminationsprogramme sowie eine bessere Kenntnis der Pathogenese und des Infektionsverlaufs zurückzuführen.[13]
Übertragung
.jpg.webp)

Das Virus kann sowohl horizontal als auch vertikal übertragen werden.[4]
Virämische Katzen scheiden das Virus in großen Mengen über den Speichel, das Nasensekret, die Tränenflüssigkeit, den Kot, den Urin und die Muttermilch aus.[15] Die Infektion erfolgt meist durch direkten Kontakt mit infizierten Tieren, vor allem über den Speichel.[1] Die indirekte Übertragung durch mit virushaltigem Speichel oder anderen Körperflüssigkeiten kontaminierte Gegenstände wie Fress- oder Trinknäpfe ist kaum von Bedeutung, da das Virus außerhalb der Katze bei Zimmertemperatur bereits innerhalb weniger Minuten deaktiviert wird. Sie kann aber unter schlechten hygienischen Bedingungen vorkommen, wenn z. B. mehrere Katzen gleichzeitig aus einem Napf fressen. Der bedeutendste Übertragungsweg sind freundliche Kontakte zwischen Katzen, wie etwa das gegenseitiges Belecken zur Fellpflege. Aber auch durch Bisse oder auch nur Bissversuche, bei denen Speichel übertragen wird, zum Beispiel bei Rangkämpfen oder beim Deckakt, kann die Infektion übertragen werden.[13]
Von virämischen trächtigen Katzen wird das Virus vertikal übertragen, das heißt die Feten können schon durch den Mutterkuchen (transplazentar) infiziert werden. Dies führt allerdings meist zu deren Absterben und/oder zu Fehlgeburten. Transplazentar infizierte Welpen zeigen bereits bei der Geburt eine Virämie, kümmern und sterben nach kurzer Zeit (Fading-Kitten-Syndrom).[13][13]
Mit steigendem Alter werden Katzen zunehmend resistent gegenüber einer FeLV-Infektion, so dass Katzenwelpen und junge Katzen besonders gefährdet für eine Ansteckung sind. Katzen, die freien Auslauf haben, sind besonders dem Risiko einer FeLV-Infektion ausgesetzt, da sie Kontakt zu Tieren mit unbekanntem FeLV-Status haben können. Dies gilt besonders für unkastrierte Tiere, da sie häufiger in Revierkämpfe verwickelt sind und die Infektion auch durch engen Kontakt beim Deckakt übertragen werden kann. Weitere Risikofaktoren für eine Infektion sind die Haltung von Katzen in größeren Gruppen mit wechselnder Besetzung, eine hohe lokale Katzendichte und schlechte hygienische Bedingungen.[13][15]
Verlauf der Infektion
Die Infektion mit dem Felinen Leukämie-Virus hat einen chronischen Verlauf und ist durch eine lange asymptomatische Phase gekennzeichnet, in denen die betroffenen Katzen keinerlei klinische Anzeichen einer Erkrankung zeigen.[14]
Nach der Aufnahme des Virus über die Maul- oder Nasenschleimhaut vermehrt dieses sich zunächst in den lokalen lymphatischen Geweben des Nasen-Rachen-Raumes. Bereits wenige Tage nach der Infektion kommt zu einer ersten Virämie, so dass an Lymphozyten und Monozyten gebundene Viruspartikel im peripheren Blut nachweisbar sind. Innerhalb von 7 bis 14 Tagen werden über den Blutweg weitere lymphatische Organe infiziert, betroffen sind vor allem der Thymus, weitere regionale Lymphknoten und die Peyerschen Platten des Dünndarms. 14 bis 21 Tage nach dem ersten Viruskontakt sind auch im Knochenmark infizierte Zellen nachzuweisen, die große Mengen an Viruspartikeln produzieren, die in die Blutbahn ausgeschwemmt werden und so eine zweite, deutlich stärkere Virämie verursachen.[13]
Prinzipiell können alle hämatopoetischen Zellen durch das FeLV infiziert werden.[16] Während zunächst vor allem Lymphozyten und Monozyten infiziert werden, weisen im späteren Verlauf der Infektion die neutrophilen Granulozyten und Thrombozyten die stärkste Virusreplikation auf.[10]
Verlaufsformen
Die Infektion mit dem FeL-Virus kann verschiedene Verlaufsformen annehmen. Während früher davon ausgegangen wurde, dass Katzen, die einmal eine FeLV-Infektion überstanden haben, ohne eine persistierende Virämie zu entwickeln, immun gegenüber einer FeLV-Infektion sind, weiß man heute durch sensitivere diagnostische Verfahren, dass die meisten Katzen, die eine FeLV-Infektion durchgemacht haben, Provirus-positiv bleiben. Bisher ist allerdings unklar, ob dieser Provirus-positive Status eine klinische Relevanz hat und welche epidemiologische Bedeutung diesen Tieren zukommt. Das Virus kann über einen Test auf virales Protein nicht im Blut dieser Tiere nachgewiesen werden und sie scheiden es auch nicht aus. Da das Virus aber in Form des Provirus in das Genom von Wirtszellen integriert ist, kann dieses nicht aus dem Körper eliminiert werden. Nach einer Reaktivierung der Virusreplikation kann es aber prinzipiell zu einer erneuten Virämie und einer Ausscheidung von infektiösen Viren kommen.[14]
Aufgrund der Erkenntnis, dass es zahlreiche Tiere gibt, die im Test auf Virusantigen im Blut negativ reagieren, gleichzeitig aber Provirus-positiv sind, erfolgte eine neue Klassifikation der Verlaufsformen der FeLV-Infektion. Nach dieser Klassifikation werden die Infektionen in eine abortive, eine progressive, eine regressive und eine atypische oder fokale Infektion eingeteilt.[14]
Der Verlauf der Infektion wird vor allem durch Immunantwort des infizierten Tieres bestimmt. Katzen, bei denen die Infektion einen abortiven oder regressiven Infektionsverlauf nimmt, weisen ein hohes Level an zirkulierenden FeLV-spezifischen cytotoxischen T-Lymphozyten (CTL) im Blut auf, noch bevor virus-neutralisierende Antikörper auftreten. Progressiv infizierte Katzen mit persistierender Virämie reagieren auf die Infektion dagegen nur mit einer verminderten spezifischen zell-vermittelten und humoralen Immunantwort.[14]
Das Alter zum Zeitpunkt der Infektion gilt als einer der am meisten den Infektionsverlauf determinierenden Eigenschaften des infizierten Tieres. Neugeborene Katzenwelpen entwickeln nach einer Infektion mit dem Felinen Leukämie-Virus eine Thymusatrophie mit schwerer Immunschwäche, kümmern und sterben nach kurzer Zeit. Mit zunehmendem Alter entwickelt sich progressiv eine Resistenz gegenüber der Infektion. So zeigen ältere Katzen meist einen abortiven oder regressiven Infektionsverlauf. Falls es bei ihnen doch zu einer progressiven Infektion kommt, entwickeln sich meist nur milde Symptome, die Phase bis zum Ausbruch der ersten Symptome ist deutlich verlängert.[14]
Abortive Infektion
Bei der abortiven Infektion vermehrt sich das Virus nach der Infektion in den lokalen lymphatischen Geweben des Nasenrachenraums. Katzen mit einer ausreichenden Immunkompetenz sind in der Lage, eine effektive humorale und zell-vermittelte Immunantwort zu entwickeln, so dass es nicht zu einer weiteren Ausbreitung des Virus über die Blutbahn im Köper kommt. Im Blut dieser Tiere liegt ein hoher Spiegel von gegen das Virus gerichteten, neutralisierenden Antikörpern vor, während zu keinem Zeitpunkt FeLV-Protein, virale RNA oder provirale DNA nachgewiesen werden können.[14]
Unter natürlichen Infektionsbedingungen verläuft eine FeLV-Infektion bei etwa 20 % bis 30 % der Katzen abortiv. Voraussetzung ist neben einer ausreichenden Immunkompetenz wahrscheinlich ein nur geringer Infektionsdruck durch niedrige Dosen an FeLV, denen die Tiere ausgesetzt sind. Nach der früheren Klassifikation wurden Katzen, bei denen nach einer Infektion kein Virusantigen im Blut nachgewiesen werden konnte, als Regressor-Katzen bezeichnet. Mit Hilfe der sehr sensitiver Polymerase-Kettenreaktion konnte in Gewebeproben zahlreicher Katzen, die bisher als Regressor-Katzen eingestuft worden waren, aber tatsächlich provirale DNA nachgewiesen werden, was zeigt, dass tatsächlich nur ein Teil der infizierten Katzen in der Lage ist, das FeLV vollständig aus dem Körper zu eliminieren.[14]
Die abortive Infektion kann nur durch den Nachweis von gegen das FeLV gerichteten Antikörpern im Blut (Serokonversion) nachgewiesen werden. Da das Virus vollständig aus dem Körper eliminiert wird, hat eine abortiv verlaufene FeLV-Infektion auch im Laufe des späteren Lebens keine klinischen Konsequenzen. Es wird kein Virus ausgeschieden, so dass die Tiere nach der Überwindung der Infektion keine Infektionsquelle für andere Katzen darstellen.[4]
Katzen, die eine abortive FeLV-Infektion durchlaufen haben, bleiben ihr Leben lang immun gegen eine erneute Infektion mit dem Virus.[14]
Progressive Infektion
Bei der progressiven Infektion durchläuft das Virus den vollständigen Infektionsverlauf von den lokalen Lymphknoten bis hin zur Infektion der Knochenmarkszellen. Dem Wirtsorganismus gelingt es dabei nicht, eine ausreichende Immunantwort auf die Infektion zu entwickeln, so dass zu einer fortdauernden Virusreplikation mit ständiger Neuinfektion weiterer Körperzellen kommt. Progressiv infizierte Katzen weisen deshalb eine persistierende Virämie auf, in ihrem Blut sind ab der Infektion des Knochenmarks zu jedem Zeitpunkt große Mengen an Virusprotein nachweisbar. Über den Speichel, aber auch über Tränenflüssigkeit, den Kot, den Urin und die Muttermilch, scheiden die Tiere permanent infektiöse Viruspartikel aus, so dass sie eine Infektionsquelle für andere Katzen darstellen.[14]
Etwa 30 % bis 40 % der FeLV-infizierten Katzen entwickeln eine progressive Infektion mit persistierender Virämie.[4] Ob eine Katze eine progressive Infektion entwickelt, hängt von mehreren Faktoren ab. So führt die Infektion junger Katzen mit einem Alter von bis zu 16 Wochen in der weit überwiegenden Anzahl der Fälle zu einer lebenslang persistierenden Virämie.[16] Bei hohem Infektionsdruck oder einer nicht ausreichenden Immunantwort können aber auch ältere Tiere dauerhaft virämisch werden.[16]
Die meisten progressiv infizierten Katzen entwickeln innerhalb von Monaten bis Jahren nach der Infektion FeLV-assoziierte klinische Erkrankungen.[15] Katzen mit einer progressiven Infektion haben deshalb eine schlechte Prognose mit einer deutlich reduzierten Lebenserwartung.[14]
Regressive Infektion
Bei 30 %–40 % der mit FeLV infizierten Katzen entwickelt sich ein regressiver Infektionsverlauf. Dabei wird das Virus nach der initialen Infektion und einer ersten Vermehrung in den lokalen Lymphgeweben zunächst durch Lymphozyten und Monozyten über die Blutbahn im ganzen Körper verteilt (erste Virämie). In diesem Stadium der Infektion lässt sich Virus-Antigen im Blut der Katzen nachweisen und die Katzen scheiden die Viren vor allem über den Speichel aus. Im weiteren Verlauf der Infektion gelingt es den Tieren aber, die Virusreplikation und damit die Infektion weiterer Körperzellen durch eine ausreichende Immunantwort zu unterbinden. Die Infektion kann dabei bereits vor der Infektion des Knochenmarks, oder in selteneren Fällen auch noch während der zweiten Virämie eingedämmt werden. Dies kann innerhalb von Wochen, in Ausnahmefällen auch noch Monate nach der Infektion erfolgen.[14]
Die molekulare Grundlage der regressiven Infektion ist die Integration einer Kopie des viralen Genoms (Provirus) in die chromosomale DNA der Wirtszellen. Dadurch kann das Virus nicht vollständig aus dem Körper eliminiert werden, die genetische Information für die Virusreplikation bleibt in den Körperzellen vorhanden ist. Mit jeder Teilung einer das Provirus tragenden Zelle wird die provirale DNA aber vermehrt und die genetische Information an die entstehenden Tochterzellen weiter gegeben, so dass alle aus den infizierten Vorläuferzellen hervorgehenden Tochterzellen provirale FeLV-DNA enthalten.[14]
Obwohl die provirale DNA in der Wirtszelle vorliegt, wird von den Zellen kein Virus produziert, weshalb bei den betroffenen Tieren kein FeLV-Antigen im Blut nachgewiesen werden kann. Mit Hilfe einer PCR lässt sich jedoch die provirale DNA in Wirtszellen nachweisen. Die Tiere scheiden kein Virus aus und stellen damit auch keine Infektionsquelle für andere Katzen dar.[14]
Da die vollständige genetische Information für die Bildung von Virus-Partikel in den Wirtstieren vorhanden ist, kann eine regressive Infektion im Falle einer Schwächung des Immunsystems reaktiviert werden, weil die Immunantwort zu schwach wird, um die Virusreplikation weiter zu unterdrücken. Die kann z. B. durch chronischen Stress, die Verabreichung von Glucocorticoiden oder anderen immunsuppressiv wirkenden Medikamenten oder bei einer Infektion mit dem Felinen Immundefizienz-Virus geschehen.[17] Durch die Reaktivierung kann es zu einer erneuten Virämie und damit zu Ausscheidung infektiöser Viren kommen.[14] Nach der früheren Einteilung wurde die regressive Infektion deshalb als latente Infektion bezeichnet. Die Reaktivierung einer regressiven FeLV-Infektion kommt unter natürlichen Bedingungen allerdings wahrscheinlich äußerst selten vor.[4]
Die klinische Relevanz der regressiven Infektion ist bis heute noch nicht vollständig verstanden. Sicher ist, dass regressiv infizierte Katzen im Vergleich zu progressiv infizierten Tieren ein deutlich geringeres Risiko haben, FeLV-assoziierte Erkrankungen zu entwickeln.[15] Im Vergleich zu Katzen, die nie Kontakt mit dem FeLV hatten, haben sie allerdings ein leicht erhöhtes Risiko für die Ausbildung eines Lymphoms im Laufe des Lebens. Bei der Virusreplikation wird Provirus in das Zellgenom jeder infizierten Zelle integriert, so dass es zu einer Tumorinduktion kommen kann. Da bei einer regressiven Infektion allerdings deutlich weniger Körperzellen als bei einer progressiv infizierten Katze mit persistierender Virusreplikation betroffen sind, ist das Risiko für die maligne Entartung von Wirtszellen geringer. So entwickeln sich Lymphome bei den regressiv infizierten Tiere meist erst in einem deutlich höheren Alter und es treten vermehrt B-Zell-Lymphom auf.[4]
Katzen mit einer regressiven Infektion sind gegenüber einer erneuten Infektion mit dem FeLV immun. Sie haben meist über Jahre hohe Spiegel an virus-neutralisierenden Antikörpern, selbst wenn sie nie wieder mit dem Virus in Kontakt kommen.[13]
Fokale oder atypische Infektion
Die fokale oder atypische Infektion zeichnet sich durch eine persistierende, aber lokal auf bestimmte Gewebe begrenzte Virus-Replikation aus. Betroffen können beispielsweise einzelne Milchdrüsen, die Harnblase oder die Augenschleimhäute sein. Da die Virusvermehrung nur in bestimmten Geweben stattfindet, sind im Blut meist nur geringe Virusmengen vorhanden, ein Nachweis für Virusprotein fällt meist nur schwach aus. In einigen Fällen findet die Virusreplikation auch nur intermittierend statt, so dass bei den betroffenen Tieres der Nachweis nur zu bestimmten Zeitpunkten positiv verläuft.[14] Eine Ausscheidung der Viren erfolgt lokal, je nach betroffenem Gewebe, oft intermittierend und meist in geringeren Mengen als bei akut virämischen oder progressiv infizierten Katzen.
Nach experimenteller Infektion zeigen bis zu 10 % der Katzen einen atypischen Infektionverlauf, es wird allerdings angenommen, dass dieser Infektionsverlauf unter natürlichen Bedingungen seltener auftritt.[14]
Da bei den betroffenen Tieren nur eine lokale bzw. intermittierende Virusvermehrung und damit auch -ausscheidung stattfindet, sind sie diagnostisch oft schwer zu identifizieren, stellen aber durch die intermittierende Virusausscheidung eine potentielle Infektionsquelle für andere Katzen dar.[14]
Klinisches Bild und Symptome
Die Benennung des Virus als Felines Leukämie-Virus erfolgte nach der Beobachtung, dass mit dem Virus infizierte Katzen häufig Tumoren der weißen Blutzellen, also Leukämien, entwickeln. Allerdings sind die klinischen Auswirkungen einer FeLV-Infektion weder ausschließlich auf die Entstehung von Tumoren der hämatopoietischen Zellen beschränkt, noch sind diese die häufigsten mit einer FeLV-Infektion assoziierten Erkrankungen. Die möglichen klinischen Folgen einer FeLV-Infektion sind außerordentlich vielgestaltig, zumal die Infektion oft eine Immunschwäche verursacht, die zu unspezifischen Sekundärinfektionen führen kann. So ist das Feline Leukämie-Virus bei Katzen für mehr verschiedene klinische Symptome und Syndrome verantwortlich, als jeder andere bisher bekannte einzelne Krankheitserreger.[14] Die häufigsten klinischen Konsequenzen einer FeLV-Infektion sind Immunschwäche, Anämie und Lymphome.[13]
Die Frage, welche Symptome im Verlauf der Infektion auftreten, wird zum einen durch Eigenschaften des die Infektion auslösenden Virusstammes, zum anderen auch durch Eigenschaften des infizierten Tieres bestimmt. So stehen Infektionen mit Viren des Subtyps FeLV-B in Zusammenhang mit der Entstehung von Tumoren, während durch die Infektion mit dem Subtyp FeLV-C eine nicht-regenerative Anämie ausgelöst wird.[14]
Klinische Symptome treten vor allem bei progressiv infizierten Katzen auf, da bei ihnen durch die persistierende Virusreplikation ständig neue Körperzellen infiziert werden. Regressiv infizierte Katzen haben im Vergleich dazu ein deutlich geringeres Risiko, klinische Symptome zu entwickeln, die zudem meist erst nach einer deutlich verlängerten Latenzzeit auftreten.
Klinisch wird zwischen neoplastischen Erkrankungen, die mit der Ausbildung verschiedener tumoröser Veränderungen einhergehen, und nicht-neoplastischen Erkrankungen unterschieden.[1] Zu den nicht-neoplastischen FeLV-assoziierten Erkrankungen und Syndromen zählen pathologische Veränderungen der Blutzellen, Immunschwäche, immun-vermittelte Erkrankungen sowie weitere Syndrome und Symptomkomplexe, wie Neuropathien oder Fortpflanzungsstörungen.
FeLV-assoziierte Neoplasien
Die Neoplastische Form ist durch die Entstehung von Tumoren gekennzeichnet. Die FeLV-Infektion verursacht vor allem Lymphome und Leukämien, seltener auch andere Tumoren des hämatopoetischen Systems. Sehr selten treten auch andere bösartige Tumore, wie z. B. Neuroblastome oder Osteochondrome, auf.[14]
Onkogenese durch FeLV
Nach der Infektion einer Wirtszelle mit dem FeLV wird eine DNA-Kopie des Virusgenoms in das Genom der Wirtszelle integriert. Diese Insertion erfolgt nach dem Zufallsprinzip an verschiedenen Stellen des Wirtsgenoms.[16] Je nachdem, an welcher Stelle des Genoms die Insertion der Virus-DNA erfolgt, kann es zu Veränderungen in der Expression verschiedener Gene der Wirtszelle kommen. Ist hiervon ein Protoonkogen betroffen, so kann dies zu einer malignen Entartung der Wirtszelle führen, die bei der Zellteilung die genetische Information inklusive des FeLV-Genoms an die entstehenden Tochterzellen weitergibt.[14][1]
Protoonkogene sind Gene, deren Transkriptionsproduke eine wichtige Rolle für die Regulation des Zellwachstum, der Zellteilung und der Zelldifferenzierung spielen. Sie codieren zum Beispiel für Wachstumsfaktoren, Wachstumsfaktor-Rezeptoren oder Proteinkinasen, die, wenn sie unkontrolliert exprimiert werden, die Zellproliferation fördern.[4] Ihre Expression unterliegt fein abgestimmten genetischen Kontrollmechanismen. Gehen diese Mechanismen z. B. durch eine Mutation verloren, kommt es zu einer unkontrollierten Expression des Protoonkogen, woraus ein unkontrolliertes Zellwachstum oder Veränderungen in der Zelldifferenzierung resultieren.
Im Replikationszyklus des FeLV wird das Virusgnom in das Genom der Wirtszelle integriert. Geschieht dies in unmittelbarer Nähe eines zellulären Protoonkogens, übernimmt der virale Promotor die Regulation der Expression dieses Gens und regt es zu ständiger Expression an, wodurch es zu einer unkontrollierten Zellproliferation und damit zu Entstehung eines Tumors kommen kann.[16]
Ein weiterer Mechanismus der Tumorinduktion durch FeLV ist der Verlust eines Tumorsuppressorgens durch die Insertion des Virusgenoms. Damit entfällt ein die Genexpression hemmender genetischer Kontrollmechanismus, was ebenfalls zu einer unkontrollierten Expression des bisher kontrollierten Onkogens führt.[16] Dieser Mechanismus tritt allerdings seltener auf, da jeweils zwei Allele eines Gens in der Zelle vorhanden sind, und beide Suppressorgene ausfallen müssen, bevor die Funktion verloren geht.[4]
Durch eine Rekombination zwischen dem Genom des FeLV und der zellulären DNA der Wirtszelle kann es zur Bildung rekombinanter Viren kommen. Dabei können auch zelluläre Onkogene in das Virusgenom integriert werden, die dann bei der Infektion weiterer Wirtszellen in deren Zellgenom integriert werden. Da der Ort der Insertion zufällig bestimmt ist, unterliegt das neu eingefügte Onkogen nicht mehr der physiologischen Kontrolle der zugehörigen Transkriptionseinheit, wodurch es zu einer unkontrollierten Transkription des Genproduktes, was eine maligne Transformation der entsprechenden Wirtszelle zur Folge haben kann.[4]
Aus felinen Lymphomzellen können häufig rekombinante Viren isoliert werden, die aus einer Rekombination zwischen dem FeLV-Virusgenom und dem Myc-Onkogen der Wirtszelle entstanden sind. Diese rekombinanten Viren werden dementsprechend als FeLV/myc bezeichnet. myc codiert für verschiedene Transkriptionsfaktoren, spielt also eine wichtige Rolle bei der Kontrolle der Genexpression. 10 % bis 15 % der FeLV-assoziierten Lymphome enthalten myc-transduzierendes Virus, bei Lymphomen des Thymus sind es sogar fast 30 %.[4]
Ein weiteres häufig aus felinen Lymphomen isoliertes rekombinantes Virus ist das FeLV/tcr, das aus einer Rekombination mit dem Gen für den zellulären T-Zell-Rezeptor entsteht. T-Zell-Rezeptoren sind auf der Oberfläche von lymphoiden Zellen verankert und spielen eine wichtige Rolle bei der Erkennung von Antigenen und der Regulation der Immunantwort. Ihre Aktivierung führt zu Veränderungen in der Zelldifferenzierung und der Genexpression. Nach der Übertragung des tcr-Gens durch das rekombinante FeLV/tcr in das Genom einer Wirtszelle kann es zu einer Überexprimierung des T-Zell-Rezeptors mit gesteigerter Zellproliferation durch autokrine Stimulation und damit zur malignen Entartung der Zelle kommen.[16]
Bei persistent virämischen Katzen kommt es ständig zu einer Infektion weiterer Körperzellen, die jeweils mit einer Integration des Virus-Genoms in das Genom der Wirtszelle verbunden ist. Die Wahrscheinlichkeit einer malignen Entartung durch eine Insertionsmutation oder durch eine Rekombination zwischen dem Virusgenom und zellulären Onkogenen steigt damit entsprechend der Anzahl neu infizierter Zellen.[16] In den Tumorzellen aus den meisten FeLV-assoziierten Lymphomen liegen mehrere verschiedene durch das Virus induzierte genetische Läsionen vor, die in der Regel mehr als einen Genlocus betreffen.[4] Bisher konnten im Genom von Lymphomzellen aus FeLV-infizierten Katzen 12 Stellen an 6 verschiedenen Genloci identifiziert werden, an denen die Virus-DNA integriert wurde.[14]
Einen Sonderfall der Rekombination zwischen FeLV und zellulären Genabschnitten stellt das Feline Sarkomvirus (FeSV) dar. Dieses entsteht de novo in FeLV-infizierten Katzen durch eine Rekombination mit zellulären Onkogenen. Da dabei ein großer Anteil des Virusgenoms durch zelluläre Onkogene ersetzt wird, ist das FeSV replikationsdefekt und bei der Vermehrung auf FeLV-A als Helfervirus angewiesen.[4]
Lymphome
Das Lymphom ist weltweit der häufigste bösartige Tumor bei Hauskatzen. Bis in die 1980er Jahre wurden bis zu 80 % der bei Katzen diagnostizierten Lymphome direkt auf eine FeLV-Infektion zurückgeführt. Seitdem ist der Anteil der FeLV-assoziierten Lymphome an der Gesamtheit der diagnostizierten Lymphome deutlich zurückgegangen. Heute stehen nur noch etwa 13–15 % der bei Katzen diagnostizierten Lymphome mit einer FeLV-Infektion in Zusammenhang, was auf die stark gesunkene Prävalenz der FeLV-Infektion in der Katzenpopulation zurückzuführen ist. Interessanterweise ist diese Entwicklung aber nicht mit einem Rückgang der Gesamtinzidenz für das feline Lymphom verbunden.[4]
60 % bis 80 % der FeLV-infizierten Katzen, die ein Lymphom entwickeln, sind progressiv infiziert und weisen damit eine persistente Virämie auf. Bei jungen Katzen unter einem Jahr, bei denen ein Lymphom diagnostiziert wird, zeigen sogar ca. 90 % eine FeLV-Virämie, bei älteren Tieren mit einem Lebensalter von über 7 Jahren sind es dagegen lediglich 50 %.[16]
Die Wahrscheinlichkeit, an einem Lymphom oder einer Leukämie zu erkranken, ist für progressiv FeLV-infizierte Katzen 60fach höher als für Katzen, die nie mit dem Virus Kontakt hatten. Am häufigsten kommen T-Zell-Lymphome vor.[18] Vor allem bei jungen Katzen unter 3 Jahren treten im Zusammenhang mit der FeLV-Infektion häufig mediastinale oder Thymuslymphome auf.[1] Alimentäre oder gastrointestinale Lymphome werden dagegen vor allem bei älteren Katzen beobachtet und können meist nicht auf eine FeLV-Infektion zurückgeführt werden.[1] Auch spinale Formen werden regelmäßig diagnostiziert.[4]
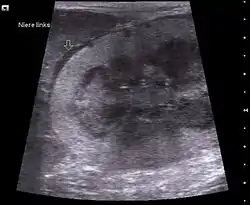
Die allgemeinen Anzeichen einer Lymphomerkrankung sind unspezifisch und beinhalten Teilnahmslosigkeit (Lethargie), Appetitlosigkeit (Anorexie) und Gewichtsverlust. Die weiteren Symptome hängen vom betroffenen Organsystem ab. Bei alimentären Lymphomen können Dünndarm, Blinddarm und Grimmdarm betroffen sein, die Tiere zeigen vor allem Erbrechen und Durchfall. Bei der multizentrischen Form liegt eine generalisierte Erkrankung der Lymphknoten (Lymphoadenopathie) vor, des Weiteren treten Lymphosarkome der Nieren sowie eine Vergrößerung der Milz und/oder der Leber auf. Bei der Thymusform können aufgrund der tumorösen Vergrößerung des Organs Schluckstörungen (Dysphagie) und Atemnot (Dyspnoe) durch Kompression von Speise- und Luftröhre auftreten. In der Pleuraflüssigkeit können häufig neoplastische Zellen nachgewiesen werden.
Bei der Lymphoid-leukämischen Form ist primär das Knochenmark betroffen, entartete Lymphozyten zirkulieren im Blut (Leukämie). Die wichtigsten Symptome sind Schwäche, Anorexie, Gelbsucht, Fieber, Blutarmut (Anämie) und blasse Schleimhäute. Darüber hinaus können eine Erkrankung der Lymphknoten, Milzvergrößerung (Splenomegalie) und Lebervergrößerung (Hepatomegalie) auftreten.
Leukämien
Bei einer Leukämie handelt es sich um eine maligne Erkrankung des blutbildenden oder des lymphatischen Systems. Prinzipiell sind alle hämatopoietischen Zellen für eine FeLV-Infektion empfänglich, so dass sowohl lymphatische als auch myeloische Leukämien (granulozytäre, erythroische und megakaryozytäre) in Assoziation mit einer FeLV-Infektion auftreten können. Kommt es zu einer FeLV-Infektion auf der Stufe der Stammzellen, so kann mehr als eine Zellreihe betroffen sein.[1]
Bei etwa 50 % der Katzen, bei denen eine Leukämie diagnostiziert wird, kann eine FeLV-Infektion nachgewiesen werden.[1]
FeSV-induzierte Tumoren
Einen Sonderfall der FeLV-assoziierten Tumoren stellen durch das Feline Sarkomvirus (FeSV) induzierte Fibrosarkome dar. Das FeSV entsteht in mit FeLV-A infizierten Katzen de novo durch eine Rekombination des FeLV-A mit Protooncogenen der Wirtszelle.[1] Es weist einen Replikationsdefekt auf, weshalb es bei der Vermehrung auf die Anwesenheit von FeLV-A als Helfervirus angewiesen ist, um weitere Körperzellen infizieren zu können. Damit ist die Entstehung von FeSV-assoziierten Fibrosarkomen nur möglich, wenn gleichzeitig eine FeLV-A-Infektion mit persistierender Virämie vorliegt.[16]
Aufgrund des Replikationsdefekts kann das Feline Sarkomvirus nicht horizontal von Katze zu Katze übertragen werden. Trägertiere des FeSV stellen also keine Infektionsquelle für andere Katzen dar.[16]
Da das FeSV bei jedem Replikationszyklus Protooncogene in das Genom der Wirtszelle integriert, induziert es in den infizierten Zellen eine unkontrollierte Proliferation und hat dadurch akut tumor-auslösende Eigenschaften. Die betroffenen Tiere entwickeln schon nach nur kurzer Inkubationszeit polyklonale Fibrosarkome mit niedrigem Differenzierungsgrad, die zeitgleich oder in kurzen Abständen an verschiedenen Körperstellen und Organen auftreten.[18] Sie treten vor allem als multiple Haut- und Unterhautknoten bei jungen Katzen auf und neigen zu schnellem und invasivem Wachstum sowie Metastasierung in die Lunge und in andere Organe.[1]
Veränderungen der Blutzellen
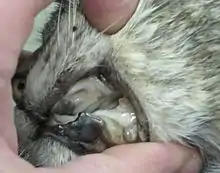
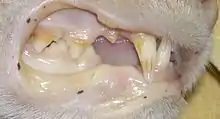
Hämatologische Veränderungen, die in Zusammenhang mit der FeLV-Infektion beschrieben wurden, beruhen vor allem auf einer Störung der Bildung von Blutzellen im Knochenmark (Myelosuppression). Sie umfassen nicht-regenerative und regenerative Anämien, persistierende, transiente oder zyklische Neutropenie, pathologische Veränderungen der Thrombozyten (Thrombozytopenien und Abnormalitäten der Plättchenfunktion), aplastische Anämien (Panzytopenien) und Panleukopenie-ähnliche Syndrome.[18]
Die pathologischen Mechanismen, durch die das FeLV eine Knochenmarkssuppression verursacht, sind noch nicht vollständig verstanden. Zum einen bewirkt der Einbau des FeLV-Provirus in zelleigene Gensequenzen die Disintegration und damit Inaktivierung von Genen. Zum anderen kann durch die virale DNA auch die Expression benachbarter Gensequenzen verändert werden. Myelomonozyten-Vorläuferzellen und stromale Fibroblasten, die eine wichtige Rolle für die Mikroumgebung des Knochenmarks spielen, können nach Infektion mit dem FeLV und der damit verbundenen Provirus-DNA in ihrer Funktion gestört werden, wodurch es zu Störungen der Homöostase im Knochenmark kommt. Zudem kann die FeLV-Infektion die Expression von Antigenen auf der Zelloberfläche von Vorläuferzellen induzieren, wodurch es zu einer immun-vermittelten Zerstörung der Zellen kommt.[18]
Bei mehr als 50 % der FeLV-infizierten und erkrankten Katzen tritt eine Anämie auf.[1] Nur etwa 10 % der FeLV-assoziierte Anämien sind regenerativ, der weit überwiegende Anteil ist dagegen nicht-regenerativ. Der wichtigste Pathomechanismus bei der Entstehung von FeLV-assoziierten Anämien ist die direkte Infektion der hämatopoetischen Stammzellen und der Stromazellen, die für das Umgebungsmilieu der hämatopoetischen Zellen verantwortlich sind. Zusätzlich können bei FeLV-infizierten Katzen auch andere Faktoren eine nicht-regenerative Anämie verursachen. So können die durch die Infektion verursachten chronischen Infektionen zu hohen Cytokin-Spiegeln führen, die schließlich zu einer Anämie führen. Bei FeLV-assoziierten Leukämien können die proliferierenden Tumorzellen im Knochenmark die anderen Vorläuferzellen verdrängen, und so die Bildung der roten Blutkörperchen unterdrücken (englisch Crowding out).[14]
Vor allem die Infektion mit dem Subtyp FeLV-C verursacht durch eine Störung der Zellteilung eine massive Knochenmarksdepression, die zu einer schweren aregenerativen Anämie, der sogenannten Pure Red Cell Aplasia führt. Bei den betroffenen Tieren ist eine Makrozytose der Erythrozyten bei gleichzeitigem Fehlen der Retikulozyten zu beobachten.[1] In einem fortgeschrittenen Stadium der FeLV-C-Infektion leiden die Tiere häufig unter einer aregenerativen Panzytopenie.[1]
Bei vielen progressiv FeLV-infizierten Katzen tritt eine reduzierte Anzahl der Blutplättchen (Thrombozytopenie) auf, die je nach Ausmaß zu einer erhöhten Blutungsneigung führt. Die Thrombozytopenie kann zum einen durch eine reduzierte Plättchenproduktion aufgrund der Infektion der Thrombozytenvorläuferzellen (Megakaryozyten) oder einer leukämischen Infiltration des Knochenmarks bedingt sein. Zum anderen kann eine immun-vermittelte Zerstörung mit verkürzter Überlebenszeit der Thrombozyten auftreten, die häufig mit einer immun-vermittelten hämolytischen Anämie verbunden ist. Neben einer verminderten Thrombozytenzahl kann auch eine Störung der Plättchenfunktion auftreten.[14]
Neben Veränderungen des roten Blutbildes und der Thrombozyten kann die FeLV-Infektion auch zu Störungen des weißen Blutbildes führen. So werden bei FeLV-infizierten Tieren häufig eine Verminderung der Neutrophilen Granulozyten diagnostiziert. In einigen Fällen kann eine Hypoplasie aller Granulozytenstadien beobachtet werden, was wahrscheinlich durch eine Infektion der Neutrophilen-Vorläuferzellen bedingt ist. Da sich in einigen Fällen die Neutrophilen-Zahl nach einer Verabreichung von Glucocorticoiden wieder erholt, wird auch ein immun-vermittelter Mechanismus bei der Entstehung der Neutropenie diskutiert.[14]
Bei vielen persistent virämischen Katzen zeigen die Neutrophilen außerdem eine verminderte Chemotaxis und eine verminderte Phagocytosefunktion, so dass neben der reinen Zellzahlverminderung auch eine Störung der Funktion vorliegt.[14]
Eine Neutropenie kann isoliert, oder in Verbindung mit einer verminderten Lymphozytenzahl auftreten. Das FeLV kann sich direkt in den Lymphozyten replizieren.[1] Meist sind sowohl die T-Helferzelle als auch die Cytotoxischen T-Zellen von der Lymphopenie betroffen; es wird aber auch ein verstärkter Verlust CD4-positiver T-Helfer-Zellen beobachtet, so dass es zu einer Umkehr des CD4+/CD8+-Verhältnisses kommt.
Das feline panleukopenie-ähnliche Syndrom (FPLS), das auch unter der Bezeichnung FeLV-assoziierte Enetritis oder Myeloblastopenie bekannt ist, ist durch eine schwere Leukopenie (<3000 Zellen/µl), eine Enteritis und eine Zerstörung der Epithelien der Darmkrypten gekennzeichnet. Die Symptome ähneln dadurch denen der durch das Feline Panleukopenie-Virus (FPV) verursachten Felinen Panleukopenie und äußern sich in blutigem Durchfall, Erbrechen, Geschwüren der Maulschleimhaut, Zahnfleischentzündungen, Fressunlust und Gewichtsverlust. Es ist unklar, ob dieses Syndrom direkt durch die FeLV-Infektion verursacht wird oder ob es sich um eine Koinfektion mit dem FPV handelt.[18]
Schwächung des Immunsystems und Sekundärinfektionen
Unabhängig davon, ob die Tiere klinische Symptome einer FeLV-Inkeftion zeigen, ist jede Katze mit persistierender FeLV-Virämie immungeschwächt und leidet unter einer verzögerten und reduzierten primären wie auch sekundären Immunantwort.[13]
Die Mechanismen, die hinter der FeLV-assoziierten Immunschwäche stehen, sind sehr komplex und vielgestaltig. Die häufig auftretenden Veränderungen des weißen Blutbildes wie Neutropenie, Lymphopenie, Funktionsstörungen der Neutrophilen, der Verlust von CD4-positiven-T-Zellen und/oder CD8-positiven-Lymphozyten führen zu einer Schwächung sowohl der zellulären als auch der humoralen Immunantwort. Daraus resultiert eine verminderte Fähigkeit der infizierten Tiere, immunologisch adäquat auf Infektionen und andere Noxen zu reagieren.[13]
Viele FeLV-infizierte Katzen weisen darüber hinaus auch eine Veränderung der Zytokin-Produktion auf. Die verschiedenen Zytokine spielen eine wichtige Rolle bei der Koordination der immunologischen Antwort. Veränderungen in ihrem Zusammenspiel führen deshalb zu Störungen der immunologischen Abwehr, die sowohl in einer Verminderung als auch einer überschießenden immunologischen Reaktion münden können.[14] Während einige Katzen reduzierte Interleukin-2- und Interleukin-4-Spiegel zeigen, wird die Interleukin-1-Produktion durch die FeLV-Infektion nicht beeinflusst. Im Vergleich zu gesunden Katzen produzieren die T-Zellen infizierter Katzen deutlich weniger B-Zell-stimulierenden Faktor (Interleukin-6). Der Spiegel an Interferon-γ kann erniedrigt oder aber erhöht sein. Im Serum infizierter Katzen wird zudem oft ein erhöhter Spiegel des Tumornekrosefaktor-α (TNF-α) nachgewiesen. Diese Veränderungen der Zytokin-Konzentrationen kann zu einer Dysregulation der immunologischen Abwehr beitragen.
Die Schwächung des Immunsystems ist die klinisch häufigste und bedeutendste Konsequenz der FeLV-Infektion. Sie ist für die weit überwiegende Anzahl der FeLV-assoziierten Symptome verantwortlich und führt häufig zu behandlungsbedürftigen Sekundärinfektionen mit bakteriellen, viralen und protozoalen Erregern sowie Pilzinfektionen.
Diese Infektionen können, bedingt durch die Immunschwäche, stärkere Symptome verursachen als bei gesunden Katzen. Dazu zählen z. B. Infektionen mit Mycoplasma haemofelis oder Cryptokokken. Infektionen, die bei gesunden Katzen normalerweise symptomlos verlaufen, wie die Infektion mit Toxoplasma gondii, können bei immungeschwächten FeLV-infizierten Katzen schwere Symptome hervorrufen. Darüber hinaus treten auch Infektionen mit opportunistischen Erregern, wie z. B. Salmonellen auf, die bei gesunden Katzen keine Infektion auslösen könnten.[14] Die Behandlung der Sekundärinfektion ist oft langwieriger und bedarf einer aggressiveren Therapie als bei gesunden Katzen.[13]
Eine weitere Konsequenz aus der Schwächung der Immunsantwort ist eine verminderte Tumorabwehr, so dass progressiv infizierte Katzen ein erhöhtes Risiko haben, auch an nicht direkt durch das FeLV-Virus induzierten Tumoren zu erkranken.[14]
Immun-vermittelte Erkrankungen
Obwohl im Verlauf einer FeLV-Infektion die humorale Immunantwort auf spezifische Stimulation abnimmt, zeigen einige FeLV-infizierte Katzen auch unspezifisch erhöhte Level an Immunglobulin G (IgG) und Immunglobulin M (IgM). Die mit der FeLV-Infektion einhergehende immunologische Dysregulation, vor allem die Störung der T-Suppressorzellaktivität kann zu einer exzessiven Antikörperantwort auf die chronisch persistierende Infektionen führen. Da die gebildeten Antikörper nicht neutralisieren können, kommt es zur Bildung von Antigen-Antikörper-Komplexen, die sich im engen Kapillarbett ablagern und dort zu Gefäßentzündungen führen. Als klinische Konsequenz können eine Glomerulonephritis, Polyarthritis oder eine Uveitis mit Ablagerungen von Immunkomplexen in der Iris und den Ziliarkörpern auftreten. Seltener wird auch eine immunvermittelte hämolytische Anämie (IHA) beobachtet.[14]
Stomatitis
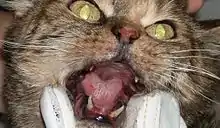
Bei einigen infizierten Katzen kann es zu einer chronischen ulzerativ-proliferativen Gingivostomatitis kommen. Histologisch lassen sich in der Schleimhaut eingewanderte Plasmazellen und Lymphozyten nachweisen, begleitet von einer unterschiedlich stark ausgeprägten neutrophilen und eosinophilen Entzündung. Die Läsionen sind sehr schmerzhaft, weshalb die betroffenen Tiere oft die Nahrungsaufnahme verweigern und stark abmagern. Häufig kommt es auch zum Ausfall von Zähnen.[14]
Die Ursachen für die FeLV-assoziierte Gingivostomatitis sind unklar. Die histologischen Befunde legen aber auch hier die Beteiligung einer überschießenden Immunantwort auf die chronische Antigen-Stimulation oder eine immunologische Dysregulation nahe. Eine mehr oder weniger starke Beteiligung von Sekundärinfektionen wie z. B. mit Caliciviren, gilt als wahrscheinlich.[14]
Neuropathien
FeLV-infizierten Katzen können neurologische Symptome entwickeln, die meistens eine Folge von Lymphomen oder lymphozytären Infiltrationen des Gehirns oder des Rückenmarks sind, die zu einer Kompressionen des umliegenden Gewebes führen. Da aber auch bei Katzen, bei denen in einer späteren Sektion keinerlei tumoröse Veränderungen des Zentralnervensystems festgestellt werden konnten, neurologischen Symptome beobachtet wurden, wird angenommen, dass das FeLV bei Infektionen von Nervenzellen auch eine direkte neurotoxische Wirkung entfalten kann. So wurde nachgewiesen, dass Glycoproteine der Virushülle den intrazellulären Spiegel an freiem Calcium in den Nervenzellen steigern können, so dass es zum neuronalen Zelltod kommt. Mikroskopisch konnten degenerative Veränderungen der weißen Substanz mit einer Dilatation der Myelinscheiden sowie geschwollene Axone im Bereich des Rückenmarks und des Hirnstamms nachgewiesen werden.[14]
Zu den am häufigsten beschriebenen neurologischen Symptomen gehören abnorme Lautäußerungen, Hyperästhesie sowie Paresen, die sich bis zur Paralyse verschlechterten. Einige Katzen zeigen Anisokorie, Mydriasis, zentrale Blindheit oder ein Horner-Syndrom, andere leiden unter Harninkontinenz. In der Regel beginnen die Symptome mild und verschlimmern sich im Laufe der Erkrankung zunehmend.[14]
Fruchtbarkeitsstörungen
Bei trächtigen Katzen führt eine FelV-Virämie zu embryonalen Fruchttod, zu Totgeburten oder zur Geburt virämischer Kätzchen, die kümmern und nach kurzer Zeit sterben (Fading-Kitten-Syndrom).[13] Von regressiv infizierten Katzen wird das Virus in der Regel nicht auf die Kätzchen übertragen, allerdings kommt es vor, dass einzelne Kätzchen eines Wurfes später eine Virämie entwickeln. Die Infektion erfolgt in diesen Fällen über die Muttermilch aus einzelnen Mammarkomplexen, in denen das Virus überdauern kann. Durch die Aktivierung des Drüsengewebes gegen Ende der Trächtigkeit kann die Virusreplikation reaktiviert werden, so dass infektiöse Viren mit der Muttermilch des betroffenen Mammarkomplexes ausgeschieden wird.[13]
Diagnose
Nachweisverfahren
Für den diagnostischen Nachweis einer FeLV-Infektion stehen verschiedene Methoden zur Verfügung. Neben dem Nachweis von Virus-Protein kann mit Hilfe der Polymerase-Kettenreaktion sowohl virale DNA als auch virale RNA in Blutproben oder im Knochenmark nachgewiesen werden. Des Weiteren stehen ein Immunfluoreszenz-Assay (IFA) und ein Antikörpernachweis zur Verfügung. Bei der Interpretation der durch die verschiedenen Methoden erhobenen Befunde muss immer berücksichtigt werden, dass die FeLV-Infektion sehr verschiedene Verlaufsformen nehmen kann und dass auch regressiv infizierte Katzen das Virus nicht vollständig aus dem Körper eliminieren können.
| Infektionsverlauf | p27-Antigennachweis aus Blut | virale RNA-PCR aus Blut | provirale DNA-PCR aus Blut | Virusausscheidung | Entwicklung FeLV-assoziierter Erkrankungen |
|---|---|---|---|---|---|
| progressive Infektion | positiv | positiv | positiv | positiv | wahrscheinlich |
| regressive Infektion | negativ oder transient | negativ oder transient | positiv | negativ | unwahrscheinlich |
| abortive Infektion | negativ | negativ | negativ | negativ | unwahrscheinlich |
| fokale Infektion | negativ | negativ | negativ oder positiv | variabel | unwahrscheinlich |
Da sich aus einem positiven Nachweis einer FeLV-Infektion Konsequenzen in Bezug auf die Haltung der betroffenen Katzen (Notwendigkeit der Separation) sowie für das Vorgehen bei der Behandlung klinischer Erkrankungen bis hin zur Entscheidung für eine Euthanasie ergeben können, sollte jedes positive Resultat eines durchgeführten Screening-Tests durch eine Testwiederholung verifiziert werden. Dies gilt vor allem für klinisch unauffällige Tiere, deren Anamnese auf ein nur geringes Infektionsrisiko schließen lässt, da hier die Wahrscheinlichkeit falsch-positiver Testergebnisse hoch ist.
Als diagnostischer goldener Standard gilt die Isolation des Felinen Leukämie-Virus, die mit Hilfe einer Zellkultur erfolgt. Die Isolierung kann aus infizierten Zellen des Blutes oder Gewebeproben erfolgen. Dieses Verfahren wird vor allem in wissenschaftlichen Studien zum Nachweis einer FeLV-Infektion eingesetzt, Aufgrund des hohen Aufwandes wird dieser Test jedoch nicht in der veterinärmedizinischen Routinediagnostik verwendet.[13]
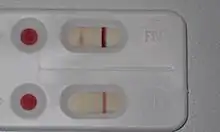
Routinemäßig wird für die Diagnostik der FeLV-Infektion vor allem der Nachweis des löslichen viralen Kapsid-Proteins p27 im Blut mit Hilfe eines ELISA als Screening-Test verwendet (sog. p27-Antigen-Test). Für diese Untersuchung sind Schnelltests verschiedener Hersteller für den Gebrauch in der Tierarztpraxis verfügbar. Auch alle auf die Veterinärmedizin spezialisierten Labore bieten einen Nachweis des p27-Antigens aus Blutproben an. Prinzipiell ist der Nachweis des p27-Antigens auch im Speichel oder der Tränenflüssigkeit möglich. Da das Virus hier jedoch bei manchen Tieren nur intermittierend ausgeschieden wird, ist die Untersuchung einer Blutprobe vorzuziehen.[1]
In Gebieten mit niedriger Prävalenz ist die Aussagekraft eines positiven Testergebnisses niedriger, bei den meisten Testsystemen liegt der positive prädiktive Wert bei ca. 80 %. Deshalb sollte jeder positive Test überprüft werden. Durch die hohe Sensitivität der Screeningtests und die insgesamt niedrige Prävalenz der FeLV-Infektion können negative Testergebnisse dagegen als sehr zuverlässig angesehen werden (hoher negativer prädiktiver Wert).[15]
Der Nachweis des p27-Antigens korreliert gut mit dem Vorhandensein einer Virämie.[10] Die meisten Katzen, die sich mit FeLV infizieren, reagieren innerhalb von 2 bis 3 Wochen nach der Infektion positiv im Antigennachweis. Im Falle der regressiven Infektion werden die Tiere innerhalb von 2 bis 8 weiteren Wochen negativ für p27, in seltenen Fällen kann dies auch erst nach Monaten passieren. Bei progressiv infizierten Katzen lässt sich jedoch auch längere Zeit nach der Infektion Virus-Antigen im Blut nachwiesen.[15] Ein positiver Test sollte deshalb nach ca. 6 Wochen wiederholt werden, um eine regressive von einer progressiven Infektion unterscheiden zu können. Bei einem zweiten positiven Ergebnis kann ein dritter Test nach weiteren 10 Wochen erfolgen. Tiere, die dann immer noch positiv reagieren, sind mit sehr hoher Wahrscheinlichkeit persistierend virämisch.[1]
Über eine Polymerase-Kettenreaktion kann zell-gebundene DNA (Provirus) in Blutproben, Knochenmarksbioptaten und -aspiraten sowie Gewebeproben nachgewiesen werden.[15] Regressiv infizierte Katzen reagieren im p27-Antigen-Nachweis negativ, da bei ihnen keine Virusreplikation stattfindet und deshalb kein virales Protein im Blut zirkuliert. Bei diesen Tieren kann aber mit Hilfe der PCR FeLV-Provirus-DNA in den Zellen des Blutes nachgewiesen werden.[15]
Mit Hilfe der PCR kann außerdem virale RNA in Proben infizierter Katzen nachgewiesen werden. Als Untersuchungsmaterial können Vollblut, Serum, Plasma, Speichel oder Kot verwendet werden. Mit diesem Verfahren kann auch freies, nicht an die Wirtszelle gebundenes Virus nachgewiesen und quantifiziert werden. Das Ergebnis der DNA-PCR und der RNA-PCR müssen nicht immer übereinstimmen, so reagieren viele Katzen, die eine Virämie überwinden konnten, im p27-Nachweis und in der RNA-PCR negativ, da sich im Blut kein Virus mehr befindet. Da das FeLV-Genom aber als Provirus in das Genom infizierter Wirtszellen integriert wurde, fällt die DNA-PCR positiv aus.[13]
Granulozyten, Lymphozyten und Thrombozyten virämischer Katzen enthalten das Gag-Protein. Dieses kann in Ausstrichen des Blutes oder des Knochenmarks durch einen indirekten Immunfluoreszenz-Test (IFA) nachgewiesen werden. Dieses Verfahren bietet zwar eine relativ niedrige Sensitivität, Katzen, die im IFA positiv reagieren, haben aber mit hoher Sicherheit auch eine Virämie. Allerdings kann bei Katzen, die unter einer Leukopenie leiden, oder bei denen nur einige der peripheren Leukozyten infiziert sind, der IFA trotz bestehender Virämie falsch negativ ausfallen.[15]
Der IFA reagiert erst nach der Infektion des Knochenmarks und während der zweiten Virämie positiv, da erst dann an die Blutzellen gebundenes Virus in die Blutbahn gelangt. Da es sich dabei um ein bereits fortgeschrittenes Stadium der Infektion handelt, ist es unwahrscheinlich, dass Katzen, die im IFA positiv getestet werden, zu einem späteren Zeitpunkt negativ reagieren, weil sie eine regressive Infektion entwickelt haben.[15]
Immunkompetente Katzen bilden nach einer überstandenen Virämie lebenslang hohe Spiegel an Antikörpern. Da aber viele Tiere auch Antikörper gegen endogenes FeLV des Katzengenoms bilden, war ein Antikörpernachweis zur Diagnose einer FeLV-Infektion bisher nur sehr eingeschränkt geeignet.[13] Allerdings wurde mittlerweile eine Testmethode zum Nachweis von Antikörpern gegen das p15(E)-Protein entwickelt, mit der sich Antikörper, die aufgrund einer stattgefundenen FeLV-Infektion gebildet wurden sicher von Antikörpern gegen endogenes FeLV unterscheiden lassen.[10] Dieses Verfahren wird allerdings bisher nicht in der Routinediagnostik eingesetzt.
In der Regel werden mit Hilfe der verschiedenen zur Verfügung stehenden Untersuchungsverfahren einzelne Tiere getestet. Für Screening-Untersuchungen in größeren Katzengruppen, wie etwa in Streunergruppen, Tierheimen oder Mehrkatzenhaushalten, können Proben für eine RNA-PCR-Untersuchung gepoolt werden. Die RNA-PCR ist so sensitiv, dass eine einzelne infizierte Katze in einem Pool von bis zu 30 Proben nachgewiesen werden kann.[10]
Differentialdiagnose
Da die FeLV-Infektion selbst mit einer Vielzahl an Symptomen assoziiert ist und die induzierte Immunschwäche zudem zahlreiche verschiedene Sekundärinfektionen begünstigt, ist das mögliche Krankheitsbild äußerst variabel. Die induzierten Tumoren verursachen je nach Lokalisation unterschiedliche Symptome. Aus diesem Grund kommt der diagnostischen Aufarbeitung und der Differentialdiagnose bei der FeLV-Infektion eine besondere Stellung zu. So müssen je nach vorliegenden Symptomen andere neoplastische Erkrankungen, das Immundefizienzsyndrom der Katzen (FIV-Infektion, Katzenaids), die feline infektiöse Peritonitis (FIP), die feline infektiöse Anämie (Hämobartonellose) und andere Infektionskrankheiten ausgeschlossen werden.
Grundsätzlich wird empfohlen, bei allen Katzen mit Symptomen, die in Zusammenhang mit einer FeLV-Infektion stehen könnten, einen Test auf p27-Antigen durchzuführen. Dies gilt auch für kranke Katzen, für die vor längerer Zeit bereits ein Test auf FeLV mit negativen Ergebnis durchgeführt wurde, wenn nicht sicher ausgeschlossen werden kann, dass in der Zwischenzeit ein Kontakt mit dem Virus stattgefunden hat.[15] Auch bei Symptomen, für die eine Infektion als Ursache nachgewiesen werden kann, muss bedacht werden, dass gleichzeitig eine FeLV-Infektion mit einhergehender Immunschwäche vorliegen und die Entstehung anderer Infektionen begünstigen kann. Vor allem Katzen, die rezidivierend an Abszessen der Unterhaut oder Entzündungen in der Maulhöhle leiden, sollten deshalb auf das Vorliegen einer FeLV-Infektion getestet werden.[15]
Therapie
Eine gibt keine Therapiemöglichkeit, mit der das Virus bei einer progressiv infizierten Katzen vollständig aus dem Körper entfernt werden kann. Auch bei regressiv infizierten Katzen, die Proviren in ihren Körperzellen tragen, ist eine Elimination des Virus aus dem Körper nicht möglich. Aus diesem Grund gibt es keine ursächliche Therapie der FeLV-Infektion. Die Behandlung erkrankter FeLV-infizierter Katzen zielt deshalb vor allem auf eine symptomatische Behandlung der jeweils auftretenden Symptome ab, womit versucht werden soll, die Leiden der Tiere zu lindern (Palliative Therapie).
Die Möglichkeiten zur antiviralen Chemotherapie erhalten in der Tiermedizin zunehmende Aufmerksamkeit, ihr Einsatz ist aber noch nicht weit verbreitet. Mit verschiedenen in der Humanmedizin vor allem für die HIV-Therapie eingesetzten Wirkstoffen konnte bei Katzen eine Hemmung der FeLV-Replikation erreicht werden. Mit dem in der Humanmedizin gegen Retro-Viren eingesetzten Wirkstoff Azidothymidin (AZT) konnte bei Katzen der Virus-Load im Plasma reduziert und sowohl der immunologische und als auch der klinische Zustand verbessert werden, so dass eine Verbesserung der Lebensqualität und eine Verlängerung der Lebenserwartung erreicht wurden. Auch durch die Verabreichung des Wirkstoffs Raltegravir konnte eine Hemmung der Virusreplikation erzielt werden, so dass innerhalb einer Woche durch diese Therapie eine deutliche Reduktion der Virus-Load im Blut erreicht wurde.[13] Allerdings gelingt es mit keinem dieser Wirkstoffe, eine persistierende Virämie vollständig zu unterdrücken. Die Wirkstoffe müssen deshalb über einen längeren Zeitraum verabreicht werden, um langfristig einen niedrigen Virus-Load zu erreichen und um den Ausbruch klinischer Symptome zu verhindern bzw. hinauszuzögern.[10] Obwohl die Medikamente von Katzen oft gut vertragen werden, ist eine langfristige Verabreichung oft mit deutlichen Nebenwirkungen verbunden.[20]
Katzen, bei denen eine progressive FeLV-Infektion mit persistierender Virämie diagnostiziert wurde, die aber keinerlei klinische Symptome zeigen, bedürfen keiner medikamentösen Behandlung. Allerdings sollten sie strikt als Wohnungskatzen gehalten werden, da auf diese Weise das Risiko von Sekundärinfektionen reduziert werden kann. Gleichzeitig kann nur so sicher verhindert werden, dass sie andere Katzen anstecken.[20] Bei diesen Katzen sollten die üblichen Routineimpfungen durchgeführt werden, um die immungeschwächten Tiere vor Infektionen zu schützen. Allerdings muss dabei berücksichtigt werden, dass diese Tiere aufgrund einer möglicherweise vorhandenen Schwächung des Immunsystems mit einer nur unzureichenden Immunantwort auf die Impfung reagieren können. Deshalb ist der Impfschutz FeLV-infizierter Katzen nicht vollumfänglich und nicht mit dem gesunder Tiere zu vergleichen, so dass kürzere Impfintervalle als bei gesunden Tieren (z. B. alle 6 statt alle 12 Monate) in Erwägung gezogen werden sollten.[14] Generell sollte für diese Tiere ein inaktivierter Impfstoff gegenüber Lebendimpfstoffen der Vorzug gegeben werden, da bei einem geschwächten Immunsystem nicht ausgeschlossen werden kann, dass selbst die abgeschwächten Impfstämme pathologisches Potential entfalten.[13]
Halter einer FeLV-positiven Katze sollten zudem darauf verzichten, unerhitztes Futter zu geben, da dieses die Gefahr der Übertragung von bakteriellen oder parasitären Infektionen birgt. Der Gesundheitszustand FeLV-infizierter symptomloser Katzen sollte regelmäßig überprüft werden. So empfiehlt es sich, in Abständen von 6 bis 12 Monaten ein Blutbild, eine blutchemische Untersuchung und eine Urinanalyse durchführen zu lassen, um auftretende gesundheitliche Probleme frühzeitig erkennen und behandeln zu können.[13]
FeLV-infizierte Katzen, bei denen sich Symptome einer Erkrankung zeigen, sollten unverzüglich einer gründlichen Diagnostik und Behandlung unterzogen werden, um eine möglichst frühe Intervention zu ermöglichen. Dabei ist zunächst abzuklären, welche Erkrankung den Symptomen primär zugrunde liegt. Nicht alle auftretenden Symptome müssen direkt in Zusammenhang mit der FeLV-Infektion stehen. Eine sorgfältige und umfassende Diagnostik ist deshalb wichtig, um die zugrunde liegende Erkrankung gezielt und konsequent behandeln zu können.[20]
Aufgrund der meist vorhandenen Immunschwäche ist oft eine längere oder aggressivere Therapie notwendig als bei FeLV-negativen Tieren, z. B. bei einer antibiotischen Behandlung. Corticosteroide, andere Immunosuppressiva oder Medikamente, die zu einer Knochenmarksuppression führen können, sollten grundsätzlich nicht verabreicht werden, außer zur Behandlung FeLV-azzoziierter Tumoren oder immunvermittelter Erkrankungen.
Bei FeLV-positiven Katzen, die unter einer Anämie leiden, ist zunächst die kausale Ursache zu klären. Durch die Immunschwäche können Sekundärinfektionen auftreten, die eine Anämie verursachen (z. B. Mycoplasma spp.). Ist dies der Fall, muss eine gezielte Behandlung dieser Infektionen erfolgen. Bei stark ausgeprägter Anämie kann eine Bluttransfusion durchgeführt werden. Falls die Anämie FeLV-induziert ist, kann ein Behandlungsversuch mit Glukokorticoiden unternommen werden, da einem Teil der mit FeLV assoziierten Anämien ein immun-vermitteltes Geschehen zugrunde liegt und diese Katzen gut auf die Therapie ansprechen.[20] Der Einsatz von Glucocorticoiden sollte bei FeLV-positiven Katzen allerdings nur nach strenger Indikation erfolgen, da der immunsupprimierende Effekt zu einer weiteren Schwächung des Immunsystems beitragen kann.
Zur Behandlung des felinen Lymphoms gibt es in der Veterinärmedizin etablierte Behandlungsprotokolle unter Einsatz von chemotherapeutischen Medikamenten. Bewährt haben sich das COP-Schema (Cyclophosphamid, Vincristin, Prednisolon) sowie der Wirkstoff Chlorambucil. In einigen Fällen sprechen die Tumore gut auf die Behandlung an. Obwohl durch die Chemotherapie oft die Remission eines Lymphoms erreicht werden kann, muss klar sein, dass auch eine erfolgreiche Chemotherapie keinen Einfluss auf eine persistierende Virämie hat. Bei FeLV-positiven Katzen ist die mittel- bis langfristige Prognose deshalb ungünstiger als bei FeLV-negativen Katzen mit malignem Lymphom.[21][13]
Auch bei FeLV-infizierten Katzen mit neurologischen Symptomen ist zunächst die Ursache der Symptome abzuklären. Neben den direkt toxischen Effekten der FeLV-Replikation können den neurologischen Symptomen auch ein Lymphom des ZNS, Sekundärinfektionen (zum Beispiel mit Cryptococcus ssp.) oder eine Toxoplasmose zugrunde liegen. Infektionskrankheiten müssen in diesem Fall direkt behandelt werden. Kann keine andere ursächliche Erkrankung festgestellt werden und wird davon ausgegangen, dass die neurologischen Symptome direkt durch das FeLV verursacht werden, so kann ein Behandlungsversuch mit dem Virustatikum Azidothymidin (AZT) durchgeführt werden.[20]
Bei FeLV-infizierten Katzen, die aufgrund der mit der Infektion einhergehenden Immunschwäche unter rezidivierenden Infektionen leiden, müssen diese Infektionen konsequent behandelt werden, um eine gute Lebensqualität zu gewährleisten. Eine Behandlung mit rekombinantem felinen Interferon Omega als Immunmodulator ist möglich.[20]
Prognose
Die Prognose für persistent virämische Katzen ist insgesamt als ungünstig zu beurteilen. Bei dem weit überwiegenden Anteil kommt es innerhalb von Monaten zur Ausbildung klinischer Symptome und die Tiere haben eine reduzierte Lebenserwartung. Studien zufolge sterben ca. 50 % der progressiv infizierten Katzen innerhalb von 2 Jahren, 80 % innerhalb von 3 Jahren nach der Diagnosestellung.[14]
Allerdings können einige Katzen auch mit einer persistierenden Virämie über viele Jahre bei guter Gesundheit leben, bevor sie erste Symptome entwickeln.[13] Die Sterberate kann durch eine gute Versorgung und Pflege durch den Halter sowie Wohnungshaltung, durch die sich das Risiko von Sekundärerkrankungen vermindern lässt, deutlich reduziert werden. Vor allem die frühzeitige und konsequente Behandlung von Sekundärinfektionen kann zu einer Erhöhung der Lebenserwartung bei guter Lebensqualität beitragen.[14]
Die Entscheidung, ob eine FeLV-infizierte Katze euthanasiert oder behandelt werden soll, sollte niemals allein auf dem Vorliegen einer FeLV-Infektion basieren.[20] Für virämische, aber symptomlose Katzen ist eine Euthanasie nicht indiziert, da es durchaus Jahre dauern kann, bis die Erkrankung ausbricht. Allerdings ist streng darauf zu achten, dass diese Tiere keinen Kontakt zu FeLV-negativen Tieren haben, um eine Übertragung des Virus zu vermeiden. Falls eine Separierung nicht möglich ist, z. B. bei Streunerkatzen, die nicht an eine ausschließliche Wohnungshaltung gewöhnt werden können, ist eine Euthanasie in Erwägung zu ziehen, um die Verbreitung der FeLV-Infektion zu verhindern.[10]
Prophylaxe
Impfung

Seit 1985 sind Impfstoffe gegen FeLV kommerziell verfügbar.[1] Zugelassen sind adjuvantierte Präparationen aus inaktiviertem Virus, adjuvantiierte Präparationen aus rekombinantem Virusoberflächenprotein sowie ein adjuvans-freier, auf dem Kanarienpockenvirus basierender rekombinanter Vektorimpfstoff. Der erzielte Impfeffekt beruht auf einer zellulären Immunität, die schnell zur Bildung neutralisierender Antikörper führt, sobald Katzen mit dem natürlich vorkommenden FeLV-Feldvirus in Kontakt kommen.[13] Alle Impfstoffe bieten nach der abgeschlossenen Grundimmunisierung einen zuverlässigen Schutz gegen die Entwicklung einer persistierenden Virämie und gegen die Ausbildung klinischer Symptome der FeLV-Infektion. Allerdings induziert keiner der verfügbaren Impfstoffe zuverlässig eine sterile Immunität, so dass eine Infektion auch bei geimpften Katzen nicht verhindert wird, die diese aber dank des Impfschutzes sicher überwinden können.[22] Dies bedeutet, dass auch bei geimpften Katzen nach einem Kontakt mit dem FeLV Provirus-DNA im Blut und meist auch virale RNA im Plasma nachweisbar ist, allerdings im Vergleich zu persistent virämischen Katzen nur in sehr geringer Konzentration, so dass sie klinisch nicht relevant sind und diese Katzen bei normalem Infektionsdruck als sicher geschützt vor der Ausbildung FeLV-assoziierter Erkrankungen angesehen werden können.[13]
Sowohl die deutschsprachigen nationalen,[23][24][25] als auch die internationalen[26][27][28] Leitlinien zur Impfung von Kleintieren stufen die Impfung gegen das Feline Leukämie-Virus als Non-Core-Impfung ein. Dies bedeutet, dass eine FeLV-Impfung nicht generell für jede zu impfende Katze empfohlen wird, sondern nur nach Abwägung des individuellen Infektionsrisikos erfolgen soll. Empfohlen wird die Impfung für die Katzen, die einem Infektionsrisiko ausgesetzt sind, weil sie Kontakt zu Katzen mit ungeklärtem Infektionsstatus haben können. Dies ist z. B. für Katzen mit Freigang, für Zucht- und Ausstellungstiere oder Tiere, die in ein Tierheim aufgenommen werden, der Fall. Nur in den Fällen, in denen die Möglichkeit einer Exposition mit dem FeLV vollständig ausgeschlossen werden kann, sollte auf die FeLV-Impfung verzichtet werden. Geographische Unterschiede in der FeLV-Prävalenz sowie die Tatsache, dass sich die Haltungsbedingungen der Katze, und damit das Risiko einer FeLV-Exposition im Laufe der Zeit, z. B. durch einen Umzug, ändern können, sollten bei der Entscheidung, ob eine Katze gegen FeLV geimpft werden soll, berücksichtigt werden. Generell bietet die FeLV-Impfung einen ausreichenden Schutz gegenüber den potentiell tödlichen Folgen einer Infektion, was gegenüber den nur geringen Risiken für Nebenwirkungen abgewogen werden muss.[13]
Jungkatzen können ab einem Alter von 8 Wochen gegen FeLV geimpft werden. Zur Grundimmunisierung werden zwei Injektionen im Abstand von 3 bis 4 Wochen verabreicht. Mit einer weiteren Injektion nach einem Jahr ist die Grundimmunisierung abgeschlossen.[13] Die meisten verfügbaren Impfstoffe sind für ein Impfintervall von einem Jahr zugelassen. Da die Empfänglichkeit gegenüber dem Virus aber mit zunehmendem Alter sinkt, werden bei Katzen, die älter als 3 Jahre sind, nach einer erfolgreichen Grundimmunisierung Wiederholungsimpfungen im Abstand von 2 bis 3 Jahren als ausreichend angesehen.[10] Umgekehrt sind junge Katzen besonderen empfänglich für die Infektion und haben ein höheres Risiko für die Entwicklung einer progressiven Infektion, weshalb sie gerade in den ersten Lebensjahren durch eine Impfung gut geschützt werden sollten.[23]
Für Katzen, deren FeLV-Impfstatus unbekannt ist, wird eine Testung auf FeLV-Antigen im Blut vor der ersten Impfung empfohlen. Für Katzen, die bereits vor der Impfung infiziert waren, ist eine Impfung nicht sinnvoll, da die Impfung eine progressive Infektion nicht zurückdrängen kann und deshalb nicht vor der Entwicklung FeLV-assoziierter Symptome schützt.[13]
Vermeidung der Infektion
Neben der Impfung stellt die Vermeidung der Ansteckung eine wichtige Prophylaxemaßnahme dar. Progressiv infizierte Katzen sollten von uninfizierten Tieren strikt getrennt werden. Sie sollten als reine Wohnungskatzen gehalten werden, um einer Verbreitung des Virus in der näheren Umgebung zu verhindern. Die separate Haltung ohne Freigang schützt FeLV-infizierte Katzen, die häufig unter einer Schwächung des Immunsystems leiden, zudem vor dem Kontakt mit Infektionserregern.
Wird in einem Mehrkatzenhaushalt eine Katze positiv auf FeLV getestet, so sollten alle anderen Katzen ebenfalls getestet werden. Alle positiv getesteten Tiere sind von den negativ getesteten Katzen streng zu trennen, um eine weitere Ausbreitung der Infektion zu verhindern. Die Impfung der negativ getesteten Tiere bietet zwar einen gewissen Schutz, kann aber bei einem sehr hohen Infektionsdruck durch mehrere Virus-ausscheidende Tiere in der direkten Umgebung nicht sicher garantieren, dass die geimpften Tiere keine progressive Infektion entwickeln.[13]
Sowohl männliche als auch weibliche progressiv infizierte Katzen sollten kastriert werden, um die Gefahr der Virusübertragung auf andere Tier durch Revierkämpfe und das Paarungsverhalten zu minimieren. Der chirurgische Eingriff der Kastration wird auch von progressiv infizierten Tieren meist sehr gut vertragen. Bei Einhaltung der Standardhygienevorschriften besteht keine Gefahr, die Infektion in der Tierarztpraxis auf andere Tiere zu übertragen.[13]
Bei der Aufnahme neuer Katzen mit unbekanntem FeLV-Status in eine bestehende FeLV-negative Tiergruppe, z. B. in Tierheimen, Tierzuchten oder auch Privathaushalten, wird empfohlen, die neuen Tiere zunächst für mindestens 3 Wochen in Quarantäne zu halten und dann einen Test auf FeLV-Antigen durchzuführen, bevor es zu einem direkten Kontakt zwischen den Tieren kommt. Tiere, die im Antigentest negativ reagieren, sollten weiter in Quarantäne gehalten werden, bevor der Test 6 Wochen später wiederholt werden muss, da es 4 bis 6 Wochen dauert, bis nach einer stattgefundenen Infektion Antigen im Blut nachweisbar ist. Positiv-reagierende Katzen sollten nur in Gruppen zusammen mit anderen positiv-getesteten Tieren gehalten werden.[10] Viele Tierheime vermitteln FeLV-positiv getestete Katzen in eine Einzelhaltung ohne Freigang und Kontakt zu FeLV-negativen Katzen. Allerdings müssen die Besitzer gründlich über die Infektion und die Risiken für andere Katzen aufgeklärt werden, damit der Kontakt zu anderen Katzen sicher vermieden wird. Es wird empfohlen, FeLV-positive erkrankte Katzen in Tierheimen zu euthanasieren.[13]
Da zur Übertragung ein direkter Kontakt mit dem Austausch von Körperflüssigkeiten, vor allem Speichel notwendig ist, können infizierte Katzen z. B. in einem Tierheim oder bei einem stationären Aufenthalt in einer Tierklinik, im selben Raum gehalten werden wie nicht infizierte Katzen, solange ein direkter Körperkontakt zwischen den Tieren z. B. durch die Unterbringung in Käfigen verhindert wird und hygienische Maßnahmen bei der Pflege der Tiere berücksichtigt werden. Allerdings ist dabei darauf zu achten, dass die FeLV-infizierten Tiere durch die anderen Tiere nicht einem erhöhten Ansteckungsrisiko für Sekundärinfektionen ausgesetzt werden.[13]
Die FeLV-Infektion kann auch durch eine Bluttransfusion übertragen werden, weshalb die Leitlinien für die Bluttransfusion bei Katzen einen Test des Spendertieres auf eine FeLV-Infektion vorsehen. Da bei einer Bluttransfusion Provirus-positive Blutzellen übertragen werden können, wird eine PCR-Untersuchung auf Provirus-DNA empfohlen, da regressiv infizierte Tiere durch einen Antigen-Test nicht identifiziert werden können. Die Testung sollte frühestens drei Monate nach dem letzten Kontakt zu einer potentiellen Infektionsquelle vorgenommen werden, um falsch-negative Ergebnisse während der längeren Inkubationszeit zu vermeiden. In akut lebensbedrohlichen Notfällen, in denen kurzfristig kein anderer Spender zu Verfügung steht, ist das Risiko einer FeLV-Übertragung abzuwägen. In diesen Fällen sollte zumindest ein Schnelltest auf p27-Antigen durchgeführt werden. Der Besitzer des Empfängertieres ist auf das Übertragungsrisiko aufzuklären.[29]
Das Feline Leukämie-Virus ist relativ empfindlich und verliert in der Umwelt rasch seine Infektiosität. Es wird durch alle gängigen Desinfektionsmittel sowie auch durch Seifenlösung sicher inaktiviert. Aus diesem Grund reicht die Einhaltung allgemeiner Hygienestandards in Tierarztpraxen, Tierheimen und auch privaten Haushalten in der Regel aus, um eine indirekte Übertragung des Virus durch kontaminierte Gegenstände, wie Untersuchungs- und Behandlungsinstrumente, das OP-Besteck, Fressnäpfe oder auch die Hände zu vermeiden.
Weblinks
Einzelnachweise
- K. Hartmann: 2.2. FeLV-assoziierte Tumoren. In: Martin Kessler (Hrsg.): Kleintieronkologie: Diagnose und Therapie von Tumorerkrankungen bei Hund und Katze. 3., vollständig überarbeitete und erweiterte Auflage. Enke-Verlag, Stuttgart 2012, ISBN 978-3-8263-3236-4, S. 17–19.
- E. Dahme, E. Weiss: 2.5. Leukose. In: Grundriss der speziellen pathologischen Anatomie der Haustiere. 6., völlig neu bearbeitete Auflage. Thieme Verlagsgruppe, Stuttgart 2006, ISBN 3-8304-1048-4, doi:10.1055/b-002-8317, S. 44.
- A. W. Philbey: Viruses and cancer, cats and cattle: a tribute to Bill Jarrett. In: The Veterinary Journal. Band 195, Nr. 1, 2013, S. 2–3. PMID 23164956, doi:10.1016/j.tvjl.2012.10.015
- Julia Beatty: Viral causes of feline lymphoma: Retroviruses and beyond. In: The Veterinary Journal. Vol. 201, Nr. 2, 2014 (Special: Feline Infectious Diseases.). S. 174–180. PMID 24928422, doi:10.1016/j.tvjl.2014.05.026
- W. F. H. Jarrett, W. B. Martin, G. W. Crighton, R. G. Dalton, M. F. Stewart: Leukæmia in the Cat: Transmission Experiments with Leukæmia (Lymphosarcoma). In: Nature. Vol. 202, 1964, S. 566–567. PMID 14195053, doi:10.1038/202566a0
- W. F. H. Jarrett, E. M. Crawford, W. B. Martin, F. A. Davie: A Virus-Like Particle Associated with Leukemia (Lymphosarcoma). In: Nature. Vol. 202, 1964, S. 567–569. PMID 14195054, doi:10.1038/202567a0
- C. Voisset, R. A. Weiss, D. J. Griffiths: Human RNA "rumor" viruses: the search for novel human retroviruses in chronic disease. In: Microbiol Mol Biol Rev. Band 72, Nr. 1, März 2008, S. 157–196, doi:10.1128/MMBR.00033-07 (englisch).
- Robert Gallo: Die Jagd nach dem Virus. S. Fischer-Verlag, 1991, ISBN 3-10-024404-4, Kap. 8. Eine einzige Krankheit mit einer einzigen Ursache, S. 190.
- Brian J. Willett, Margaret J. Hosie: Feline leukaemia virus: Half a century since its discovery. In: The Veterinary Journal. Band 195, 2013, S. 16–23. PMID 22867855, doi:10.1016/j.tvjl.2012.07.004
- K. Möstl, D. D. Addie, C. Boucraut-Baralon, H. Egberink, T. Frymus, T. Gruffydd-Jones, K. Hartmann, M. J. Hosie, A. Lloret, H. Lutz, F. Marsilio, M. Grazia Pennisi, A. D. Radford, E. Thiry, U. Truyen, M. C. Horzinek: Something old, something new - Update of the 2009 and 2013 ABCD guidelines on prevention and management of feline infectious diseases. In: Journal of Feline Medicine and Surgery. Band 17, Nr. 7, 2015, S. 570–582. PMID 26101308 doi:10.1177/1098612X15588448
- S. J. O’Brien, J. L. Troyer, M. A. Brown, W. E. Johnson, A. Antunes, M. E. Roelke, J. Pecon-Slattery: Emerging Viruses in the Felidae: Shifting Paradigms. In: Viruses. Nr. 4, 2012, S. 236–257. PMID 22470834, doi:10.3390/v4020236
- M. L. Meli, V. Cattori, F. Martinez, G. Lopez, A. Vargas, M. A. Simon, I. Zorrilla, A. Munoz, F. Palomares, J. V. Lopez-Bao u. a.: Feline leukemia virus and other pathogens as important threats to the survival of the critically endangered Iberian lynx (Lynx pardinus). In: PLoS One. Nr. 4, 2009, Artikel e4744. PMID 19270739, doi:10.1371/journal.pone.0004744
- H. Lutz, D. Addie, S. Belák, C. Boucraut-Baralon, H. Egberink, T. Frymus, T. Gruffydd-Jones, K. Hartmann, M. J. Hosie, A. Lloret, F. Marsilio, M. Grazia Pennisi, A. D. Radford, E. Thiry, U. Truyen, M. C. Horzinek: Feline Leukaemia: ABCD Guidelines on Prevention and Management. In: Journal of Feline Medicine and Surgery. Vol. 11, Nr. 07, 2009, S. 565–574. PMID 19481036, doi:10.1016/j.jfms.2009.05.005
- K. Hartmann: Clinical Aspects of Feline Retroviruses: A Review. In: Viruses. Band 4, Nr. 4, 2012, S. 2684–2710. PMID 23202500, doi:10.3390/v4112684
- J. Levy, C. Crawford, K. Hartmann, R. Hofmann-Lehmann R. S. Little, E. Sundahl, V. Thayer: 2008 American Association of Feline Practitioners' feline retrovirus management guidelines. In: Journal of Feline Medicine and Surgery. Vol. 10, Nr. 3, 2008, S. 300–316. PMID 18455463, doi:10.1016/j.jfms.2008.03.002
- Thomas Vahlenkamp: 2.1. Virusassoziierte Onkogenese - Kapitel 2.1.2. Retroviren. In: Martin Kessler (Hrsg.): Kleintieronkologie: Diagnose und Therapie von Tumorerkrankungen bei Hund und Katze. 3., vollständig überarbeitete und erweiterte Auflage. Georg Thieme Verlag, 2012, ISBN 978-3-8263-3236-4, S. 15–16.
- M. C. Horzinek, D. Addie, S. Belák, C. Boucraut-Baralon, H. Egberink, T. Frymus, T. Gruffydd-Jones, K. Hartmann, M. J. Hosie, A. Lloret, H. Lutz, F. Marsilio, K. Möstl, M. Grazia Pennisi, A. D. Radford, E. Thiry, U. Truyen: ABCD - Update of the 2009 guidelines on prevention and management of feline infectious diseases. In: Journal of Feline Medicine and Surgery. Band 15, Heft 7, 2013, S. 530–539. PMID 23813810, doi:10.1177/1098612X13489208
- K. Hartmann: Clinical aspects of feline immunodeficiency and feline leukemia virus infection. In: Veterinary Immunology and Immunopathology. Band 143, Nr. 3-4, 2011, S. 190–201. PMID 21807418, doi:10.1016/j.vetimm.2011.06.003
- Tabelle in Anlehnung an: Levy, C. Crawford, K. Hartmann, R. Hofmann-Lehmann, R. S. Little, E. Sundahl, V. Thayer: 2008 American Association of Feline Practitioners' feline retrovirus management guidelines. In: Journal of Feline Medicine and Surgery. Vol. 10, Nr. 3, 2008, S. 300–316. PMID 18455463, doi:10.1016/j.jfms.2008.03.002
- S. N. Ettinger: Principles of treatment for feline lymphoma. In: Clinical Techniques in Small Animal Practice. Band 18, Nr. 2, 2003, S. 98–102. PMID 12831069, doi:10.1053/svms.2003.36623
- D. A. Grosenbaugh, V. Frances-Duvert, S. Abedi, B. Feilmeier, H. Ru, H. Poulet: Efficacy of a nonadjuvanted recombinant FeLV vaccine and two inactivated FeLV vaccines when subject to consistent virulent FeLV challenge conditions. In: Biologicals. Band 49, 2017, S. 76–80. PMID 28734742, doi:10.1016/j.biologicals.2016.10.004
- Ständige Impfkommission Vet. am Friedrich-Loeffler-Institut: Impfempfehlung Katze. In der Leitlinie zur Impfung von Kleintieren. 4. Auflage, Stand 1. Februar 2019. S. 14, veröffentlicht auf der Homepage des Bundesverbandes praktizierender Tierärzte (bpt), abgerufen am 11. März 2020.
- Ständige Impfkommission der Schweizerischen Vereinigung für Kleintiermedizin: Impfempfehlungen der SVK-ASMPA 2017. Ausgabe Januar 2017, veröffentlicht auf der Homepage der Schweizerischen Vereinigung für Kleintiermedizin SVK+ASMPA, abgerufen am 27. März 2018.
- Abteilung für Interne Medizin der Klinik für Kleintiere, Department für Kleintiere und Pferde an der Veterinärmedizinischen Universität Wien und Österreichische Tierärztekammer: Impfleitlinien für Kleintiere 2017, Stand Mai 2017., veröffentlicht auf der Homepage der Österreichischen Tierärztekammer, abgerufen am 27. März 2018.
- M. J. Hosie, D. D. Addie, C. Boucraut-Baralon, H. Egberink, T. Frymus, T. Gruffydd-Jones, K. Hartmann, M. C. Horzinek, A. Lloret, H. Lutz, F. Marsilio, M. Grazia Pennisi, A. D. Radford, E. Thiry, U. Truyen, K. Möstl: Matrix vaccination guidelines - 2015 ABCD recommendations for indoor/outdoor cats, rescue shelter cats and breeding catteries. In: Journal of Feline Medicine and Surgery. Vol. 17, 2015, S. 583–587. PMID 26101309, doi:10.1177/1098612X15590732
- M. J. Day, M. C. Horzinek, R. D. Schultz, R. A. Squires: Guidelines for the Vaccination of dogs and cats compiled by the Vaccination Guidelines Group (VGG) of the World Small Animal Association (WSAVA).In: Journal of Small Animal Practice. Vol 57, Nr. 1, 2016, S. E1–E45. PMID 26780853, doi:10.1111/jsap.12431
- A. Scherk, R. B. Ford, R. M. Gaskell, K. Hartmann, K. F. Hurley, M. R. Lappin, J. K. Levy, S. E. Little, S. K. Nordone, A. H. Sparkes: 2013 AAFP Feline Vaccination Advisory Panel Report. In: Journal of Feline Medicine and Surgery. Band 15, Nr. 9, 2013, S. 785–808. PMID 23966005 doi:10.1177/1098612X13500429
- M. Grazia Pennisi, K. Hartmann, D. D. Addie, H. Lutz, T. Gruffydd-Jones, C. Boucraut-Baralon, H. Egberink, T. Frymus, M. C. Horzinek, M. J. Hosie, A. Lloret, F. Marsilio, A. D. Radford, E. Thiry, U. Truyen, K. Möstl: Blood transfusion in cats - ABCD guidelines for minimising risks of infectious iatrogenic complications. In: Journal of Feline Medicine and Surgery. Band 17, 2015, S. 588–593. PMID 26101310, doi:10.1177/1098612X15588449