Bromethan
Bromethan (auch Bromäthan, Monobromethan, Monobromäthan, Ethylbromid, Äthylbromid, Bromethyl oder Bromäthyl) ist ein Bromderivat des Ethans und somit ein Halogenalkan. Es sollte nicht mit Brommethan verwechselt werden.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
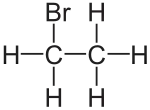 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Bromethan | |||||||||||||||
| Andere Namen |
Ethylbromid | |||||||||||||||
| Summenformel | C2H5Br | |||||||||||||||
| Kurzbeschreibung |
farblose, stark lichtbrechende Flüssigkeit mit etherischem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 108,97 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,46 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
38 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schwer in Wasser (9 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Brechungsindex |
1,4239 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
Schweiz: 5 ml·m−3 bzw. 22 mg·m−3[5] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−90,5 kJ/mol[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung
Im Labor kann Bromethan durch Umsetzung von Ethanol mit Phosphortribromid PBr3 dargestellt werden. Als Nebenprodukt entsteht Phosphonsäure PH(OH)2O.
Eigenschaften
Bromethan ist bei Raumtemperatur eine farblose bis gelbliche Flüssigkeit, deren Dämpfe schwerer als Luft sind. Mit Luft bilden Bromethan-Dämpfe entzündbare explosionsfähige Gemische.
Bei Erhitzung zersetzt es sich unter Bildung von Ethen und Bromwasserstoff.
Durch das elektronegative Brom ist das benachbarte Kohlenstoffatom positiv polarisiert. Somit fungiert Bromethan in vielen chemischen Reaktionen als elektrophiles Reagenz.
Verwendung
Bromethan findet vielseitige Verwendung bei der organisch-chemischen Synthese, speziell zur Einführung von Ethylgruppen in organische Verbindungen. In Grignard-Reaktionen wird die Ethylgruppe des Bromethans zu einem Kohlenstoff-Nukleophil „umgepolt“, was eine Reihe weiterer Syntheseanwendungen eröffnet.
In der zweiten Hälfte des 19. Jahrhunderts wurde es als Inhalationsnarkotikum[7] für Narkosezwecke verwendet, aber aufgrund seiner Giftigkeit für Herz und Nervensystem als Mittel für die Inhalationsanästhesie wieder verlassen.
Sicherheitshinweise
Hautkontakt, Einatmen und Verschlucken von Bromethan ist gesundheitsschädlich. Augen, Atmungsorgane und Haut werden durch Bromethan stark gereizt. Bei Resorption durch die Haut sind Leber-, Lungen- und Nierenschäden möglich. In Tierversuchen wurde die krebserregende Wirkung von Bromethan eindeutig nachgewiesen.[1] Bromethan besitzt außerdem narkotisierende Wirkung.[1]
Sonstiges
Das Bromethan wurde 1827 von Georges Serullas entdeckt und ab 1847 für einige Zeit als Inhalationsanästhetikum benutzt.[8] Die in Publikationen häufig anzutreffende Kurzformel EtBr für Bromethan geht auf die international anerkannte Abkürzung Et für die Ethylgruppe zurück. In den biowissenschaftlichen Fachgebieten kann dies zu Verwechselungen führen, denn dort wird EtBr als Kurzform für den Phenanthridin-Farbstoff Ethidiumbromid verwendet, der als Nachweisreagenz für Nukleinsäuren dient.
Einzelnachweise
- Eintrag zu Bromethan. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- Eintrag zu Bromethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-62.
- Eintrag zu Bromoethane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 74-96-4 bzw. Bromethan), abgerufen am 2. November 2015.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 18.
- H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 14.


