Edotreotid
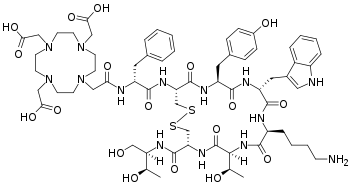
Edotreotid ist der Internationale Freiname für den Arzneistoff (DOTA(0)-Phe(1)-Tyr(3))octreotid.[4] In der Fachwelt ist die Bezeichnung DOTATOC am gebräuchlichsten.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Freiname | Edotreotid | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C65H92N14O18S2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 1421,64 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Edotreotid wird zusammen mit verschiedenen Radionukliden als Radiopharmakon in der Onkologie sowohl zur Diagnostik als auch zur Therapie (Radionuklidtherapie) verwendet.
Die Radiopeptidtherapie (RPT) mit 90Y-DOTATOC wird insbesondere bei fortgeschrittenen neuroendokrinen Tumoren (NET) als palliatives Behandlungsverfahren eingesetzt und klinisch getestet.[5]
Aufbau
DOTATOC besteht aus zwei Komponenten, die durch kovalente Bindungen chemisch miteinander verbunden (konjugiert) sind. Die beiden Komponenten sind:
- Der Komplexbildner 1,4,7,10-Tetraazacyclododecan-1,4,7,10-tetraessigsäure, genannt DOTA und
- das Octreotid-Analogon D-Phe-cyclo[Cys-Tyr-D-Trp-Lys-Thr-Cys]-Thr(ol), genannt TOC
DOTA ist als Chelatbildner in der Lage, eine Vielzahl mehrwertiger Metallionen koordinativ sehr fest zu binden. Über eine der vier Säuregruppen des Moleküls ist das DOTA mit dem Oktapeptid TOC verbunden. TOC selbst ist dem Somatostatin-Analogon Octreotid (D-Phe-c[Cys-Phe-D-Trp-Lys-Thr-Cys]-Thr(ol)) in der Struktur sehr ähnlich. Die Aminosäure Phenylalanin des Octreotids ist im TOC durch Tyrosin ersetzt. Die nichtproteinogene D-Aminosäure D-Phenylalanin verhindert eine vorzeitige Verstoffwechselung (Metabolisierung) des TOC im Körper.
Während das endogene, aus 14 Aminosäuren bestehende Somatostatin eine sehr kurze Plasmahalbwertszeit von 2 bis 4 Minuten hat,[6] weist das aus acht Aminosäuren aufgebaute Octreotid (griech. Vorsilbe octa- = „acht“) mit 1,5 bis 2 Stunden eine deutlich längere Halbwertszeit auf.[6][7][8]
TOC bindet – wie Octreotid auch – an Somatostatin-Rezeptoren, auch SRIF-Rezeptoren genannt (von Somatropin Release Inhibiting Factor). Diese Rezeptoren sind bei einer Reihe von Tumoren, speziell bei neuroendokrinen Tumoren (NET), überexprimiert, das heißt, an der Oberfläche der Krebszellen befinden sich überdurchschnittlich viele dieser Rezeptoren.
Bisher wurden fünf verschiedene Typen von Somatostatin-Rezeptoren (SSTR1 bis SSTR5, von somatostatin seven-transmembrane-domain receptor) gefunden, die je nach Tumorart unterschiedlich stark exprimiert werden. Gastro-entero-pankreatische neuro-endokrine Tumoren (GEP-NET) exprimieren beispielsweise bevorzugt SSTR2 und – weniger stark – SSTR1 und SSTR5.[9]
Diagnostik
Wird DOTATOC mit kurzlebigen Isotopen beladen, die Gamma-Strahlen aussenden, wie beispielsweise 111Indium, oder mit Isotopen, die einem Beta-plus-Zerfall (β+) unterliegen, wie beispielsweise 68Gallium, so ist es möglich, mittels bildgebender Verfahren wie SPECT oder Positronen-Emissions-Tomographie (PET) die entsprechenden neuroendokrinen Tumoren sowie ihre Metastasen nachzuweisen und zu lokalisieren.
Szintigraphie
Für diese Anwendung ist DOTATOC nicht zugelassen. In einigen Kliniken werden jedoch Studien mit 111In-DOTATOC durchgeführt. Das Verfahren hat keine wesentlichen Vorteile gegenüber der zugelassenen Somatostatin-Rezeptor-Szintigraphie mit 111Indium-Pentetreotid (OctreoScan®).
Positronen-Emissions-Tomographie
Wird DOTATOC mit einem radioaktiven Metallion beladen, das einem β+-Zerfall unterliegt, wie beispielsweise 68Gallium aus einem Gallium-68-Generator, so können Somatostatin-exprimierende Tumoren und deren Metastasen mit Hilfe der Positronen-Emissions-Tomographie nachgewiesen werden. An den entsprechend entarteten Zellen reichert sich das 68Ga-DOTATOC an. Diese Areale strahlen gegenüber dem normalen Gewebe deutlich stärker. Die Strahlung wird mittels Detektoren lokalisiert und über Bildverarbeitung zu einer dreidimensionalen Darstellung verarbeitet.
Die PET mit 68Ga-DOTATOC ermöglicht die Darstellung und quantitative Bewertung der Rezeptorexpression im Tumor- und Normalgewebe.[10] Dabei ist die 68Ga-DOTATOC-PET der 111In-DTPA-Octreotid-Szintigraphie (Octreotid-Scan) bei neuroendokrinen Tumoren überlegen.[11][12] 68Ga-DOTATOC ist hydrophiler als 111In-DTPA-Octreotid, weshalb eine schnellere Ausscheidung (renale Clearance) von nichtgebundenem DOTATOC erfolgt.
Neuroendokrine Tumoren und deren Metastasen können mit diesem Verfahren bis herunter auf 7 bis 8 mm Durchmesser diagnostiziert werden, während es im Vergleich dazu bei der 111In-DTPA-Octreotid-Szintigraphie Probleme mit der Erkennung von malignem Gewebe unterhalb von 25 mm Durchmesser gibt.[13]
Die Technik der 68Ga-DOTATOC-PET kann derzeit nur an sehr wenigen Kliniken durchgeführt werden. Bei dieser Form der Bildgebung werden im Wesentlichen nur der Tumor und eventuell vorhandene Metastasen dargestellt. Eine genaue Information über die anatomische Lage dieser Gewebsveränderungen werden durch die PET alleine nicht erhalten. Mit Hilfe der Kombination von PET und Computertomographie (PET/CT) kann dieses Problem jedoch umgangen werden.[14]
Therapie
Neuroendokrine Tumoren wachsen relativ langsam. Sie sprechen daher auf viele konventionelle Chemotherapeutika, die im Wesentlichen nur gegen schnell wachsende Zellen wirken, nicht an. Zudem entwickeln sich bei vielen Patienten Symptome erst in einem sehr späten Stadium, wenn bereits Metastasen vorhanden sind.[15] Diese Form von Tumoren ist generell sehr schwer therapierbar.
Die spezifische Bindung des DOTATOC an die Somatostatin-Rezeptoren der neuroendokrinen Tumoren kann auch für therapeutische Zwecke genutzt werden. Wird DOTATOC mit einem Beta-Strahler beladen, so können die Tumorzellen durch DNA-Schäden, die durch die abgegebene Betastrahlung induziert werden, abgetötet werden. Diese Radiopeptidtherapie ist eine spezielle Form der Endoradiotherapie. Da die Reichweite der Betastrahlung nur wenige Millimeter beträgt, wird das umliegende gesunde Gewebe weitgehend geschont.
Verwendete Radionuklide
Als mögliche Radionuklide haben sich dabei im Wesentlichen 90Yttrium und 177Lutetium etabliert. 90Yttrium zerfällt mit einer Halbwertszeit von 64,1 Stunden unter Abgabe eines Elektrons mit einer Energie von 2,28 MeV. Die Reichweite im menschlichen Gewebe beträgt dabei etwa 11 Millimeter.[16]
Der Zerfall von 177Lu ist dagegen mit 0,5 MeV deutlich energieärmer. Entsprechend verkürzt sich die Reichweite der Elektronen auf etwa 1,5 Millimeter.[17] Die Halbwertszeit beträgt 6,73 Tage. Neben der Abgabe eines Elektrons wird beim Zerfall von 177Lu auch Gammastrahlung frei.
Anwendung
Neben der Therapie von neuroendokrinen Tumoren exprimieren auch eine Reihe anderer Tumortypen Somatostatin-Rezeptoren. Eine mögliche Anwendung ist beispielsweise die Therapie von Prostatakrebs.[18] Weitere Indikationen sind zurzeit in verschiedenen klinischen Phasen, so beispielsweise zur Behandlung von Lungenkrebs und metastasiertem Brustkrebs.[19] Auch die Anwendung zur Behandlung von Gliomen wird getestet.[20]
Limitierungen
Eine Therapie mit 90Y-DOTATOC ist nur in den Fällen sinnvoll, in denen der Tumor über die notwendigen und an das TOC bindenden Somatostatin-Rezeptoren an den Zelloberflächen verfügt.
Eine weitere Limitierung der Radiopeptidtherapie mit 90Y, beziehungsweise 177Lu, ist die strahlungsbedingte Nephrotoxizität (Nierentoxizität).[21][22] Durch Infusionen mit den beiden Aminosäuren Arginin und Lysin kann die Aufnahme von DOTATOC in den Nieren reduziert werden.[23][24][25] Allerdings bewirken diese Infusionen andere Nebenwirkungen.[22]
Therapieerfolg
Eine Heilung ist bei dieser Therapieform zwar nicht möglich, aber bei den meisten betroffenen Patienten kommt es zu einem Wachstumsstillstand der Tumoren und Metastasen. Die Lebensqualität der Patienten kann dadurch deutlich verbessert werden.[26]
Es gibt derzeit keine offizielle Zulassung dieser Therapieform.[27] Die Anwendung erfolgt im Wesentlichen palliativ.[5]
In Fällen, in denen die DOTATOC-Therapie die einzig erfolgversprechende Therapie ist, ist die Krankenkasse zur Erstattung der Kosten verpflichtet.[28]
Entwicklungsgeschichte
Unter der Bezeichnung SMT487 wurde 90Y-DOTATOC Ende der 1990er Jahre vom Schweizer Unternehmen Novartis entwickelt. Der Markenname war zunächst OctreoTher®, später dann Onalta®. Im September 2005 hatte Novartis die Aktivitäten des in der klinischen Phase II befindlichen Präparates deutlich reduziert, beziehungsweise eingestellt. Im Januar 2007 übernahm das US-amerikanische Unternehmen Molecular Insight Pharmaceuticals die weltweiten Rechte an SMT487.[29]
Verwandte Arzneistoffe
Mehrere mit dem DOTATOC verwandte Verbindungen befinden sich in der klinischen Erprobung.
DOTALAN
DOTALAN oder auch DOTA-Lanreotid genannt, hat wie das Octreotid ein ähnliches Bindungsvermögen an den SST2-Rezeptor. Dieses Somatostatin-Analogon hat allerdings eine deutlich höhere Affinität zu SSTR5. Mit 90Y wird es als 90Y-DOTA-Lanreotid eingesetzt.[17]
DOTATATE
DOTATATE oder auch DOTA-[Tyr³]Octreotat genannt, hat eine etwa neunmal höhere Affinität zu SSTR2 als DOTATOC. Zusammen mit 177Lu wird es als 177Lu-DOTA-Tyr³-Octreotat eingesetzt.[30] DOTATATE ist als Lu 177 Komplex Lutathera® in Europa und den USA zugelassen.
Literatur
- A. Otte u. a.: Yttrium-90 DOTATOC: first clinical results. In: Eur J Nucl Med. 26/1999, S. 1439–1447. PMID 10552085
- D. Storch: Neue, radioaktiv markierte und magnet-resonanz-aktive Somatostatinanaloga zur besseren Diagnose und zielgerichteten Radionuklidtherapie von neuroendokrinen Tumoren. S. l. 2005, doi:10.5451/unibas-003592299 (Dissertation, Universität Basel).
- A. Frilling u. a.: Treatment with (90)Y- and (177)Lu-DOTATOC in patients with metastatic neuroendocrine tumors. In: Surgery. 140/2006, S. 968–976. PMID 10552085.
- S. W. J. Lamberts u. a.: Octreotide. In: NEJM. 334/1996, S. 246–254.
- A. Otte u. a.: DOTATOC: a powerful new tool for receptor-mediated radionuclide therapy. In: European journal of nuclear medicine. 24/1997, S. 792–795. PMID 9211767.
- J. Rendl u. a.: Somatostatin-Rezeptor-Szintigraphie (SRS) bei malignen kindlichen ZNS-Tumoren: erste Ergebnisse und Vergleich mit CT und MR. In: Nucl Med. 34/1995, S. 50–78.
- R. Albert u. a.: Direct synthesis of [DOTA-DPhe1]-octreotide and [DOTA-DPhe1,Tyr3]-octreotide (SMT487): two conjugates for systemic delivery of radiotherapeutical nuclides to somatostatin receptor positive tumors in man. In: Bioorg Med Chem Lett. 8/1998, S. 1207–1210. PMID 9871736.
- R. E. Weiner, M. L. Thakur: Radiolabeled peptides in the diagnosis and therapy of oncological diseases. In: Applied Radiation and Isotopes. 57/2002, S. 749–763.
- C. Waldherr u. a.: Tumor response and clinical benefit in neuroendocrine tumors after 7.4 GBq (90)Y-DOTATOC. In: J Nucl Med. 43/2002, S. 610–616.
- D. V. Beuter: Vergleich der Gastrinrezeptorszintigraphie mit der Positronenemissionstomographie, Computertomographie, Somatostatinrezeptorszintigraphie, Knochenmarks- und Knochenszintigraphie bei Patienten mit metastasierten medullären Schilddrüsenkarzinomen. Dissertation, Philipps-Universität Marburg, 2007.
- C. Wängler u. a.: Radiolabeled peptides and proteins in cancer therapy. In: Protein Pept Lett. 14/2007, S. 273–279. PMID 17346233.
- D. Bushnell u. a.: Assessment of hepatic toxicity from treatment with 90Y-SMT 487 (OctreoTher(TM)) in patients with diffuse somatostatin receptor positive liver metastases. In: Cancer Biotherapy & Radiopharmaceuticals. 18/2003, S. 581–588.
Weblinks
- PET - modernes Diagnose-Verfahren im Kampf gegen Krebs Deutschen Gesellschaft für Nuklearmedizin e.V. und des Berufsverbandes Deutscher Nuklearmediziner e.V.
- Peptides and Amines (engl.)
Einzelnachweise
- EDOTREOTIDE - Drug information (Memento vom 5. September 2010 im Internet Archive), abgerufen am 10. Juni 2008.
- Bachem AG: EG-SDB - StreamExtPDF, abgerufen am 7. Januar 2022
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- F. Forrer u. a.: Treatment with 177Lu-DOTATOC of patients with relapse of neuroendocrine tumors after treatment with 90Y-DOTATOC. In: Journal of nuclear medicine. 46/2005, S. 1310–1316. PMID 16085587.
- M. Neininger u. a.:Untersuchungen zur Nephrotoxizität einer Radiopeptidtherapie mit 90-Y-DOTATOC. (Memento vom 4. Oktober 2015 im Internet Archive) (PDF; 1,9 MB). In: Nuklearmedizin. 2/2008, A15.
- R. E. Weiner u. a. In: Appl Radiat Isot. 57/2002, S. 749–763.
- A. Janecka u. a. In: J Pept Res. 58/2001, S. 91–107.
- A. Schmid: Modulare Synthese und Makrozyklisierung Ruthenium-markierter Diarylether-Peptoide. (PDF; 5,6 MB) Dissertation, LMU München, 2005.
- V. Prasad u. a.: Changing role of somatostatin receptor targeted drugs in NET: Nuclear Medicine’s view. (PDF; 2,4 MB). In: J Pharm Pharmaceut Sci. 2007, S. 321–337.
- M. Ö. Öksüz u. a.: Therapiekontrolle einer Radiopeptidtherapie (Y-90 bzw. Lu-177 DOTATOC) mit Ga-68 DOTATOC-PET/CT. In: Nuklearmedizin. 2/2008, A15.
- V. Budach u. a.: PET/CT als therapiesteuerndes Instrument in der onkologischen Diagnostik und als Therapieverlaufsmarker. In: 4. Berliner PET/(CT) Symposium. S. 22–26.
- J. Kowalski u. a.: Evaluation of positron emission tomography imaging using [68Ga]-DOTA-D Phe(1)-Tyr(3)-Octreotide in comparison to [111In]-DTPAOC SPECT. First results in patients with neuroendocrine tumors. In: Mol Imaging Biol. 5/2003, S. 42–48.
- M. Henze u. a.: Exceptional increase of Somatostatin receptor expression in pancreatic neuroendocrine tumour visualized with 68Ga-DOTATOC-PET. In: Eur J Nucl Med. 31/2004, S. 466.
- S. Petersenn: Neuroendokrine Tumoren. (PDF; 720 kB). In: Essener Unikate. 25/2005, S. 62–75.
- Neuroendokrine Tumoren werden oft erst sehr spät entdeckt. In: Ärzte-Zeitung. 3. Juli 2006.
- D. J. Kwekkeboom u. a.: Comparison of 111In-DOTA-Tyr3-octreotide and 111In-DTPA-octreotide in the same patients: biodistribution, kinetics, organ and tumor uptake. In: J. Nucl. Med. 40/1999, S. 762–767.
- M. De Jong u. a.: Radiolabelled peptides for tumour therapy: current status and future directions. In: Eur. J. Nucl. Med. 30/2003, S. 463–469.
- J. Kotzerke: Aktuelle Entwicklungen auf dem Gebiet protstataspezifischer Tracer. S. 9–11.
- ClinicalTrials.gov: Edotreotide, abgerufen am 10. Juni 2008.
- T. Schumacher u. a.: Local injection of the 90Y-labelled peptidic vector DOTATOC to control gliomas of WHO grades II and III. An extended pilot study. In: Eur J Nucl Med Mol Imaging. 29/2002, S. 486–493.
- O. C. Boermann u. a.: Between the Scylla and Charybdis of peptide radionuclide therapy: hitting the tumor and saving the kidney. In: Eur. J. Nucl. Med. 28/2001, S. 1447–1449.
- T. M. Behr u. a.: Nephrotoxicity versus anti-tumor efficacy in radiopeptide therapy: facts and myths about the Scylla and Charybdis. In: Eur. J. Nucl. Med. 29/2002, S. 277–279.
- M. Béhé u. a.: Kidney protections agents during radiopeptide therapy in mice. In: Eur. J. Nucl. Med. Mol. Imag. 29/2002, S. 301.
- D. Bushnell u. a.: Effects of intravenous amino acid administration with Y-90 DOTA-Phe1-Tyr3-Octreotide (SMT487, OctreoTher) treatment. In: Cancer Biother Radiopharm 19/2004, S. 35–41. PMID 15068609.
- E. J. Rolleman u. a.: Save and effective inhibition of renal uptake of radiolabelled octreotide by a combination of lysine and arginine. In: Eur. J. Nucl. Med. Mol. Imag. 30/2002, S. 9–15.
- Universitätsspital Basel: (Seite nicht mehr abrufbar, Suche in Webarchiven: Neue Therapieoptionen gegen Lymphdrüsenkrebs) ; Pressemitteilung vom 28. April 2005.
- M. Pavel: Neuroendokrine Tumoren: Präsentation, rationelle Diagnostik und Therapieleitlinien.
- LSG Nordrhein-Westfalen, Urteil vom 17. Januar 2007 - L 11 KR 6/06 (PDF; 899 kB) RID 07-01-143, S. 52.
- Molecular Insight Pharmaceuticals, Inc. Acquires Clinical Stage, Targeted Radiotherapeutic Candidate Onalta™ (Formerly OctreoTher™). In: evaluategroup.com. Evaluate Ltd., 24. Januar 2007, abgerufen am 14. Februar 2017 (englisch).
- D. J. Kwekkeboom u. a.: Treatment of patients with gastroenteropancreatic (GEP) tumours with the novel radiolabelled somatostatin analogue [177Lu-DOTA , Tyr3]octreotate. In: Eur. J. Nucl. Med. Mol. Imag. 30/2003, S. 417–422.