4-Phenyl-3-buten-2-on
4-Phenyl-3-buten-2-on (Benzylidenaceton) ist eine chemische Verbindung aus der Gruppe der Ketone.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
-4-phenylbut-3-en-2-one.svg.png.webp) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Phenyl-3-buten-2-on | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H10O | ||||||||||||||||||
| Kurzbeschreibung |
hellgelber Feststoff mit charakteristischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 146,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,008 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
261 °C[1] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen
4-Phenyl-3-buten-2-on kommt natürlich in Sojabohnen und Virginia tobacco vor.[3]
Gewinnung und Darstellung
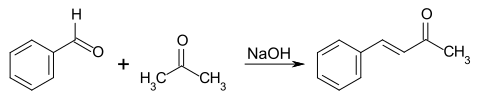
4-Phenyl-3-buten-2-on kann durch Umsetzung von Aceton mit Benzaldehyd in Gegenwart von Natriumhydroxid (Claisen-Schmidt-Kondensation) gewonnen werden.[4]
Eigenschaften
4-Phenyl-3-buten-2-on ist ein brennbarer, schwer entzündbarer, hellgelber Feststoff mit charakteristischem Geruch (Geruch nach Cumarin[5]), der schwer löslich in Wasser ist.[1] trans-4-Phenyl-3-buten-2-on ist ein Substrat für Glutathion-S-Transferasen. Es reagiert mit Methyl- und Benzylguanidinen zu aromatischen N2-substituierten 2-Pyrimidinaminen.[2]
Verwendung
4-Phenyl-3-buten-2-on wird aufgrund der Enon-Substruktur in der organischen Synthese als Baustein für Kondensations-, Cycloadditionsreaktionen, Michael-Additionen, Grignard-Reaktionen verwendet. Es liefert mit Dieisennonacarbonyl [Fe2(CO)9] Benzyliden-Eisentricarbonyl, ein Reagenz, welches die Fe(CO)3-Gruppe auf andere Moleküle übertragen kann.[5] Benzalaceton wird als Edukt für die Synthese von Warfarin verwendet.[6]
Sicherheitshinweise
4-Phenyl-3-buten-2-on darf beim Herstellen oder Behandeln von kosmetischen Mitteln nicht verwendet werden (deutsche Kosmetik-Verordnung Anlage 1, Nr. 356).[5]
Einzelnachweise
- Eintrag zu 4-Phenyl-3-buten-2-on in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Datenblatt 4-Phenyl-3-buten-2-one, 99% bei Sigma-Aldrich, abgerufen am 18. Januar 2016 (PDF).
- George A. Burdock: Fenaroli’s Handbook of Flavor Ingredients, Sixth Edition. CRC Press, 2009, ISBN 978-1-4200-9086-4 (eingeschränkte Vorschau in der Google-Buchsuche).
- Drake, N. L.; Allen, Jr. P.: Benzalacetone In: Organic Syntheses. 3, 1923, S. 17, doi:10.15227/orgsyn.003.0017 (PDF).
- Eintrag zu Benzylidenaceton. In: Römpp Online. Georg Thieme Verlag, abgerufen am 18. Januar 2016.
- Enders, E.: Rodentizide. In: Wegler, R. (Hrsg.): Chemie der Pflanzenschutz- und Schädlingsbekämpfungsmittel. 1. Auflage. Band 1. Springer, Berlin / Heidelberg / New York 1970, S. 618.