Acetogenese
Acetogenese[a 1] ist eine spezielle Form des Energiestoffwechsels und zwar der anaeroben Atmung, die auf dem reduktiven Acetyl-CoA-Weg (Wood-Ljungdahl-Weg) basiert[1]. Kohlenstoffdioxid (CO2) fungiert dabei als Elektronenakzeptor und übernimmt somit die Funktion als Oxidationsmittel, die O2 bei der aeroben Atmung hat. Als Endprodukt dieser „CO2-Atmung“[a 2][2] wird (meist[3]) ausschließlich Essigsäure ausgeschieden. In Abgrenzung zu anderen mikrobiellen anaeroben Prozessen, bei denen Essigsäure nicht als Hauptprodukt gebildet wird[a 3], bezeichnet man diesen Prozess auch als Homoacetogenese.[4]
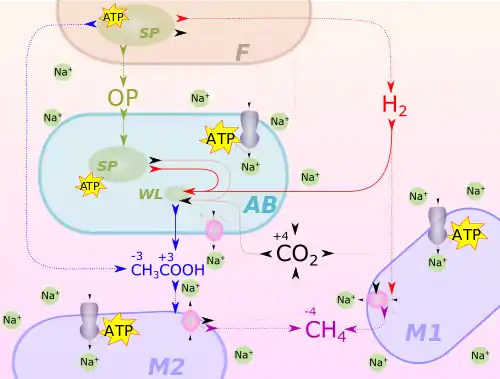
Ein gärender Anaerobier (F), der ATP ausschließlich durch Substratkettenphosphorylierung (SP) gewinnt, scheidet organische Gärprodukte (OP), aus, die von einem acetogenen Bakterium (AB) heterotroph zu H2 und CO2 vergoren werden. Diese Produkte werden durch den Wood-Ljungdahl-Weg (WL) zu Essigsäure kondensiert. Acetogene Bakterien können aber auch H2 und CO2 von außen aufnehmen und verarbeiten
Sie konkurrieren dabei mit obligat autotrophen Archaeen (M1), die Methanogenese betreiben. Acetoclastische, Essigsäure „spaltende“ Methanogene stehen dagegen in Syntrophie zu den Acetogenen. Sie verschieben das Gleichgewicht 4 H2 + 2 CO2 ↔ CH3-COOH nach rechts, indem sie das Endprodukt Essigsäure entfernen und CO2 recyceln.
Als Reduktionsmittel dient beim Acetyl-CoA-Weg elementarer Wasserstoff (H2). Er stammt, ebenso wie CO2, aus einer Reihe von Gärungsprozessen. Diese finden entweder in den acetogenen Bakterien selbst statt. Sie können durchweg heterotroph organisches Material zu H2/CO2 vergären und so die Reaktionspartner für den Acetyl-CoA-Weg bilden. Der Gesamtprozess aus Gärung und Acetogenese wird dann als Homoacetatgärung bezeichnet[5]. Die beiden Gase H2 [6][7] und CO2 werden aber auch durch andere gärende Organismen gebildet und ausgeschieden. Sie ermöglichen damit acetogenen Bakterien ein lithoautotrophes Wachstum.
Die exergone Redoxreaktion 4 H2 + 2 CO2 → CH3-COOH liefert nur so wenig Energie (ΔG0’ = -111 kJ/mol[5]), dass man von „Autotrophie am thermodynamischen Limit“[8] sprechen kann. Das zum Wachstum nötige ATP wird auch bei der Acetogenese nach dem Chemiosmotischen Prinzip durch eine ATP-Synthase gebildet.[2][9]
Ökologische Stellung und Vorkommen
Als anaerobe Atmung findet Acetogenese ausschließlich in Lebensräumen statt, in denen kein Sauerstoff (O2) zur Oxidation toten organischen Materials zur Verfügung steht. Der anaerobe Abbau geschieht schrittweise durch ganz unterschiedliche Mikroorganismen, die Abbauprodukte ausscheiden, welche dann anderen anaeroben Organismen als Nahrungsquelle dienen. Am Ende dieser Nahrungskette[2] stehen Lebewesen, die selbst dann noch wachsen können, wenn kein organisches Material mehr zur Verfügung steht. Dazu sind sie in der Lage, weil sie anorganisches CO2 zum Aufbau von Zellmaterial assimilieren können. Sie sind autotroph und zudem lithotroph, da sie anorganisches H2 zur Reduktion von CO2 verwenden.
Die CO2-Assimilation ist ein energetisch aufwendiger Prozess. Die Organismen am Ende der anaeroben Nahrungskette sind chemotroph. Das heißt, dass sie Energie nicht durch Licht, sondern aus chemischen Reaktionen gewinnen. Am Ende der anaeroben Atmungskette stehen zur Energiegewinnung nur noch die beiden Reaktionspartner zur Verfügung, die zur CO2-Assimilation dienen: CO2 und H2.
Diese beiden Verbindungen sind die Lebensgrundlage von zwei ganz unterschiedlichen Gruppen von Organismen: Acetogene Bakterien und Methanogene Archaeen.
| Merkmal | Acetogene | Methanogene |
|---|---|---|
| Endprodukt | Essigsäure | Methan |
| Energie liefernde Reaktion bei autotrophem Wachstum | 4 H2 + 2 CO2 → CH3-COOH + 2H2O, ΔG0’ ca. -100 kJ/mol | 4 H2 + CO2 → CH4 + 2H2O, ΔG0’ca. -130 kJ/mol |
| Alternative Substrate | Acetogene sind definitionsgemäß autotroph, einige können auch Kohlenstoffmonoxid nutzen. Sie können aber in der Regel auch heterotroph eine Vielzahl organischer Verbindungen verwerten. Das geschieht nicht nur durch Gärung, sondern auch durch Nutzung von Methylgruppen im Wood-Ljungdahl-Weg. | Manche Methanogene können niedermolekulare Methylverbindungen und Kohlenstoffmonoxid nutzen. Essigsäure ist Substrat bei allen acetoklastischen Methanogenen (Methanosarcina), die teilweise nur mit diesem Substrat wachsen können. Ameisensäure wird von vielen Methanogenen verwertet. |
| Elektronenakzeptoren der anaeroben Atmung | CO2 dient meist nur als Elektronenakzeptor in Abwesenheit stärkerer Oxidationsmittel wie Nitrat, Nitrit, Thiosulfat, Fumarat, Pyruvat und Acetaldehyd. Von einigen (hydrogenogenen) Acetogenen kann selbst H+ als Elektronenakzeptor genutzt werden, wenn z. B. Methanogene die Konzentration von H2 und CO2 sehr niedrig halten. | nur CO2 |
| Vorkommen | Acetogene kommen ausschließlich bei Bakterien, meist Firmicutes der Klasse Clostridia, aber auch bei Acidobakterien und Spirochaeten in mehr als 20 Gattungen. Oft sind acetogene mit nicht acetogenen Bakterien eng verwandt.[12] | Methanogene gehören ausschließlich zu Archaeen der Klasse Euryarchaeota. Diese gliedern sich Methanobacteriales, Methanococcales, Methanomicrobiales, Methanocellales, Methanosarcinales und Methanopyrales, nebst einigen klar abgegrenzten nicht methanogenen Clustern. |
Zusammenfassend unterscheiden sich acetogene Bakterien von methanogenen Archaeen darin, dass letztere durch ihre obligate „CO2-Atmung“ als Spezialisten auf das unterste Ende der anaeroben Nahrungskette fixiert sind. Die acetogene „CO2-Atmung“ ist dagegen eine zusätzliche Option von Organismen, die vielen taxonomischen Gruppen angehören. Häufig tritt sie nur unter bestimmten Wachstumsbedingungen auf. So kommt es, dass Acetogenese immer wieder bei Bakterien nachgewiesen wird, die vorger als nicht-acetogen gegolten haben.[13]

Acetogene Bakterien finden sich in vielen anaeroben Biotopen.
| Biotop | Organismus | Anmerkung |
|---|---|---|
| Boden | Clostridium aceticum | Erstes isoliertes acetogenes Bakterium (1936) |
| Kot, Kaninchen | Clostridium autoethanogenum | Produziert aus CO neben Essigsäure auch Ethanol |
| Darm, Säugetiere | Clostridium difficile | Acetogenese nur nachgewiesen bei Stämmen, die aus dem Pansen neugeborener Lämmer isoliert wurden. |
| Klärschlamm | Clostridium glycolicum | Acetogenese nachgewiesen bei einigen Stämmen. Ein Stamm ist aerotolerant bis zu 6 % O2 |
| Kot, Vögel | Clostridium ljungdahlii | Kann Nitrat als Elektronenakzeptor zu Ammoniak reduzieren. |
| Klärschlamm | Eubacterium limosum | Produziert bei Wachstum aus Kohlenstoffmonoxid auch Buttersäure |
| Boden | Moorella thermoacetica | Temperaturoptimum 55–60 °C |
| Vulkanische Quellen | Moorella thermoautotrophica | thermophil |
| Alkalische Gewässer | Natroniella | Halophile Bakterien, die zur Reduktion von CO2 nur organische Verbindungen nutzen können |
| Kot, Säugetiere | Ruminococcus | |
| Süßwassersediment | Holophaga foetida | Gehört nicht zu den Firmicutes, sondern zu den Acidobakterien |
| Termitenbau | Treponema primitia. | Gehört nicht zu den Firmicutes, sondern Spirochaeten |
| Marines Sediment | Acetobacterium woodii | Stickstoff-Fixierer |
| Süßwassersediment | Sporomusa malonica |
Biochemie acetogener Bakterien
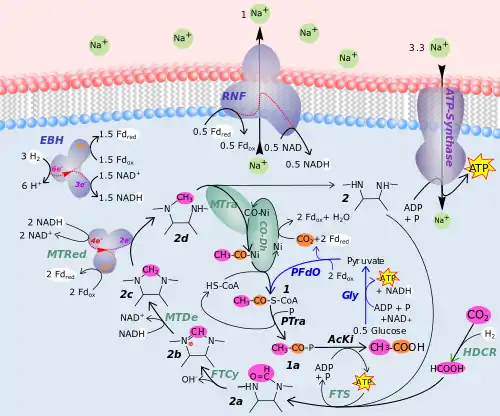
1 Acetyl-Coenzym A, 1a Acetylphosphat, 2 Tetrahydrofolat (THF), 2a Formyl-THF, 2b Methenyl-THF, 2c Methylen-THF, 2d Methyl-THF, AcKi Acetatkinase, CO-Dh CO-Dehydrogenase / Acetyl-CoA-Synthase, EBH Elektronenbifurkierende Hydrogenase, Fdox Ferredoxin, Fdred Ferredoxin 2−, FTCy Formyl-THF-Cyclohydrolase, FTS Formyl-THF-Synthetase, Gly Glycolyse, HDCR H2-abhängige CO2 -Reductase, MTDe Methylene-THF-Dehydrogenase, Mtra Methyltransferase, MTRed Methylene-THF-Reductase, PFdO Pyruvat:Fd-Oxidoreductase, Ptra Phosphotransacetylase, RNF Ferredoxin:NAD-Oxidoreductase (Rnf-Komplex)
Viele anaerobe Organismen fixieren CO2 mittels des Acetyl-CoA-Wegs, bei dem Coenzym A in „aktivierte Essigsäure“ (Acetyl-CoA) umgewandelt wird. Bei der Acetogenese wird das endergon produzierte Acetyl-CoA indes nicht nur zum Aufbau von Zellsubstanz, sondern vielmehr unter teilweiser Energierückgewinnung katabolisch umgesetzt.
In Abb. 3 sind die katabolischen Prozesse schematisch dargestellt. Bei der CO2 Fixierung wird bei zwei Reaktionen Energie verbraucht.
1. Die Reaktion von HCOOH mit THF (2) wird von der Formyl-THF-Synthetase (FTS) katalysiert und verbraucht ATP. Dieses wird im Prinzip durch die Acetat-Kinase (AcKi) bei der finalen Bildung von Essigsäure aus Acetylphosphat[14] (1a) regeneriert. (Abb. 3, unten)
2. Bei der Fixierung des zweiten CO2 wird von der CO-Dehydrogenase / Acetyl-CoA-Synthase (CO-Dh) Ferredoxin (Fd) oxidiert, das beim heterotrophen Wachstum beispielsweise durch die Pyruvat:Fd-Oxidoreductase (PFdO) regeneriert wird. Beim lithoautotrophen Wachstum muss indes das Ferredoxin endergon mittels H2 regeneriert werden. Der Mechanismus wurde erst im zweiten Jahrzehnt des 21. Jahrhunderts aufgeklärt:
- H2 wird in den Gesamtprozess durch eine Elektronenbifurkierende Hydrogenase (EBH) eingespeist. Dieses cytosolische Enzym regeneriert Ferredoxin und NADH. Dabei wird im Zellinneren H+ freigesetzt, das aus der Zelle gelangen muss, damit sie nicht übersäuert. Die Hydrogenase regeneriert nach dem Prinzip der Elektronenbifurkation synchron mit Ferredoxin auch NADH aus NAD+.
- Das NADH wird von der Methylene-THF-Dehydrogenase (MTDe) verbraucht, ebenso von einer bifurkierenden Methylene-THF-Reductase (MTRed), die dabei Ferredoxin reduziert.
- Ein membranständiges Enzym, die Ferredoxin:NAD-Oxidoreductase (Rnf-Komplex, RNF) fungiert schließlich nach dem Chemiosmotischen Prinzip als Ionenpumpe. Es nutzt dabei die Potentialdifferenz zwischen Fdred/Fdox und NADH/NAD+. Der Rückstrom der Ionen treibt die ATP-Regenerierung durch eine Na+-getriebene ATP-Synthase an.
Anmerkungen
- Acetogenese leitet sich ab von lateinisch acētum = Essig und altgriechisch γένεσις genesis = Herkunft. Die bei der Acetogenese überwiegend entstehende Essigsäure steht je nach pH-Wert im Gleichgewicht mit ihrer korrespondierenden Base Acetat.
- Die früher verwendete Bezeichnung Carbonatatmung ist irreführend, da Carbonate nicht direkt reduziert werden können, sondern vorher zu CO2 umgesetzt werden müssen. Zur Katalyse dieser Reaktion dient das Enzym Carboanhydrase, das auch von acetogenen Bakterien genutzt wird. (Siehe auch Kerry S. Smith, James G. Ferry: Prokaryotic carbonic anhydrases. In: FEMS Microbiology Reviews. 24, Nr. 4, 2000, S. 335–336. doi:10.1111/j.1574-6976.2000.tb00546.)
- Dazu zählen u. a. die Heterofermentative Milchsäuregärung, die Gemischte Säuregärung und die Propionsäuregärung.
Einzelnachweise
- Harold L. Drake, Kirsten Küsel, Carola Matthies: Acetogenic Prokaryotes. In: Eugene Rosenberg et al. (Hrsg.): The Prokaryotes – Prokaryotic Physiology and Biochemistry. 4. Auflage. Springer-Verlag, Berlin Heidelberg 2013, S. 4, doi:10.1007/978-3-642-30141-4_61.
- Fuchs, Georg: Allgemeine Mikrobiologie. 9. Auflage. Stuttgart 2014, ISBN 978-3-13-444609-8, S. 461–462.
- Jiyeong Jeong, Johannes Bertsch, Verena Hess, Sunju Choi, In-Geol Choi, In Seop Chang, Volker Müller,: Energy Conservation Model Based on Genomic and Experimental Analyses of a Carbon Monoxide-Utilizing, Butyrate-Forming Acetogen, Eubacterium limosum KIST612. In: Applied and Environmental Microbiology. Band 81, Nr. 14, 2015, S. 4782–4790, doi:10.1128/AEM.00675-15.
- Stephen W. Ragsdale, Elizabeth Pierce: Acetogenesis and the Wood–Ljungdahl pathway of CO2 fixation. In: Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics. Band 1784, Nr. 12, 2008, S. 1873–1898, doi:10.1016/j.bbapap.2008.08.012.
- Fuchs, Georg: Allgemeine Mikrobiologie. 9. Auflage. Stuttgart 2014, ISBN 978-3-13-444609-8, S. 435–438.
- Edward Schwartz, Johannes Fritsch, Bärbel Friedrich: H2-Metabolizing Prokaryotes. In: Eugene Rosenberg et al. (Hrsg.): The Prokaryotes – Prokaryotic Physiology and Biochemistry. 4. Auflage. Springer-Verlag, Berlin Heidelberg 2013, S. 119–200, doi:10.1007/978-3-642-30141-4_61.
- Debabrata Das & T.Nejat Veziroǧlu: Hydrogen production by biological processes: a survey of literature. In: International Journal of Hydrogen Energy. Band 26, Nr. 1, 2001, S. 13–28, doi:10.1016/S0360-3199(00)00058-6.
- Kai Schuchmann, Volker Müller: Autotrophy at the thermodynamic limit of life: a model for energy conservation in acetogenic bacteria. In: Nature Reviews Microbiology. Nr. 12, 2014, S. 809–821, doi:10.1038/nrmicro3365.
- Eva Biegel: Energiekonservierung in Acetobacterium. In: BIOspektrum. Nr. 4.12, 2012, S. 453, doi:10.1007/s12268-012-0209-5.
- Harold L. Drake, Kirsten Küsel, Carola Matthies: Acetogenic Prokaryotes. In: Eugene Rosenberg et al. (Hrsg.): The Prokaryotes – Prokaryotic Physiology and Biochemistry. 4. Auflage. Springer-Verlag, Berlin Heidelberg 2013, S. 3–61, doi:10.1007/978-3-642-30141-4_61.
- Harold L. Drake, Kirsten Küsel, Carola Matthies: Acetogenic Prokaryotes. In: Martin Dworkin, Stanley Falkow, Eugene Rosenberg, Karl-Heinz Schleifer, Erko Stackebrandt (Hrsg.): The Prokaryotes – Prokaryotic Physiology and Biochemistry. 3. Auflage. Springer-Verlag, New York, NY 2006, ISBN 978-0-387-30742-8, S. 354–420, doi:10.1007/0-387-30742-7.
- Harold L. Drake, Kirsten Küsel, Carola Matthies: Acetogenic Prokaryotes. In: Eugene Rosenberg et al. (Hrsg.): The Prokaryotes – Prokaryotic Physiology and Biochemistry. 4. Auflage. Springer-Verlag, Berlin Heidelberg 2013, S. 9–45, doi:10.1007/978-3-642-30141-4_61.
- Kirsten Küsel, Tanja Dorsch, Georg Acker, Erko Stackebrandt, Harold L. Drake: Clostridium scatologenes strain SL1 isolated as an acetogenic bacterium from acidic sediments. In: International Journal of Systematic and Evolutionary Microbiology. 50, Seiten=537–546, 2000.
- Acetylphosphat, Lexikon der Biologie; Acetylphosphat, Lexikon der Chemie. Auf spektrum.de.