Gemischte Säuregärung
Die Gemischte Säuregärung ist ein Weg des Abbaus von Zuckern zur Energiegewinnung unter anoxischen Bedingungen, der bei einigen fakultativ anaeroben Bakterien vorkommt, insbesondere bei einigen Gattungen der Enterobakterien. Der Abbau der Zucker verläuft auf verschiedenen Wegen und es wird eine Reihe von Endprodukten gebildet, im Wesentlichen Lactat, Acetat, Kohlenstoffdioxid (CO2), elementarer, molekularer Wasserstoff (H2), Ethanol und Succinat. Ein charakteristisches Zwischenprodukt ist Formiat (Anion der Ameisensäure), das fast vollständig in H2 und CO2 gespalten wird, manchmal aber auch teilweise oder vollständig ausgeschieden werden kann. Die Gemischte Säuregärung ist eine der beiden Formen der Ameisensäuregärungen.
| Übergeordnet |
| Glykolytische Gärung Metabolismus der D-Glucose |
| Gene Ontology |
|---|
| QuickGO |
Verlauf der Gärung
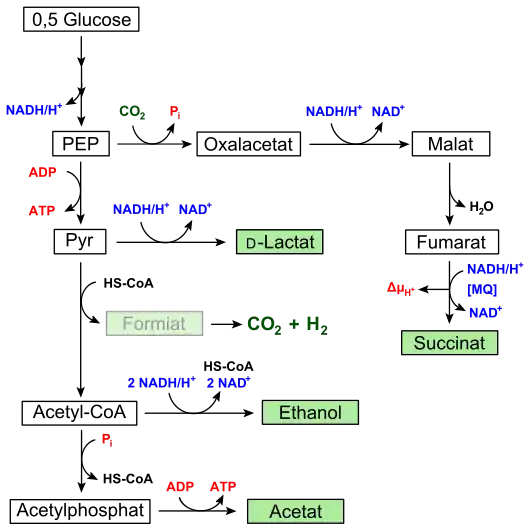
Hexosen werden typischerweise über den Weg der Glykolyse zu Pyruvat abgebaut, wobei durch Substratkettenphosphorylierung ATP erzeugt wird. Zum kleinen Teil werden diese auch über den Entner-Doudoroff-Weg (ED-Weg) zu Pyruvat umgesetzt. Beim Abbau wird NAD+ zu NADH reduziert. Damit dieses für weitere Runden der Glykolyse bzw. dem ED-Weg bereitsteht, wird es auf durch die im weiteren Verlauf der Gärung gebildete Zwischenprodukte (Pyruvat, Acetylphosphat,[1] Oxalacetat und Fumarat) wieder zu NAD+ reoxidiert. Im Gegensatz zur homofermentativen Milchsäuregärung entsteht bei der Gemischten Säuregärung ein Gemisch von verschiedenen organischen Verbindungen. Je nach Organismus und Umweltsituation unterscheiden sich die vorliegenden Mengenverhältnisse.[2] Bei Escherichia coli wurde die Menge der erzeugten organischen Verbindungen gemessen. Ein Mol Glucose wird hierbei umgesetzt zu:[3]
Ein charakteristisches Schlüsselenzym dieses Gärungstypes ist die Pyruvat-Formiat-Lyase, sie wird nur unter anaeroben Bedingungen gebildet.
Bildung von Succinat
Oxalacetat (OA) ist einer der möglichen Akzeptoren für Elektronen aus NADH. Dieses kann durch Carboxylierung von PEP gebildet werden, was eine Phosphoenolpyruvatcarboxylase (PEPC) katalysiert. OA wird dann durch eine Malatdehydrogenase zu L-Malat reduziert, und dieses nach Wasserabspaltung zu Fumarat umgesetzt, was eine Fumarase katalysiert. Eine Fumaratreduktase schließlich reduziert Fumarat zu Succinat.
Die Fumarat-Reduktase ist ein membrangebundenes Enzym, welches Elektronen aus dem Menachinol-Pool (MQH2) auf Fumarat überträgt. Menachinol wird entweder durch eine NADH-Dehydrogenase erzeugt, die NADH oxidiert und Menachinon (MQ) reduziert. Alternativ könnten die Elektronen auch von einer membranständigen Formiatdehydrogenase stammen, welche extrazelluläres Formiat zu Kohlenstoffdioxid oxidiert. die NADH-Dehydrogenase (bzw. auch die Formiat-Dehydrogenase) translokieren Protonen vom Cytosol nach außen, wodurch eine protonmotorische Kraft Δμ(H+) aufgebaut wird.[4]
In der Literatur wird die Nutzung Fumarats als reiner Elektronenakzeptor auch als Fumaratatmung bezeichnet.
Bildung von D-Lactat
NAD+ kann auch dadurch reoxidiert werden, indem Pyruvat zu Lactat reduziert wird. Dies wird von einer D-Lactatdehydrogenase katalysiert, im Gegensatz zur Milchsäuregärung entsteht dadurch das D-Isomer.[5]
Bildung von Formiat, Wasserstoff und Kohlenstoffdioxid
Pyruvat kann unter Einbeziehung von Coenzym A durch das Enzym Pyruvat-Formiat-Lyase (PFL) in Acetyl-CoA und Formiat gespalten werden. PFL ist das nur unter anoxischen Bedingungen gebildete Schlüsselenzym dieser Gemischten Säuregärung.[2] Es ersetzt unter diesen Bedingungen die Pyruvatdehydrogenase.[3] Formiat wird größtenteils von den Bakterien ausgeschieden. Falls ein geeigneter Elektronenakzeptor vorhanden ist, wird es im Zuge der Fumaratatmung durch eine membranständige Formiat-Dehydrogenase zu Kohlenstoffdioxid oxidiert, wobei die Elektronen auf Menachinon übertragen werden (vgl. Abschnitt oben). Falls diese Möglichkeit nicht mehr besteht und der pH-Wert des Mediums sinkt, wird Formiat nicht mehr ausgeschieden und durch eine cytosolische Formiat-Hydrogen-Lyase in CO2 und H2 gespaltet. Bei diesem Vorgang werden die gebundenen Reduktionsäquivalente als Wasserstoffgas freigesetzt. Da eine starke Säure (pKS = 3,7) in Wasserstoffgas (neutral) und Kohlenstoffdioxid (pKS = 6,3) umgesetzt wird, wirkt die Formiat-Hydrogen-Lyase der Ansäuerung des Mediums entgegen.[3]
Bildung von Acetat und Ethanol
Bei der Spaltung des Pyruvates entsteht Acetyl-CoA. Die Energie der energiereichen Thioesterbindung kann konserviert werden, indem Coenzym A gegen Phosphat ausgetauscht wird. Diese Reaktion wird durch eine Phosphotransacetylase katalysiert, es entsteht Acetylphosphat. Eine Acetatkinase setzt dieses schließlich zu Acetat um, wobei durch Substratkettenphosphorylierung ATP erzeugt wird.
Acetyl-CoA kann aber auch durch eine Coenzym-A-abhängige Alkoholdehydrogenase, ein bifunktionelles Enzym, zu Ethanol unter Verbrauch von zwei Molekülen NADH reduziert werden. Im Gegensatz zu anderen Alkoholdehydrogenasen wird Acetaldehyd als Zwischenprodukt nicht freigesetzt.[2] Bei diesem Vorgang wird kein ATP erzeugt.
Vorkommen
Von den jeweils weitaus meisten Arten der folgenden, fakultativ anaeroben Enterobakterien werden Zucker auf dem Weg der Gemischten Säuregärung abgebaut:[6] Citrobacter, Edwarsiella, Escherichia, Proteus, Providencia, Salmonella, Shigella, Yersinia[7] und einige andere Gattungen. Auch einige fakultativ anaerobe Bacillusarten führen diese Form der Gärung aus.[2]
Bedeutung für die Identifizierung von Bakterien
Der Abbau von Zuckern auf dem Weg der Gemischten Säuregärung ist ein taxonomisches Merkmal, das zur Bestimmung von Bakterien, besonders von Enterobakterien, verwendet wird. Dass zum Beispiel dieser Abbauweg in dem Enterobakterium E. coli vorliegt, wird durch den Nachweis der in großer Menge entstehenden Säuren (pH-Wert-Absenkung) festgestellt. Eine andere Gärung, die 2,3-Butandiol-Gärung, wird durch das Fehlen des für diese Gärung charakteristischen Zwischenprodukts Acetoin ausgeschlossen, d. h. der Nachweis von Acetoin durch die Voges-Proskauer-Reaktion fällt negativ aus. Die Ausschüttung von Acetoin kann aber zum Beispiel bei Klebsiella aerogenes, auch ein Enterobakterium, nachgewiesen werden.
Literatur
- Georg Fuchs (Hrsg.): Allgemeine Mikrobiologie (begr. von Hans G. Schlegel). 8. Auflage. Georg Thieme Verlag, Stuttgart, New York 2007, ISBN 978-3-13-444608-1.
- Katharina Munk (Hrsg.): Grundstudium Biologie. 2. Mikrobiologie. Reihe Spektrum Lehrbuch. Spektrum Akademischer Verlag, Heidelberg, Berlin 2001, ISBN 3-8274-0795-8.
Einzelnachweise
- Acetylphosphat, Lexikon der Biologie; Acetylphosphat, Lexikon der Chemie. Auf spektrum.de.
- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag Stuttgart 2008; ISBN 978-3-13-144861-3; S. 379ff.
- Georg Fuchs (Hrsg.), Hans. G. Schlegel (Autor): Allgemeine Mikrobiologie. Thieme Verlag Stuttgart; 8. Auflage 2007; ISBN 3-13-444608-1; S. 364ff.
- Katharina Munk (Hrsg.): Taschenlehrbuch Biologie: Mikrobiologie. Thieme Verlag Stuttgart 2008; ISBN 978-3-13-144861-3; S. 365.
- Garabed Antranikian: Angewandte Mikrobiologie. Springer, Berlin 2006; ISBN 978-3540240839; S. 64ff.
- Michael T. Madigan und John M. Martinko: Brock Mikrobiologie. Pearson Studium; 11., überarb. Auflage 2006; ISBN 978-3-8273-7187-4; S. 397.
- Katharina Munk: Grundstudium Biologie - Mikrobiologie. Spektrum Akademischer Verlag 2000; ISBN 3-8274-0795-8; S. 3–26.