4-Brombiphenyl
4-Brombiphenyl ist ein in 4- bzw. para-Stellung mit einem Bromatom substituiertes Biphenyl. Die Verbindung ist Ausgangsstoff für antibakterielle und antimykotische sowie gegen Herzinsuffizienz wirksame Arzneistoffe und rodentizide Agrochemikalien. 4-BBP dient als Vorstufe von Trägermaterialien für Organische Leuchtdioden (OLED), für Oligo-para-Phenyle und wegen seiner stäbchenförmigen Molekülgestalt zur Synthese nematischer thermotroper Flüssigkristalle.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||||||
| Name | 4-Brombiphenyl | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H9Br | ||||||||||||||||||
| Kurzbeschreibung |
weißer, kristalliner Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 233,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, wenig löslich in Chloroform, löslich in Ethanol, Diethylether, Benzol, Essigsäure[2] in Dichlormethan[4] und Tetrahydrofuran THF[5] | ||||||||||||||||||
| Brechungsindex |
1,6565 (25 °C, 589 nm)[6] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
In einer nach den amerikanischen Chemikern Moses Gomberg und Werner Emmanuel Bachmann benannten Gomberg-Bachmann-Reaktion reagiert das Diazoniumsalz des 4-Bromanilins mit Benzol zum 4-Brombiphenyl,[3]
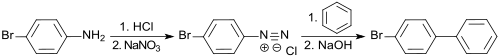
das nach Wasserdampfdestillation und Umkristallisation aus Ethanol in ca. 35 % Reinausbeute anfällt.
Bei der direkten Bromierung von Biphenyl mit (überschüssigem) elementarem Brom entsteht ein Gemisch von stellungsisomeren Mono- und Dibromiden. So entsteht in Essigsäure als Lösungsmittel und in Gegenwart von Zinkchlorid (ZnCl2) 4-BBP in 85 % Ausbeute neben 16 % 4,4′-Dibrombiphenyl (92-86-4), 5 % 2-Brombiphenyl (2052-07-5) und 1 % 2,4′-Dibrombiphenyl (49602-91-7).[7]
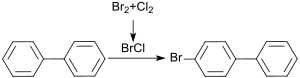
In Dichlormethan als Lösungsmittel wird mit äquimolaren Mengen Brom und Chlor unter Bildung von Bromchlorid (BrCl) 4-Brombiphenyl in 74 % Ausbeute, neben 13 % Biphenyl und 9 % 4,4′-Dibrombiphenyl, erhalten.[4]
Eigenschaften
4-Brombiphenyl ist ein farbloser Feststoff, der aus ethanolischer Lösung in kleinen Plättchen mit schichtartiger Anordnung der stäbchenförmigen Moleküle kristallisiert.[8]
4-BBP ist wassergefährdend und bioakkumulierend. Es konnte noch 2017 im Tiefenwasser und im Sediment des Genfersees in erhöhten Konzentrationen als Verunreinigung des bis 2001 auch in Europa produzierten technischen Flammschutzmittels Pentabromdiphenylether (PentaBDE) nachgewiesen werden.[9]
Anwendungen
para-Oligophenyle aus 4-BBP
Bei der Photolyse von 4-Brombiphenyl in Benzol entsteht ein Gemisch von überwiegend p-Terphenyl, neben Biphenyl und Bromwasserstoff HBr.[10]
para-Oligophenyle[11] besitzen eine hohe Tendenz zur Selbstassemblierung in faserartige Aggregate mit interessanten optischen, elektronischen und optoelektronischen Eigenschaften.
Durch Suzuki-Kupplung von in 4-Stellung funktionalisierten Iodbenzolen mit Benzol-1,4-diboronsäure (4612-26-4) in Gegenwart von Tetrakis(triphenylphosphin)palladium(0) (14221-01-3) entsteht eine 4-funktionalisierte Biphenylboronsäure, die mit 4-Brombiphenyl monosubstituierte para-Quaterphenyle liefert.[12]
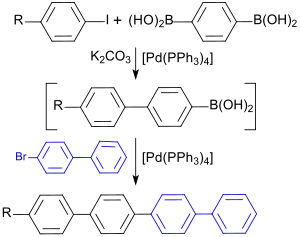
Substitutionsderivate von 4-BBP
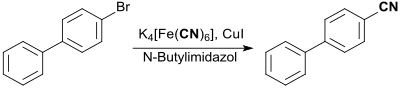
In einer Modifikation der Rosenmund-von-Braun-Reaktion zur Darstellung von Arylnitrilen aus Arylhalogeniden kann das giftige Kupfer(I)-cyanid CuCN durch das ungiftige Kaliumhexacyanidoferrat(II) K4[Fe(CN)6] ersetzt werden. In Anwesenheit von Kupfer(I)-iodid CuI und 1-Butyl-1H-imidazol (4316-42-1) wird 4-Brombiphenyl zu 4-Cyanobiphenyl (73 % Ausbeute) umgesetzt.[13][14] 4-Cyanobiphenyl (2920-38-9) ist Ausgangsverbindung für Flüssigkristalle und das DPP-Pigment C.I. Pigment Red 264 (DPP-Rubin).
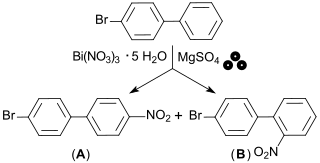
Zur Überführung von 4-Brombiphenyl in isomere 4-Bromnitrobiphenyle wurde ein „grünes“ mechanochemisches Verfahren angegeben, wobei beim Vermahlen mit Bismut(III)-nitrat-pentahydrat Bi(NO3)3·5 H2O in Gegenwart von Magnesiumsulfat MgSO4 bei vollständigem Umsatz im ungefähren Verhältnis 1:1 – 4-Brom-4′-nitrobiphenyl (6242-98-4) und 4-Brom-2′-nitrobiphenyl (35450-34-1) in ca. 48 % Ausbeute – gebildet werden.[15]
LC- und OLED-Materialien aus 4-BBP
Eine Standardvariante der mesogenen Cyanobiphenyle ist das als 5CB bezeichnete 4-Cyano-4′-pentylbiphenyl (40817-08-1). Zu seiner Synthese wird 4-BBP zunächst mit Buttersäurechlorid acyliert, die entstandene 4′-Butanoylverbindung in einer Wolff-Kishner-Reaktion mit Hydrazin zur 4′-Pentylverbindung reduziert und diese mit Kupfercyanid zum Zielprodukt umgesetzt.

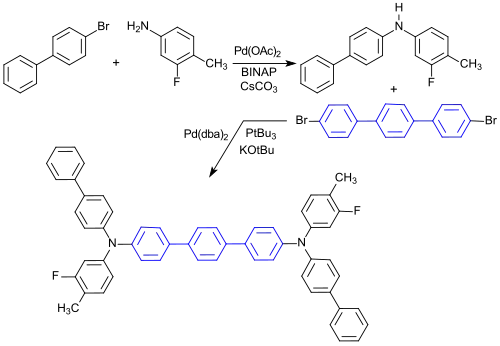
Auch Lochtransportmaterialien (engl. hole transport matrices HTM) für OLEDs vom Typ der Triarylamine sind, ausgehend von 4-Brombiphenyl, durch Reaktion mit 3-Fluor-4-methylanilin (452-77-7) zum sekundären Amin und anschließend mit 4,4′′-Dibrom-p-terphenyl (17788-94-2) zum Triarylamin zugänglich.[16]
Pharmakologisch aktive Wirkstoffe aus 4-BBP
Antimikrobiell und antimykotisch wirksame basische Biphenyle werden bei der Verknüpfung von 4-Brombiphenyl mit einem C3- bis C5-Alkylaminrest zugänglich.[17] Die erhaltenen Verbindungen sind wasserlöslich und auch gegen multiresistente Keime aktiv.
Der gegen Herzinsuffizienz eingesetzte Neprilysin-Inhibitor Sacubitril leitet sich ab von der Grignard-Verbindung des 4-BBP, die mit (S)-Epichlorhydrin zum entsprechenden chiralen Chlorhydrin reagiert.
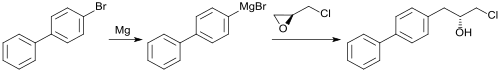
In weiteren Schritten wird der NEP (Neutrale Endopeptidase)-Inhibitor Sacubitril (AHU-377) aufgebaut.[5]
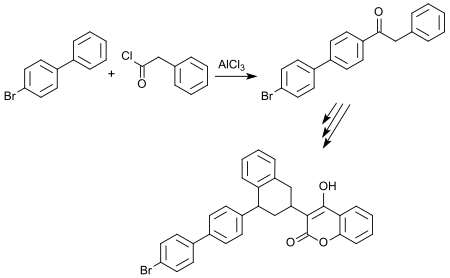
Die wegen ihrer extremen Wirksamkeit als „Superwarfarine“ bezeichneten Rodentizide (Nagetiergifte) Bromadiolon, Brodifacoum und Difethialon basieren auf 4-Brombiphenyl als wesentlichem Ausgangsstoff (engl. building block). In der ersten Stufe der Synthese des potentesten Wirkstoffs Brodifacoum (akute orale LD50 (Ratte) 0,27 mg/kg Körpergewicht[18]) wird 4-BBP mit Phenylacetylchlorid (103-80-0) in 4′-Stellung acyliert und in der letzten Stufe mit 4-Hydroxycumarin (1076-38-6) zum Endprodukt umgesetzt.[19]
Einzelnachweise
- Datenblatt 4-Brombiphenyl bei Sigma-Aldrich, abgerufen am 2. Juli 2021 (PDF).
- William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, Boca Raton, FL, U.S.A. 2015, ISBN 978-1-4822-6097-7, S. 3–62.
- M. Gomberg, W.E. Bachmann: p-Bromobiphenyl In: Organic Syntheses. 8, 1928, S. 42, doi:10.15227/orgsyn.008.0042; Coll. Vol. 1, 1941, S. 113 (PDF).
- Patent US5107044: Process for bromination of biphenyl with BrCl. Angemeldet am 20. September 1990, veröffentlicht am 21. April 1992, Anmelder: Rhone-Poulenc Chimie, Erfinder: A. Nonn.
- Patent EP2890672B1: Processes for preparing intermediates for the manufacture of NEP inhibitors. Angemeldet am 2. September 2013, veröffentlicht am 30. Mai 2018, Anmelder: Novartis AG, Erfinder: G. Zhu et al..
- Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 361.
- Patent US4990705: Preparation of 4-bromobiphenyl. Angemeldet am 24. April 1989, veröffentlicht am 5. Februar 1991, Anmelder: Rhone-Poulenc Chimie, Erfinder: A. Nonn.
- C.P. Brock: 4-Bromobiphenyl; an ordered crystal with a structure similar to that of biphenyl. In: Acta Cryst. Band 36, Nr. 4, 1980, S. 968–971, doi:10.1107/S0567740880005043.
- S. Samanipour, P. Dimitriou-Christidis, D. Nabi, J.S. Arey: Elevated Concentrations of 4-Bromobiphenyl and 1,3,5-Tribromobenzene Found in Deep Water of Lake Geneva Based on GC×GC-ENCI-TOFMS and GC×GC-μECD. In: ACS Omega. Band 2, Nr. 2, 2017, S. 641–652, doi:10.1021/acsomega.6b00440.
- N. Kharasch, R.K. Sharma, H.B. Lewis: The photolysis of 4-bromobiphenyl in benzene. In: Chem. Commun. (London). Band 13, 1966, S. 418–419, doi:10.1039/C19660000418.
- W. Ried, D. Freitag: Oligophenyle, Oligophenylene und Polyphenyle, eine Klasse thermisch sehr beständiger Verbindungen. In: Angew. Chem. Band 80, Nr. 22, 1968, S. 932–942, doi:10.1002/ange.19680802203.
- I. Wallmann, M. Schiek, R. Koch, A. Lützen: Synthesis of monofunctionalized p-quaterphenyls. In: Synthesis. Band 15, 2008, S. 2446–2450, doi:10.1055/s-2008-1067163.
- T. Schareina, A. Zapf, W. Mägerlein, N. Müller, M. Beller: A state-of-the-art cyanation of aryl bromides: A novel and versatile copper catalyst system inspired by nature. In: Chemistry – A European Journal. Band 13, Nr. 21, 2007, S. 6249–6254, doi:10.1002/chem.200700079.
- T. Schareina, A. Zapf, A. Cotté, N. Müller, M. Beller: A bio-inspired copper catalyst system for practical catalytic cyanation of aryl bromides. In: Synthesis. Band 20, 2008, S. 3351–3355, doi:10.1055/s-0028-1083161.
- F.-C. Guo, M.-Z. Ji, P. Zhang, Z.-X. Guo: Facile nitration of aromatic compounds using Bi(NO3)3·5 H2O / MgSO4 under mechanochemical conditions. In: Green Process. Synth. Band 7, Nr. 5, 2018, S. 453–459, doi:10.1515/gps-2017-0069.
- Patent EP3002797B1: A light emitting organic device and an active OLED display. Angemeldet am 30. September 2014, veröffentlicht am 29. April 2020, Anmelder: Novaled GmbH, Erfinder: C. Rothe, T. Rosenow, M. Köhler, T. Canzler, A. Haldi.
- Patent EP2654740B1: Antibakteriell und antimykotisch wirksame Biphenyl-Verbindungen. Angemeldet am 21. Dezember 2011, veröffentlicht am 11. Februar 2015, Anmelder: Christian-Albrechts-Universität zu Kiel, Erfinder: B. Clement, F. Furkert, B. Gerig, D. Heber.
- Ramesh C. Gupta: Veterinary Toxicology: Basic and Clinical Principles, 1st Edition. Elsevier Inc., Amsterdam, NL 2007, ISBN 978-0-12-370467-2, S. 527.
- J.-C. Jung, S. Oh: Practical synthesis of hydroxychromenes and evaluation of their biological activity. In: Molecules. Band 17, 2012, S. 240–247, doi:10.3390/molecules17010240.


