Gomberg-Bachmann-Reaktion
Bei der Gomberg-Bachmann-Reaktion handelt es sich um eine Namensreaktion in der Organischen Chemie, die nach dem ukrainisch-US-amerikanischen Chemiker Moses Gomberg (1866–1947) und dem US-amerikanischen Chemiker Werner Emmanuel Bachmann (1901–1951) benannt wurde. Die Reaktion wurde 1924 zur Synthese von symmetrischen und unsymmetrischen Diarylen (Biphenylen) aus Aryldiazoniumsalzen entwickelt.[1]
Übersichtsreaktion
Bei der Gomberg-Bachmann-Reaktion reagieren Aryldiazoniumsalze in einer wässrigen, alkalischen Lösung mit Aromaten (z. B. Benzol) zu Diarylverbindungen:[2]
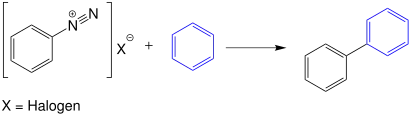
Die intramolekulare Variante der Gomberg-Bachmann-Reaktion ist als Pschorr-Cyclisierung bekannt.[3]
Mechanismus
Am Beispiel von Benzoldiazoniumchlorid und Benzol soll der Mechanismus[4][5] zur Synthese von Biphenyl erklärt werden. Wird Diazoniumsalz 1 mit Natronlauge behandelt, entsteht in einer Gleichgewichtsreaktion Benzoldiazohydroxid 2, welches mit einem weiteren Diazoniumsalz unter Protonenabspaltung zum Benzoldiazoanhydrid 3 reagiert. Den Beweis für die Existenz von 3 erbrachte Rüchardt durch Kreuzungsexperimente.[6] Dieses Anhydrid spaltet Stickstoff ab und reagiert zu einem Benzoldiazoanhydrid-Radikal 4 und einem Phenylradikal 5.[7] Das reaktive Phenylradikal greift das Benzol unter Bildung eines mesomeriestabilisierten Radikals (Phenylcyclohexadienyl-Radikal) (6) an. Bei diesem Reaktionsschritt handelt es sich um eine radikalische Substitution.[8][9][10] Das Radikal 6 reagiert dann mit 4 unter Abspaltung von 2 zu Biphenyl (7).

Aufgrund von Nebenreaktionen hat die Gomberg-Bachmann-Reaktion oft eine Ausbeute von weniger als 40 %. Durch Phasentransfer-Katalysatoren kann die Ausbeute deutlich gesteigert werden.[11]
Selektivität
Gemäß der allgemeinen Regel, dass die Selektivität mit zunehmender Reaktivität abnimmt, sind die hoch reaktiven Arylradikale wenig selektiv. Deshalb wird als Aromat meist Benzol eingesetzt.[12]
Beispiel
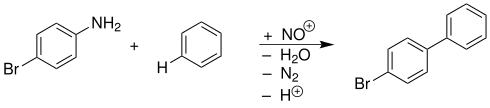
4-Bromanilin und Benzol reagieren durch Diazotierung in alkalischer Lösung zu 4-Brombiphenyl:[13]
Einzelnachweise
- M. Gomberg, W. E. Bachmann: The Synthesis of Biaryl Compounds by means of the Diazo Reaction. In: J. Am. Chem. Soc. Band 46, 1924, S. 2339–2343, doi:10.1021/ja01675a026.
- T. Laue, A. Plagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 158–160.
- DeLos F. DeTar: The Pschorr Synthesis and Related Diazonium Ring Closure Reactions. In: Organic Reactions. Band 9, 1957, S. 409–462, doi:10.1002/0471264180.or009.07.
- T. Laue, A. Plagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 158–160.
- Z. Wang: Comprehensive Organic Name Reactions and Reagents. Vol. 1. Wiley, 2009, ISBN 978-0-471-70450-8, S. 1248–1251.
- Christoph Rüchardt, Ekkehard Merz: Der Mechanismus der Bachmann-Gomberg Reaktion. In: Tetrahedron Letters. Band 5, Nr. 36, 1964, S. 2431–2436, doi:10.1016/S0040-4039(00)70404-7.
- Jan Bülle, Aloys Hüttermann: Das Basiswissen der organischen Chemie. Wiley-VCH, 2008, ISBN 978-3-527-30847-7.
- M. Gomberg, W. E. Bachmann: The Synthesis of Biaryl Compounds by means of the Diazo Reaction. In: J. Am. Chem. Soc. Band 42, 1924, S. 2339–2343, doi:10.1021/ja01675a026.
- M. B. Smith, J. March: March's Advanced Organic Chemistry. Wiley, 2001, ISBN 0-471-58589-0.
- R. Bolton, G. Williams: Homolytic arylation of aromatic and polyfluoroaromatic compounds. In: Chem. Soc. Rev. Band 15, 1986, S. 261–289, doi:10.1039/CS9861500261 (Review).
- James R. Beadle, Stephen H. Korzeniowski, David E. Rosenberg, Blanche J. Garcia-Slanga, George W. Gokel: Phase-transfer-catalyzed Gomberg-Bachmann synthesis of unsymmetrical biarenes: a survey of catalysts and substrates. In: The Journal of Organic Chemistry. Band 49, Nr. 9, 1984, S. 1594–1603, doi:10.1021/jo00183a021.
- S. Hauptmann: Reaktion und Mechanismus in der organischen Chemie. Teubner Verlag, 1991, ISBN 978-3-519-03515-2.
- M. Gomberg, W. E. Bachmann: p-Bromobiphenyl In: Organic Syntheses. 8, 1928, S. 42, doi:10.15227/orgsyn.008.0042; Coll. Vol. 1, 1941, S. 113 (PDF).