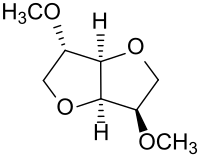
2,5-Dimethylisosorbid
2,5-Dimethylisosorbid ist ein Ether des bicyclischen Diols Isosorbid, das als biobasierte Plattformchemikalie aus nachwachsenden Rohstoffen großes Interesse findet.[8][9]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2,5-Dimethylisosorbid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C8H14O4 | |||||||||||||||
| Kurzbeschreibung |
klare, farblose Flüssigkeit[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 174,19 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,4622 (20 °C, 589 nm)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Dimethylisosorbid eignet sich als wenig toxisches Lösungsmittel für pharmakologisch aktive Wirkstoffe, deren Eindringen in die Haut es fördert.[10]
Vorkommen und Darstellung
2,5-Dimethylisosorbid wird z. B. durch Williamson-Ethersynthese aus Isosorbid in Wasser bei gleichzeitiger Zugabe von Dimethylsulfat und 30%iger Natronlauge in 77%iger Ausbeute erhalten.[11]
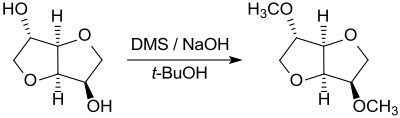
Wasser bzw. verdünnte Natronlauge sind wegen der hohen Hydrolyseneigung des Dimethylsulfats im Alkalischen als Reaktionsmedium eher weniger geeignet.
In Aceton als Lösungsmittel wird DMI unter ähnlichen Prozessbedingungen nach Vakuumdestillation in 82,6 % Ausbeute erhalten.[4]
Die konventionelle Williamson-Synthese liefert mit einer Reihe von Alkylierungsmitteln, wie Dimethylsulfat, Methyliodid oder p-Toluolsulfonsäuremethylester in tert-Butanol als Lösungsmittel Dimethylisosorbid in 91 bis 93%iger Ausbeute.[12]
In jüngerer Zeit wurden Synthesen für 2,5-Dimethylisosorbid publiziert, die den bio-basierten Dimethylether unter Vermeidung carcinogener Alkylierungsmittel mit weniger problematischen Methylgruppendonoren erzeugen.[5]
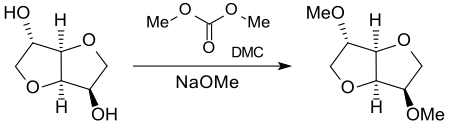
Insbesondere Dimethylcarbonat DMC wird als „grünes“ Alkylierungsmittel intensiver untersucht, wobei auch eine Eintopfreaktion, ausgehend von D-Sorbit, beschrieben wird.[13]
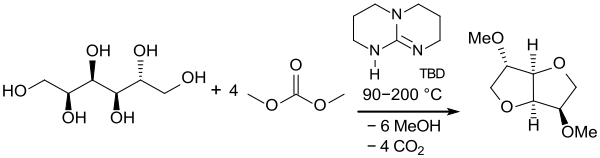
Die DMI-Synthese unter Verwendung von Dimethylcarbonat als Kondensations- und Methylierungsmittel benötigt sehr lange Reaktionszeiten (10[14] bis 72 h[13]), hohe Temperaturen (90 bis 200 °C) und hohe Drücke (20 bis 85 bar) in Laboransätzen (meist 10 millimolar). Isolierung durch Vakuumdestillation und Reinigung über Säulenchromatographie liefert meist relativ niedrige kalkulierte Ausbeuten an DMI (z. B. 69 %[13]), womit die Anforderungen an einen wirtschaftlich rentablen industriellen Prozess noch nicht erfüllt werden können.
Eigenschaften
2,5-Dimethylisosorbid ist eine klare, farblose Flüssigkeit mit schwachem Geruch, die sich mit Wasser und vielen organischen Lösungsmitteln mischt. Wegen seiner günstigen Eigenschaften (z. B. geringe Augen- und Hautreizung und sehr niedrige Toxizität)[6] wurde DMI als bio-basierter Ether und Ersatz für problematische Lösungsmittel, wie z. B. Ethylenglykoldimethylether Glyme oder Tetrahydrofuran THF untersucht und klassifiziert.[15] Der Ether DMI ist nicht toxisch gegenüber Wasserorganismen, aber trotz seiner „grünen“ Herkunft nicht bioabbaubar.[10] Nachteilig ist vor allem sein hoher Siedepunkt, der die vollständige Abtrennung des DMI erschwert.[15]
Anwendungen
2,5-Dimethylisosorbid hat sich als brauchbares Lösungsmittel für Palladium-katalysierte Kreuzkupplungsreaktionen, wie z. B. die Sonogashira-Kupplung, die Heck-Reaktion und die Suzuki-Kupplung erwiesen.[16]
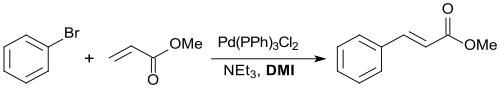
So wird bei der Reaktion von Brombenzol mit Acrylsäuremethylester in DMI in Gegenwart von Triethylamin und dem Katalysator Bis(triphenylphosphin)palladiumchlorid Zimtsäuremethylester in 98%iger Ausbeute erhalten.
Neben technischen Anwendungen, wie z. B. als Kraftstoffadditiv, als Elektrolytkomponente in Lithiumbatterien oder Lösemittel in der Halbleiterfertigung eignet sich DMI als Formulierungs- und Stabilitätsverbesserer in kosmetischen und pharmazeutischen dermalen Zubereitungen. Als Penetrationsverstärker (ähnlich Dimethylsulfoxid DMSO) bewirkt DMI den beschleunigten und erhöhten Transport von gelösten Wirkstoffen, z. B. des Selbstbräuners Dihydroxyaceton DHA oder des gegen Akne eingesetzten Wirkstoffs Benzoylperoxid, in und durch die Epidermis- und Dermis-Schicht der Haut. Auch in Pflanzenschutzformulierungen erhöht Dimethylisosorbid das Eindringen der Wirkstoffe in die Wachsschicht (Cuticula) von Blättern.[17]
2,5-Dimethylisosorbid ist u. a. als Super Refined® Arlasolve® DMI der Firma Croda International, Dottisol® der Dottikon ES Holding und Salibide® DMI der Salicylates & Chemicals Pvt. Ltd. im Handel.
Einzelnachweise
- Eintrag zu DIMETHYL ISOSORBIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 23. Oktober 2021.
- Datenblatt Isosorbide dimethyl ether bei Sigma-Aldrich, abgerufen am 11. Mai 2019 (PDF).
- Anna & George Wypych: Databook of Green Solvents, 2nd Edition. ChemTec Publishing, Toronto 2019, ISBN 978-1-927885-43-7, S. 336–337.
- Patent US4322359: Process for the preparation of 2,5-dimethyl-1,4:3,6-dianhydrosorbitol. Angemeldet am 19. März 1981, veröffentlicht am 30. März 1982, Anmelder: American Cyanamid Co., Erfinder: R.L. Hillard, I.D. Greene.
- P. Tundo, F. Aricò, G. Gauthier, L. Rossi, A.E. Rosamilia, H.S. Bevinakatti, R.L. Sievert, C-P. Newman: Green synthesis of dimethyl isosorbide. In: ChemSusChem. Band 3, Nr. 5, 2010, S. 566–570, doi:10.1002/cssc.201000011.
- Arlasolve DMI. In: Full Public Report, File No: STD/1052. NICNAS, 12. Mai 2004, abgerufen am 22. Mai 2019.
- Safety Data Sheet (Dimethyl Isosorbide). Parchem, 21. Dezember 2016, abgerufen am 22. Mai 2019.
- M. Rose, R. Palkovits: Isosorbide as a renewable platform chemical for versatile applications – quo vadis? In: ChemSusChem. Band 5, Nr. 1, 2012, S. 167–176, doi:10.1002/cssc.201100580.
- F. Aricò, P. Tundo: Isosorbide and dimethyl carbonate: a green match. In: Beilstein J. Org. Chem. Band 12, 2016, S. 2256–2266, doi:10.3762/bjoc.12.218.
- W. Zhang, B.W. Cue: Green Techniques for Organic Synthesis and Medical Chemistry, 2nd Edition. John Wiley & Sons, Hoboken, NJ, U.S.A. 2018, ISBN 978-1-119-28817-6, S. 27.
- R. Montgomery, L.F. Wiggins: 77. The anhydrides of polyhydric alcohols. Part IV. The constitution of dianhydro sorbitol. In: J. Chem. Soc. 1946, S. 390–393, doi:10.1039/JR9460000390.
- Patent EP0205770B1: Verfahren zur Herstellung von 2,5-Dimethyl- bzw. 2,5-Diethyl-1,4:3,6-dianhydrosorbitol. Angemeldet am 21. März 1986, veröffentlicht am 10. September 1991, Anmelder: Rütgerswerke AG, Erfinder: M. Maurer, W. Orth, W. Fickert.
- F. Aricò, A.S. Aldoshin, P. Tundo: One-pot preparation of dimethyl isosorbide from D-sorbitol via dimethyl carbonate chemistry. In: ChemSusChem. Band 10, Nr. 1, 2017, S. 53–57, doi:10.1002/cssc.201601382.
- Green approach to the isosorbide conversion into dimethyl isosorbide. (PDF; 241 KB) 4th International Congress on Catalysis for Biorefineries, abgerufen am 20. Mai 2019 (englisch).
- C.M. Alder, J.D. Hayler, R.K. Henderson, A.M. Redman, L. Shukla, L.E. Shuster, H.F. Sneddon: Updating and further expanding GSK’s solvent sustainability guide. In: Green Chem. Band 18, Nr. 13, 2016, S. 3879–3890, doi:10.1039/C6GC00611F.
- K.L. Wilson, J. Murray, H.F. Sneddon, C. Jamieson, A.J.B. Watson: Dimethylisosorbide (DMI) as a bio-derived solvent for Pd-catalyzed cross-coupling reactions. In: Synlett. Band 29, Nr. 17, 2018, S. 2292–2297, doi:10.1055/s-0037-1611054.
- Dottisol. Dottikon Exclusive Synthesis, 2019, abgerufen am 22. Mai 2019.