Isosorbid
Isosorbid ist eine bicyclische chemische Verbindung aus der Gruppe der Diole und der sauerstoffhaltigen Heterocyclen, bei der zwei Furanringe anelliert sind. Ausgangsmaterial für Isosorbid ist D-Sorbit, das durch katalytische Hydrierung von D-Glucose erhalten wird, die wiederum durch Hydrolyse aus Stärke entsteht. Isosorbid wird daher auch als pflanzenbasierte Plattformchemikalie diskutiert, aus der bioabbaubare Derivate unterschiedlicher Funktionalität abgeleitet werden können.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
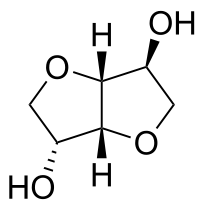 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Isosorbid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H10O4 | |||||||||||||||||||||
| Kurzbeschreibung |
Weißer, geruchloser, kristalliner, hygroskopischer Feststoff[2][3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 146,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||||||||
| Dichte |
1,30 g·cm−3 [4] | |||||||||||||||||||||
| Schmelzpunkt |
61–64 °C[2] | |||||||||||||||||||||
| Siedepunkt |
zersetzt sich oberhalb von 270 °C[2] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Als Monomerbaustein für biopolymere Polycarbonate, Polyester, Polyurethane und Epoxide findet Isosorbid derzeit großes wissenschaftliches und technisches Interesse.
Gewinnung und Darstellung
Isosorbid wird durch säurekatalysierte dimolekulare Dehydratisierung aus D-Sorbit erhalten, wobei zunächst das monocyclische furanoide Sorbitan entsteht, aus dem durch weitere Wasserabspaltung das bicyclische Furofuran-Derivat Isosorbid gebildet wird.[7]
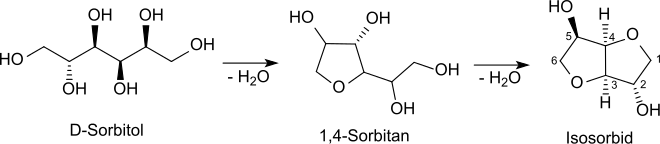
Die Reaktion liefert ca. 70 bis 80 % Isosorbid neben 30 bis 20 % unerwünschten Nebenprodukten, die relativ aufwendig durch Destillation, Umkristallisation aus Alkoholen, Umkristallisation aus der Schmelze,[8] bzw. durch eine Kombination dieser Methoden oder durch Abscheidung aus der Dampfphase[9] erfolgen kann. Die hohe Reinheit (>99,8 %[9]) des Isosorbids als Monomer ist für die Erzielung hoher Molgewichte und ungefärbter Produkte unabdingbar.
Eigenschaften
Isosorbid ist ein weißer kristalliner Feststoff, der an feuchter Luft stark wasseranziehend wirkt. Die unterschiedliche Orientierung der sekundären Hydroxygruppen im V-förmig angeordneten bicyclischen System führt zu unterschiedlichen physikalischen Eigenschaften und chemischen Reaktivitäten und erlaubt daher die selektive Monoderivatisierung von Isosorbid. Die Hydroxygruppe in 5-Position ist endo-ständig und bildet mit dem Sauerstoffatom im benachbarten Furanring eine Wasserstoffbrücke aus. Dadurch wird die Hydroxygruppe in 5-Position nucleophiler und reaktiver als die exo-ständige Hydroxygruppe in Position 2; sie ist jedoch gegenüber dem Angriff sterisch anspruchsvoller Reaktanden stärker abgeschirmt.[10]
Verwendung
Isosorbid
Wegen seiner ausgeprägten Hygroskopizität wird Isosorbid als Feuchthaltemittel, in der Medizin als osmotisches Diuretikum zur Behandlung von Hydrocephalus und akutem Engwinkelglaukom eingesetzt.[11] Die beiden sekundären Hydroxygruppen machen Isosorbid zu einer vielseitig verwendbaren Plattformchemikalie aus nachwachsenden Rohstoffen. Als Diol kann Isosorbid mit Standardreaktionen der Organischen Chemie, wie Nitrierung, Veresterung, Veretherung, Tosylierung usw. mono- oder bifunktionell derivatisiert und in Verbindungen mit interessanten Eigenschaftsprofilen sowie in Monomerbausteine für neuartige Polymere überführt werden.[12]
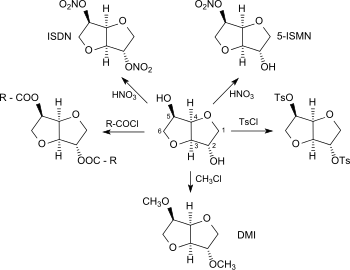
Isosorbidnitrate
Das durch Nitrierung von Isosorbid mit konz. Salpetersäure zugängliche 2,5-Isosorbiddinitrat (ISDN) eignet sich wie sein Hauptmetabolit 5-Isosorbidmononitrat (ISMN)[13] wegen seiner gefäßerweiternden Wirkung zur Behandlung der Angina Pectoris.[14]
Isosorbidester
Bei Veresterung von Isosorbid mit Fettsäuren sind Isosorbidmonoester zugänglich, die sich wegen ihrer grenzflächenaktiven Eigenschaften als Detergentien in Haushaltsreinigern, Geschirrspülmitteln und kosmetischen Zubereitungen eignen.[15] Die ebenfalls leicht zugänglichen Isosorbiddiester[16] werden als Dispergiermittel für Pigmente, Konservierungsstoffe, Polymerstabilisatoren, als Emulgatoren für Kosmetika und als Weichmacher für Vinylpolymere, insbesondere Polyvinylchlorid (PVC) verwendet. Isosorbiddioctanoat[17] besteht als Diester aus Isosorbid und Octansäure (z. B. aus Palmöl gewonnen) vollständig aus biobasierten Bausteinen und ist als Polysorb(R) ID 37 der Firma Roquette Frères seit einiger Zeit als besonders untoxisches Produkt in Gebrauch.[18]
Isosorbidether
Isosorbidether, insbesondere der einfachste Vertreter, 2,5-Dimethylisosorbid (DMI), finden zunehmend Verbreitung als nachhaltiges Lösemittel für kosmetische und pharmazeutische Zubereitungen[19] sowie als Elektrolytzusatz für Lithium-Ionen-Akkumulatoren[20] und als Treibstoffzusatz für Diesel.[21]
Isosorbidphosphate
Phosphorsäurederivate des Isosorbids werden als umweltverträgliche Alternative zu halogenhaltigen Flammschutzmitteln erforscht. Bislang wurde 1,2,5,6,9,10-Hexabromcyclododecan (HBCD) als Flammschutzmittel in extrudierten Polystyrolhartschäumen (XPS) im Bausektor für die Gebäudedämmung verwendet, dieses wurde jedoch seit Mai 2013 als SVHC (substance of very high concern) mit einem Herstell- und Anwendungsverbot belegt. Als Ersatz kommen u. a. phosphorbasierte Isosorbidverbindungen, wie z. B. Isosorbid-bis(diphenylphosphat), ISTP, in Betracht.
.svg.png.webp)
ISTP ist einfach durch Umesterung von Isosorbid mit Triphenylphosphat in Gegenwart von Kaliumcarbonat bei 150 °C zugänglich. Das als gelbliches Öl in 88%iger Ausbeute erhaltene Isosorbid-bis-diphenylphosphat enthält ca. 20 % Dimere.[22] Die hohe Zersetzungstemperatur von ISTP erlaubt den Einsatz in XPS, wobei der starke Weichmachereffekt allerdings störend wirkt. Besonders ausgeprägt ist die Flammschutzwirkung in Gegenwart von schwefelhaltigen Synergisten, wie z. B. Bis(diphenylphosphinothionyl)disulfid (BDPS), so dass bei 3 % ISTP die Mindestanforderung der Brandschutzklasse B2 erfüllt wird.[23]
Polymere aus Isosorbid
Die inzwischen gute Verfügbarkeit und die hohe thermische Stabilität des Isosorbids machen dieses Diol aus nachwachsenden Rohstoffen interessant als Monomerbaustein für thermoplastische (Bio)Polymere wie Polyester und Polycarbonate, sowie für Duroplaste wie Polyurethane oder Epoxidharze.[12] Die Hydroxygruppen können über die Tosylate und Azide in primäre Aminogruppen[12], bzw. durch Addition von Acrylnitril und anschließende Hydrierung mit hoher Ausbeute in die entsprechenden Aminopropylderivate überführt werden[24], die sich als Ausgangsstoffe für Di-isocyanate – zur Darstellung von Polyurethanen – als Diamine zur Darstellung von Polyamiden oder auch als Härter für Epoxyharze eignen.
Der Ersatz von Monoethylenglycol (MEG) als Diol in dem Polyester Polyethylenterephthalat (PET) führt zum Polyisosorbidterephthalat (PIT), das sich durch eine außerordentlich hohe thermische Stabilität (bis 360 °C unter Stickstoff) auszeichnet. Allerdings bedingt die geringere Reaktivität der sekundären Hydroxygruppen im Isosorbid relativ niedrige Molmassen und hohe Restgehalte an Terephthalsäure, die die zu geringer chemischer Stabilität der erhaltenen Polymeren führen. Daher werden heute Polyester mit Isosorbid und MEG als Diolkomponenten untersucht, die verbesserte Eigenschaften zeigen, wie z. B. geringere Verfärbung.[25][26]
Besonderes Interesse findet Isosorbid als Monomer in Polycarbonaten,[27][28] wo es das als Xenoestrogene identifizierte Bisphenol A ersetzen könnte. Problematisch bei isosorbid-basierten Polycarbonaten ist deren unbefriedigende Temperaturbeständigkeit und Schlagzähigkeit, die durch Zugabe von Comonomeren zum Isosorbid oder durch Polymerblends verbessert wird.[29]
In Polyurethanen kann Isosorbid selbst als Diol[30] oder als Baustein für die Polyol-[31] wie für die Diisocyanatkomponente[32] dienen, sowie als Kettenverlängerer[33] fungieren. Durch Umsetzung von Isosorbid mit Epichlorhydrin erhält man Isosorbid-bis-glycidylether[34] (ein Bis-Epoxid), das als Ersatz für das analoge Bisphenol A-bis-epoxid mit geeigneten Härtern, wie z. B. Polyaminen oder cyclischen Säureanhydriden zu duroplastischen Epoxidharzen umgesetzt werden kann, die als Klebstoffe, Anstrichfarben oder für Beschichtungen von Dosen für Lebensmittel[35] Verwendung finden.
Weiter sind Polyoxazolidone durch Reaktion von Isosorbid-diglycidylethern mit Diisocyanaten beschrieben[36], die als starre, hochverzweigte und lösemittelbeständige Duroplaste Verwendung in der Elektro- und Elektronikindustrie finden könnten.
Isosorbid ist eine vielseitig einsetzbare Plattformchemikalie aus nachwachsenden Rohstoffen, die inzwischen auch in industriellen Mengen von mehreren zehntausend Tonnen/Jahr in Europa (Roquette Frères S.A.) und U.S.A. (Cargill, Inc. und Archer Daniels Midland Co.) verfügbar ist. Für besonders aussichtsreich wird derzeit der Einsatz von Isosorbid als Comonomer in PET als Flaschenrohstoff[37] und als Ersatzstoff für Bisphenol A, besonders in duroplastischen Polycarbonaten, gehalten.
Sicherheitshinweise
Mit einer LD50-Wert von 24,15 g·kg−1 (Ratte, oral)[6] ist Isosorbid ähnlich untoxisch wie D-Glucose, ebenfalls mit einer LD50 von 25,8 g·kg−1 (Ratte, oral)[38] und ist von der Food and Drug Administration FDA als GRAS („generally recognized as safe“)-Substanz eingestuft.[39]
Einzelnachweise
- Eintrag zu ISOSORBIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 30. Juni 2020.
- N.N., Isosorbide as sustainable diol from the C6 platform (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 1,6 MB), BioPerspectives 2005, BREW Symposium, Wiesbaden, May 11th 2005
- Datenblatt Isosorbid bei AlfaAesar, abgerufen am 20. Dezember 2012 (PDF) (JavaScript erforderlich).
- Eintrag zu Isosorbide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgefragt am 18. Dezember 2012
- Datenblatt Dianhydro-D-glucitol, 98% bei Sigma-Aldrich, abgerufen am 28. Januar 2013 (PDF).
- Datenblatt Isosorbide bei Acros, abgerufen am 6. Januar 2013.
- Patent US9120806: Dianhydrosugar production process. Veröffentlicht am 1. September 2015, Anmelder: Iowa Corn Promotion Board, Erfinder: David James Schreck, Marion McKinley Bradford, Nye Atwood Clinton, Paul Aubry.
- Patent US6670033: Process and products of purification of anhydrosugar alcohols. Veröffentlicht am 30. Dezember 2003, Anmelder: E.I. du Pont de Nemours and Company, Erfinder: Michael A. Hubbard, Michael Wohlers, Helmut B. Witteler, Edward G. Zey, George Kvakovszky, Thomas H. Shockley, Larry F. Charbonneau, Norbert Kohle, Jochen Rieth.
- Patent US6867296: Recovery and purification of anhydro sugar alcohols from a vapor stream. Veröffentlicht am 15. März 2005, Anmelder: E.I. du Pont de Nemours and Company, Erfinder: Kamlesh Kumar Bhatia.
- G. Flèche, M. Huchette: Isosorbide. Preparation, Properties and Chemistry. In: Starch – Stärke. Band 38, Nr. 1, 1986, S. 26–30, doi:10.1002/star.19860380107.
- merckmanuals.com: Angle-Closure Glaucoma
- M. Rose, R. Palkovits, Isosorbide as a Renewable Platform chemical for Versatile Applications – Quo Vadis?, In: ChemSusChem 2012, 5, 167–176 doi:10.1002/cssc.201100580.
- Remington: The Science and Practice of Pharmacy, 21st Edition, p. 1359, edit. D.B. Troy, Lippincott Williams & Wilkins, 2006, ISBN 0-7817-4673-6.
- Pharmakologie und Toxikologie: Für Studium und Praxis. Herausgegeben von Claus J. Estler, Harald Schmidt, Schattauer Verlag, 6. Aufl., 2007, ISBN 978-3-7945-2295-8.
- Patent WO2010115565: Isosorbide monoesters and their use in household applications. Veröffentlicht am 14. Oktober 2010, Anmelder: Cognis IP Management GmbH, Erfinder: C. Breffa et al..
- Patent DE102007028702: Verfahren zur Herstellung von Dianhydrohexitol-Diestern. Veröffentlicht am 24. Dezember 2008, Anmelder: Evonik Oxeno GmbH, Erfinder: M. Graß, M. Woelk-Faehrmann.
- Patent US2012220507: 2,5-Furan dicarboxylate derivatives, and use thereof as plasticizers. Angemeldet am 17. August 2010, veröffentlicht am 30. August 2012, Anmelder: Evonik Oxeno GmbH, Erfinder: M. Grass, H.G. Becker.
- Healthy Building Network, Phthalate-free plasticizers in PVC: PDF
- Grant Industries: About Dimethyl Isosorbide (Memento des Originals vom 7. September 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Patent US2010183913: Lithium cell with iron disulfide cathode and improved electrolyte. Veröffentlicht am 22. Juli 2010, Anmelder: The Procter & Gamble Co., Erfinder: M. Sliger et al..
- Patent US2010064574: Diesel cycle fuel compositions containing dianhydrohexitols and related products. Veröffentlicht am 18. März 2010, Anmelder: Petróleo Brasileiro S.A.-Petrobras, Erfinder: R.M. de Almeida, C.R. Klotz Rabello.
- Patent EP2574615: Verfahren zur Herstellung von Zucker(thio)phosphaten. Veröffentlicht am 3. April 2013, Anmelder: BASF SE, Erfinder: Ch. Fleckenstein, H. Denecke.
- J. Wagner: Halogenfreie Flammschutzmittelmischungen für Polystyrol-Schäume (PDF; 15,5 MB), Inauguraldissertation, Universität Heidelberg, Juni 2012.
- Patent US2010130759: Novel functional compounds with an isosorbide or isosorbide isomer core, production process and uses of these compounds. Veröffentlicht am 27. Mai 2010, Anmelder: Arkema Inc., Erfinder: J.-P. Gillet.
- Patent WO2006032022: Processes for making low color poly(ethylene-co-isosorbide) terephthalate polymer. Veröffentlicht am 3. August 2006, Anmelder: E.I. du Pont de Nemours and Company, Erfinder: L. Charbonneau.
- J.C. Bersot, et al.: Efficiency Increase of Poly (ethylene terephthalate‐co‐isosorbide terephthalate) Synthesis using Bimetallic Catalytic Systems. In: Macromol. Chem. Phys.. 212, Nr. 19, 2011, S. 2114–2120. doi:10.1002/macp.201100146.
- M.A. Hani et al.: Polycondensation of isosorbide and various diols by means of diphosgene characterization by a combination of MALDI and NMR (PDF; 1,7 MB), Recent Res. Devel. Organic Chem., 11(2007):1–11, ISBN 978-81-7895-294-9
- Patent US2011077377: Method of making isosorbide polycarbonates. Veröffentlicht am 31. März 2011, Anmelder: Sabic Innovative Plastics IP BV, Erfinder: H.-P. Brack et al..
- Patent US2011160422: Isosorbide-based polycarbonates, method for making, and articles formed therefrom. Veröffentlicht am 30. Juni 2011, Anmelder: Sabic Innovative Plastics IP BV, Erfinder: J.H. Kamps et al..
- PCT-Patent WO 2012/163845 Fibre composite component and a process for the production thereof, Erfinder: S. Lindner et al., Anmelder: Bayer IP GmbH, veröffentlicht am 6. Dezember 2012
- X. Feng et al., Sugar-Based Chemicals for Environmentally Sustainable Applications, in Contemporary Science of Polymeric Materials, ACS Symposium Series, Vol. 1061, Chapter 1, pp 3–27, ISBN 978-0-8412-2602-9
- Frank Bachmann, Joachim Reimer, Marcus Ruppenstein, Joachim Thiem: Synthesis of Novel Polyurethanes and Polyureas by Polyaddition Reactions of Dianhydrohexitol Configurated Diisocyanates. In: Macromolecular Chemistry and Physics. Band 202, Nr. 17, 2001, S. 3410–3419, doi:10.1002/1521-3935(20011101)202:17<3410::AID-MACP3410>3.0.CO;2-Q.
- Patent US2011015366: Novel chain extenders for polyurethane elastomer formulations. Veröffentlicht am 20. Januar 2011, Erfinder: G. da Costa et al..
- Patent US7619056: Thermoset epoxy polymers from renewable resources. Veröffentlicht am 17. November 2009, Anmelder: New Jersey Institute of Technology, Erfinder: A.J. East et al..
- Press Release NEWARK, Feb 24 2010: NJIT Patent May Be Able To Replace BPA; Make Consumer Products Safer
- Patent US2010298520: Polyoxazolidones derived from dianhydrohexitols. Veröffentlicht am 25. November 2010, Anmelder: New Jersey Institute of Technology, Erfinder: A.J. East et al..
- AGRICULTURE Project Fact Sheet: New continuous isosorbide production from sorbitol (PDF; 314 kB), Iowa Corn Promotion Board, September 2001
- Datenblatt D-Glucose (PDF) bei Carl Roth, abgerufen am 24. August 2010.
- X. Feng et al., Thermal analysis characterization of isosorbide-containing thermosets, Isosorbide epoxy as BPA replacement for thermosets industry J. Therm. Anal. Calorim., 109, 1267–1275 (2012), doi:10.1007/s10973-012-2581-2