Lactid
Lactid ist der cyclische Diester der Milchsäure und findet als Ausgangsstoff bei der technischen Herstellung von Polylactiden (Polymilchsäuren) Verwendung. Im Unterschied dazu sind Lactide (Plural) als Gattungsbegriff cyclische Diester von α-Hydroxycarbonsäuren (Milchsäure, α-Hydroxybuttersäure, Mandelsäure etc.).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
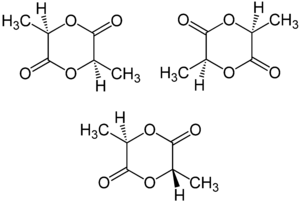 | |||||||||||||||||||
| (R,R)-Lactid (links oben), (S,S)-Lactid (rechts oben) und meso-Lactid (unten) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lactid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C6H8O4 | ||||||||||||||||||
| Kurzbeschreibung |
Farb- und geruchlose Kristalle[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 144,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung
Lactid kann durch säurekatalytische Kondensation von Milchsäure hergestellt werden. Technisch wird es heutzutage aber meist biotechnologisch aus Glucose und Melasse gewonnen.
Isomerie
Da Lactid zwei durch jeweils analoge Reste substituierte Stereozentren enthält, gibt es drei isomere Lactide:
- (S,S)-Lactid,
- (R,R)-Lactid und
- meso-Lactid.
Das Lactid der natürlichen L-Milchsäure [Synonym: (S)-Milchsäure] besitzt (S,S)-Konfiguration. (R,R)-Lactid und meso-Lactid besitzen im Vergleich zu (S,S)-Lactid nur geringe Bedeutung.
Eigenschaften
Lactid ist ein farbloses, geruchloses Pulver, das bei Berührung mit Wasser sofort zu Milchsäure hydrolysiert.
Verwendung
Aus dem Lactid [genauer: dem (S,S)-Lactid] der L-Milchsäure wird durch ionische Polymerisation Polylactid hergestellt. Außerdem wird es im polymerisierten Zustand als biologisch abbaubares Nahtmaterial in Operationen verwendet (selbstauflösende Fäden).
Die Hydrierung von L-Lactid liefert (S)-(+)-1,2-Propandiol.[6]
Einzelnachweise
- Eintrag zu LACTIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 6. März 2020.
- Eintrag zu Lactid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Mai 2014.
- A. Auras, Loong-Tak Lim, Susan E. M. Selke, Hideto Tsuji, Poly(lactic acid): Synthesis, Structures, Properties, Processing, and Applications, S. 11, John Wiley & Sons 2011
- guidechem.com: 1,4-Dioxane-2,5-dione,3,6-dimethyl-, (3R,6S)-rel-, abgerufen am 7. Februar 2018.
- Eintrag zu Dilactid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Ekambaram Balaraman, Eran Fogler und David Milstein: Efficient hydrogenation of biomass-derived cyclic di-esters to 1,2-diols, Chem. Commun. 48 (2012) 1111–1113.
