α-Angelicalacton
α-Angelicalacton ist ein bei der trockenen Destillation (Thermolyse) der Plattformchemikalie Lävulinsäure entstehendes ungesättigtes alkyliertes γ-Lacton, das als Aromastoff und Duftstoff, als chemisches Zwischenprodukt und in Versuchen zur Enzyminduktion von Glutathion-S-Transferasen Verwendung findet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | α-Angelicalacton | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C5H6O2 | |||||||||||||||
| Kurzbeschreibung |
weiße, nadelige Kristalle[2] bzw. klare farblose[3] bis hellgelbe[4] Flüssigkeit | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 98,10 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck |
52,3 Pa (25 °C)[7] | |||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,446–1,449 (20 °C, 589 nm)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vorkommen und Darstellung
α-Angelicalacton wird in der Natur in Mandeln, Kaffee, Rosinen, Cranberries, Kokosnüssen, Sojabohnen, sowie in Weißbrot und Lakritz gefunden.[8]
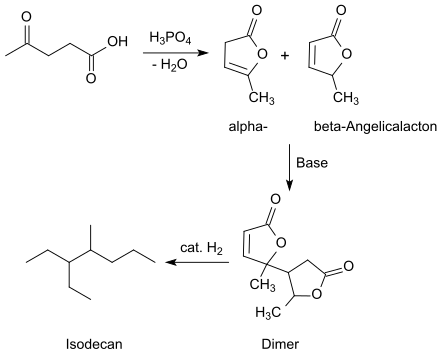
Die bereits 1883 von Ludwig Wolff beobachtete[9] und 1885 ausführlich berichtete chemische Synthese erfolgt durch langsame Destillation von Lävulinsäure unter Normaldruck[6] oder durch Vakuumdestillation von Lävulinsäure bei Temperaturen von 150 bis 175 °C unter Wasserabspaltung zu α-Angelicalacton in 90%iger Ausbeute, wobei weniger als 5 % des β-Isomeres (Sdp. 205–208 °C[6]) gebildet werden.[10] Die endotherme und säurekatalysierte Reaktion verläuft über die intermediär entstehende so genannte Pseudolävulinsäure[11] und liefert neben geringen Mengen des β-Isomeres fast ausschließlich α-Angelicalacton.[12]
Destillation von Lävulinsäure in Gegenwart von konzentrierter Phosphorsäure im Vakuum liefert mit 95 % die höchste Ausbeute an α-Angelicalacton.[13]
Die Konstitution der α- und β-Isomere des Angelicalactons wurden von J. Thiele bereits 1901 nachgewiesen.[14] Größere Anteile des β-Isomers können bei der Thermolyse von Lävulinsäure bei höheren Temperaturen erzeugt werden.[6]
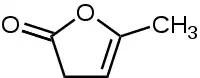
Ein auch als α'-Angelicalacton (γ-Methylen-γ-valerolacton) mit exocyclischer Doppelbindung bezeichnetes Isomer des α-Angelicalactons ist aus 4-Pentinsäure mit Quecksilber(II)-acetat in Methylenchlorid in 74%iger Ausbeute zugänglich.[15]
Eigenschaften
Das frisch destillierte α-Angelicalacton liegt als wasserklare Flüssigkeit vor, die sich nach einigen Tagen bei Raumtemperatur gelb färbt.[6] Der bei Abkühlung als lange Nadeln auskristallisierende Feststoff sublimiert bei Raumtemperatur.[6] Geruch und Geschmack des α-Angelicalactons werden als süß, ölig, (kokos)nussig, coumarin- und tabakartig beschrieben.[8]
Das Lacton löst sich wenig in Wasser, ist aber gut löslich in vielen organischen Lösungsmitteln. α-Angelicalacton isomerisiert leicht in das β-Isomere, das wegen seiner konjugierten Doppelbindungen eine wenig höhere Stabilität besitzt.[16][12]
Als ungesättigtes Dihydrofuranon addiert α-Angelicalacton Brom zum entsprechenden Dibrom-γ-valerolacton oder Chlorwasserstoff zum Monochlor-γ-valerolacton.[6]
Verwendung
Hydrierung zu γ-Valerolacton und 2-Methyltetrahydrofuran
Hydrierung von α-Angelicalacton an einem Kupferchromit-Kontakt bei 150 °C[13] oder in ionischen Flüssigkeiten, wie z. B. 1-Butyl-3-methylimidazolium-hexafluorophosphat ([Bmim]PF6) mit einem Palladium auf Kohlenstoff-(Pd/C)-Katalysator bei Raumtemperatur[17] liefert bei vollständiger Umsetzung mit fast 100%iger Selektivität γ-Valerolacton, ebenso wie die lösemittelfreie Hydrierung in einem Ruthenium auf Kohlenstoff- (Ru/C)-Katalysator bei Normaldruck, die in einer Eintopfreaktion unter Wasserabspaltung zu 2-Methyltetrahydrofuran (2-MTHF) weitergeführt werden kann.[18]

Sowohl γ-Valerolacton[19] als auch 2-MTHF[19][20] werden neuerdings als alternative biogene Kraftstoffe oder Kraftstoffadditive bzw. als Lösungsmittel[21] diskutiert.
Die Hydrierung von α-Angelicalacton bei hohen Temperaturen (240 °C) an Kupferchromit erzeugt 1,4-Pentandiol.[13]
Lävulinsäureester durch Ringöffnung
Aus α-Angelicalacton lassen sich mit Alkoholen unter Ringöffnung und Katalyse mit sauren Ionenaustauschern, wie z. B. sulfoniertem Polystyrol (Amberlyst 15) oder sulfonierten Polytetrafluorethylen (Nafion) Ester der Lävulinsäure darstellen.[22]
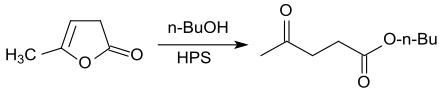
Statt der Ionenaustauscherharze lassen sich auch unlösliche und daher leicht abtrennbare, cholinmodifizierte Polyoxometallate (Heteropolysäuren) einsetzen.[23] Auch die Ester der Lävulinsäure finden neuerdings als alternative biogene Kraftstoffe oder Kraftstoffadditive Interesse.
Amidierung und Decarbonylierung
Durch Umsetzung von α-Angelicalacton mit primären Aminen in wässrigem Medium und anschließender Hydrierung sind 5-Methyl-N-alkyl-2-pyrrolidone zugänglich.
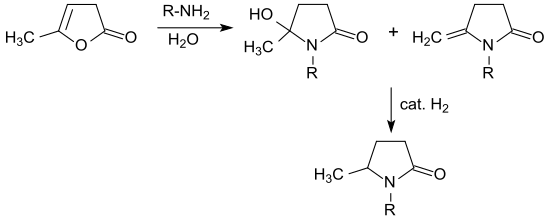
Bei der Reaktion mit Methylamin entsteht auf der ersten Stufe 5-Hydroxy-1,5-dimethyl-2-pyrrolidon, aus dem unter Wasserabspaltung 5-Methylen-N-alkyl-2-pyrrolidon[24] entsteht, das zum gesättigten Pyrrolidon hydriert wird. Wie das überwiegend aus fossilen Rohstoffen industriell hergestellte N-Methylpyrrolidon eignet sich 5-Methyl-N-methylpyrrolidon als aprotisch dipolares Lösungsmittel für eine Vielzahl technischer Anwendungen.
Decarbonylierung von α-Angelicalacton bei 130–250 °C in Gegenwart saurer Silikat-Katalysatoren liefert den vielseitigen Molekülbaustein (engl. building block) – z. B. für Vitamin A – Methylvinylketon, der zu dem wichtigen Keton Butanon hydriert werden kann.[12]
Dimere des α-Angelicalactons
Bei Erhitzen von α-Angelicalacton im Alkalischen, z. B. mit Triethylamin, Kaliumhydroxid[25] oder mit wasserfreiem Kaliumcarbonat entstehen fast quantitativ (94 %) Dimere des Angelicalactons,[26] die in hoher Ausbeute (88 %) zu verzweigten, als Benzinersatz diskutierten C7- bis C10-Alkanen hydriert werden können.[27]
Polymere mit α-Angelicalacton
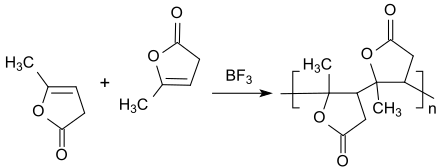
Das ungesättigte Lacton α-Angelicalacton kann als disubstituiertes Vinylacetat betrachtet werden, das mit starken Lewis-Säuren, wie z. B. Bortrifluoriddiethyletherat, oder durch lange UV-Bestrahlung an der (wenig reaktiven) Doppelbindung zu klebrigen, dunkelrot gefärbten Oligomeren (n = 8–9) polymerisiert werden kann.[28][29]
Mit Polymerisationsinitiatoren für die radikalische Polymerisation, wie z. B. Benzoylperoxid oder Acetonperoxid lässt sich α-Angelicalacton nicht polymerisieren.[29]
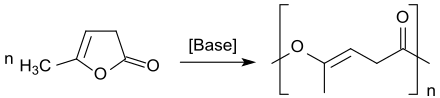
Wie andere Lactone, z. B. Caprolacton, kann α-Angelicalacton unter Ringöffnung mit basischen Katalysatoren, wie z. B. Natriumhydroxid oder Kalium-tert-butanolat, zu niedrigmolekularen (MW bis 20k) homopolymeren Polylactonen polymerisiert werden.[29][30] Die Polymeren sind innerhalb 180 Tagen im Boden bioabbaubar.
Relativ gut bioabbaubare Copolymere von α-Angelicalacton mit Styrol, Caprolactam oder Methylmethacrylat mit brauchbaren Molmassen und mechanischen Eigenschaften sind ebenfalls beschrieben.[31]
Physiologische Effekte des α-Angelicalactons
Wegen seiner geschmacklichen und olfaktorischen Eigenschaften wird α-Angelicalacton als Aroma- und Duftstoff in der Lebensmittelindustrie eingesetzt. In den USA ist α-Angelicalacton als Lebensmittelzusatzstoff GRAS (englisch generally recognized as safe) zertifiziert.[8]
In mehreren Tierstudien wurde ein tumorhemmender Effekt von α-Angelicalacton durch Steigerung der Aktivität des entgiftenden Enzyms Glutathion-S-Transferase[32][33] und UDP-Glucuronosyltransferase[34] gefunden.
Einzelnachweise
- Eintrag zu 5-METHYLFURANONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. Januar 2022.
- G.A. Burdock: Fenaroli’s Handbook of Flavor Ingredients, 6th Edition. CRC Press, Boca Raton, FL 2010, ISBN 978-1-4200-9077-2, S. 101.
- Datenblatt alpha-Angelica lactone bei AlfaAesar, abgerufen am 15. April 2017 (PDF) (JavaScript erforderlich).
- Eintrag zu α-Angelicalacton bei TCI Europe, abgerufen am 15. April 2017.
- Datenblatt α-Angelica lactone bei Sigma-Aldrich, abgerufen am 15. April 2017 (PDF).
- L. Wolff: Ueber einige Abkömmlinge der Lävulinsäure. In: Justus Liebigs Ann. Chem. Band 229, Nr. 3, 1885, S. 249–285, doi:10.1002/jlac.18852290302.
- ANGELICA LACTONE ALPHA. (PDF; 83 kB) In: takasago.com. Takasago International Corp., abgerufen am 15. April 2017 (englisch).
- alpha-angelica lactone. In: thegoodscentcompany.com. The Good Scent Co., abgerufen am 3. April 2017 (englisch).
- S. Young: Ueber ein neues Hepto- und Octolacton. In: Justus Liebigs Ann. Chem. Band 216, Nr. 1–2, 1883, S. 52, doi:10.1002/jlac.18832160106.
- Patent US2809203: Method of converting levulinic acid into alpha angelica lactone. Angemeldet am 14. Mai 1953, veröffentlicht am 8. Oktober 1957, Anmelder: Heyden Newport Chemical Corp., Erfinder: R.H. Leonard.
- R.H. Leonard: Levulinic acid as a basic chemical raw material. In: Ind. Eng. Chem. Band 48, Nr. 8, 1956, S. 1330–1341, doi:10.1021/ie50560a033.
- Patent US7960592B2: Production of methyl-vinyl ketone from levulinic acid. Angemeldet am 12. Januar 2010, veröffentlicht am 14. Juni 2011, Anmelder: Wisconsin Alumni Research Foundation, Erfinder: J.A. Dumesic, R.M. West.
- J.H. Helberger, S. Ulubay, H. Civelekoglu: Ein einfaches Verfahren zur Gewinnung von α-Angelicalacton und über die hydrierende Spaltung sauerstoffhaltiger Ringe. In: Justus Liebigs Ann. Chem. Band 561, Nr. 3, 1949, S. 215–220, doi:10.1002/jlac.19495610307.
- J.Thiele, R. Tischbein, E. Lossow: Ueber die Angelicalactone. In: Justus Liebigs Ann. Chem. Band 319, Nr. 2, 1901, S. 180–195, doi:10.1002/jlac.19013190205.
- R.A. Amos, J.A. Katzenellenbogen: An efficient synthesis of .gamma.-methylene-.gamma.-butyrolactone (.alpha.'-angelicalactone). Application to the synthesis of deoxyobtusilactone and deoxyisoobtusilactone. In: J. Org. Chem. Band 43, Nr. 4, 1978, S. 560–564, doi:10.1021/jo00398a007.
- Patent US2761869: Method of converting alpha angelica lactone into beta angelica lactone. Angemeldet am 14. Mai 1953, veröffentlicht am 4. September 1956, Anmelder: Newport Industries, Inc., Erfinder: R.H. Leonard.
- R. Cao et al.: Efficient conversion of α-angelica lactone into γ-valerolactone with ionic liquids at room temperature. In: ACS Sust. Chem.&Eng. Band 2, Nr. 4, 2014, S. 902–909, doi:10.1021/sc4005185.
- M.G. Al-Shaal, P.J.C. Hausoul, R. Palkovits: Efficient, solvent-free hydrogenation of α-angelica lactone catalyzed by Ru/C at atmospheric pressure and room temperature. In: Chem. Commun. Band 50, Nr. 71, 2014, S. 10206–10209, doi:10.1039/c4cc03970j.
- D.M. Alonso, S.G. Wettstein, J.A. Dumesic: Gamma-valerolactone, a sustainable platform molecule derived from lignocellulosic biomass. In: Green Chem. Band 15, 2013, S. 584–595, doi:10.1039/C3GC37065H.
- M.J. Climent, A. Corma, S. Iborra: Conversion of biomass platform molecules into fuel additives and liquid hydrocarbon fuel. In: Green Chem. Band 16, 2014, S. 516–547, doi:10.1039/C3GC41492B.
- V. Pace, P. Hoyos, L. Castoldi, P. Domínguez de María, A.R. Alcántara: 2-Methyltetrahydrofuran (2-MeTHF): A biomass-derived solvent with broad application in organic chemistry. In: Chemsuschem. Band 5, Nr. 8, 2012, S. 1369–1379, doi:10.1002/cssc.201100780.
- Patent US20060063948A1: Preparation of levulinic acid esters from alpha-angelica lactone and alcohols. Angemeldet am 23. März 2005, veröffentlicht am 23. März 2006, Anmelder: E.I. Du Pont de Nemours and Co., Erfinder: L.E. Manzer.
- X. Yi et al.: Synthesis of butyl levulinate based on α-angelica lactone in the presence of easily separable heteropoly acid catalysts. In: Chemsuschem. Band 10, Nr. 7, 2017, S. 1494–1500, doi:10.1002/cssc.201601882.
- C. Wedler, B. Costisella, H. Schick: Reactions of 4-oxoalkanoic acids. III. Synthesis of 5-methyl- and 5-methylenepyrrolidin-2-ones by reaction of α-angelica lactone with methylamine. In: J. prakt. Chem. Band 332, Nr. 4, 1990, S. 557–562, doi:10.1002/prac.19903320422.
- Patent US2493373: Dimers of angelica lactone. Angemeldet am 31. Juli 1946, veröffentlicht am 3. Januar 1950, Anmelder: A.E. Staley Manufacturing Co., Erfinder: H. Wolff, W.W. Moyer.
- B. Lu et al.: Obtaining a high value branched bio-alkane from biomass-derived levulinic acid using RANEY® as hydrogenation catalyst. In: RSC Adv. Band 96, Nr. 6, 2016, S. 93956–93962, doi:10.1039/C6RA14625B.
- M. Mascal, S. Dutta, I. Gandarias: Hydrodeoxygenation of the angelica lactone dimer, a cellulose-based feedstock: simple, high-yield synthesis of branched C7 – C10 gasoline-like hydrocarbons. In: Angew. Chem. Band 126, Nr. 7, 2014, S. 1885–1888, doi:10.1002/ange.201308143.
- C.S. Marvel, C.L. Levesque: The structure of vinyl polymers. III. The polymer from α-angelica lactone. In: J. Am. Chem. Soc. Band 61, Nr. 7, 1939, S. 1682–1684, doi:10.1021/ja01876a013.
- V.E. Tarabanko, K.L. Kaygorodov: New biodegradable polymers based on α-angelica lactone. In: Chem. Sus. Dev. Band 18, 2010, S. 321–328 (sibran.ru [PDF]).
- T. Chen et al.: Degradable polymers from ring-opening polymerization of α-angelica lactone, a five-membered unsaturated lactone. In: Polym. Chem. Band 5, Nr. 2, 2011, S. 1190–1194, doi:10.1039/C1PY00067E.
- V.E. Tarabanko, K.L. Kaygorodov: New environmentally benign polymers produced by copolymerization with α-angelica lactone. In: Macromol. Symp. Band 354, Nr. 1, 2015, S. 367–373, doi:10.1002/masy.201400108.
- W.A. Nijhoff, G.M. Groen, W.H.M. Peters: Induction of rat hepatic and intestinal glutathione-S-transferases and glutathione by dietary naturally-occuring anticarcinogens. In: Int. J. Oncol. Band 3, Nr. 6, 1993, S. 1131–1139, doi:10.3892/ijo.3.6.1131.
- W.A. Nijhoff, M.A. Bosboom, M.H. Smidt, W.H.M. Peters: Enhancement of rat hepatic and gastrointestinal glutathione and glutathione-S-transferases by α-angelicalactone and flavone. In: Carcinogenesis. Band 16, Nr. 3, 1995, S. 607–612, doi:10.1093/carcin/16.3.607.
- E.M.J. van der Logt, H.M.J. Roelofs, F.M. Nagengast, W.H.M. Peters: Induction of rat hepatic and intestinal UDP-glucuronosyltransferases by naturally occurring dietary anticarcinogens. In: Carcinogenesis. Band 24, Nr. 10, 2003, S. 1651–1656, doi:10.1093/carcin/bggl17.