Phosphotransferasesystem
Das Phosphotransferasesystem (PTS), genauer Phosphoenolpyruvat-Phosphotransferasesystem (PEP-PTS) ist ein aktives Stofftransportsystem von Mikroorganismen, das über Gruppentranslokation arbeitet. Bislang wurde es nur bei Bakterien nachgewiesen.[1]
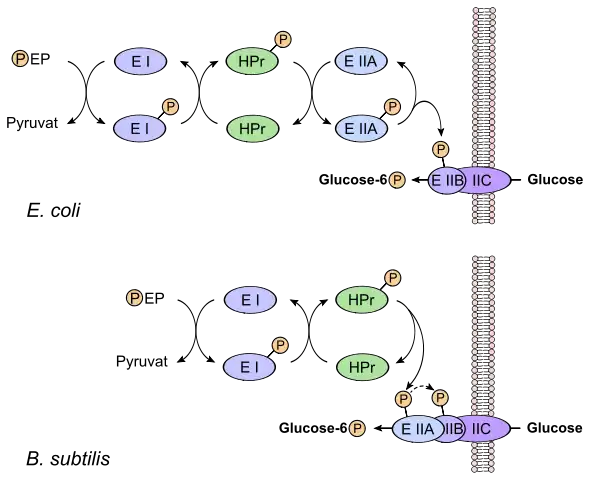
Hierbei wird der hochenergetische Phosphatrest von Phosphoenolpyruvat (PEP) über mehrere Proteinkinasen (Signaltransduktion) zunächst auf die „Vermittlerproteine“ und schließlich auf das Substrat, meist Hexosen (Glucose, Mannose, Fructose) oder Zuckeralkohole (z. B. Glucitol, Mannitol) übertragen. Das Substrat wird durch Membranproteine (Translokasen, die energieunabhängig agieren und daher nur ein Gleichgewicht einstellen) ins Cytoplasma eingeschleust, wo es dann schließlich phosphoryliert vorliegt. Dadurch wird das Substratmolekül dem Gleichgewicht entzogen, denn der Transporter kann nur unphosphorylierte Moleküle binden und translozieren. Aus diesem Grund kann die Zelle die Substrate gegen den Konzentrationsgradienten in die Zelle pumpen. PEP liefert dafür die Energie, es wird dabei zu Pyruvat umgewandelt.
Ablauf
Der erste Reaktionsschritt besteht hierbei aus der Übertragung des Phosphatrests von PEP auf das unspezifische Enzym I (EI) durch Selbstphosphorylisierung, welches anschließend ein Histidin-haltiges Protein (HPr) an seinem Histidinrest phosphoryliert. EI und HPr sind entweder konstitutiv exprimiert oder teilweise induzierbar und befinden sich an den Zellpolen.[2] Erst die nun folgenden Übertragungsschritte auf den Enzymkomplex Enzym II (EII) sind substratspezifisch. Dieser ist aus mindestens drei Domänen (A bis C) aufgebaut, welche systemabhängig zu einem Komplex fusionieren oder separat im Cytoplasma der Zelle vorliegen können. Das eigentliche Transportprotein ist hierbei das Enzym II C, welches in die Membran integriert ist. Enzym IIB ist die einzige Komponente dieses Systems, die an einem Cysteinrest phosphoryliert wird; alle anderen Komponenten erfahren eine Übertragung auf einen Histidinrest. EII befinden sich an der Zellperipherie und werden durch die Anwesenheit des entsprechenden Zuckers exprimiert.[2] Zur Unterscheidung des Substrates verwendet man entsprechende dreibuchstabige Abkürzungen als hochgestellten Index; so bezeichnet man die glucosespezifische EIIA-Komponente EIIAGlc, eine manitolspezifische EIIC-Komponente dagegen EIICMtl.
Das PTS ist ebenfalls an der Regulation der Stoffwechselwege beteiligt. Da viele chemoheterotrophe Bakterien Glucose als bevorzugte Kohlenstoffquelle nutzen, werden bei deren Verfügbarkeit Stoffwechselwege zur Verwertung anderer Zucker auf Transkriptionsebene abgeschaltet (Katabolitrepression). Das E IIA-Protein für den Glucosetransport aus Escherichia coli aktiviert in seiner phosphorylierten Form die Adenylatcyclase, welche cAMP synthetisiert. cAMP wirkt mit seinem Rezeptorprotein CRP als Transkriptionsaktivator für die Expression von Genen deren Produkte die Aufnahme alternativer Kohlenstoffquellen ermöglichen.
In seiner dephosphorylierten Form inhibiert E IIA zudem Transporter für die Aufnahme anderer Zucker.
Substrate
Das PEP-PTS akzeptiert Keto- und Aldohexosen, Di- und Trisaccharide, Zuckeralkohole, Aminozucker, Gluconsäuren, Glucoseaminat, Glucoselysin und Fructoselysin.[2] Diese Substrate bezeichnet man auch als PTS-Zucker.
Dagegen werden nicht-PTS-Zucker u. a. durch Permeasen oder ABC-Transporter in die Zelle gebracht, wie z. B. Glycerin, Glucuronat oder D-Arabinose.
Literatur
- Anne Galinier, Josef Deutscher: Sophisticated Regulation of Transcriptional Factors by the Bacterial Phosphoenolpyruvate: Sugar Phosphotransferase System. In: Journal of Molecular Biology. Band 429, Nr. 6, 24. März 2017, S. 773–789, doi:10.1016/j.jmb.2017.02.006.
- Milton H. Saier: The Bacterial Phosphotransferase System: New Frontiers 50 Years after Its Discovery. In: Journal of Molecular Microbiology and Biotechnology. Band 25, Nr. 2-3, 2015, S. 73–78, doi:10.1159/000381215, PMID 26159069, PMC 4512285 (freier Volltext).
- J. Deutscher, C. Francke, P. W. Postma: How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria. In: Microbiol Mol Biol Rev. Band 70, Nr. 4, 2006, S. 939–1031. PMID 17158705; PDF (freier Volltextzugriff, engl.)
- C. Siebold, K. Flükiger, R. Beutler, B. Erni: Carbohydrate transporters of the bacterial phosphoenolpyruvate: sugar phosphotransferase system (PTS). In: FEBS Lett. Band 504, Nr. 3, 2001, S. 104–111. PMID 11532441; doi:10.1016/S0014-5793(01)02705-3.
Einzelnachweise
- 4.A: Phosphotransfer-driven group translocators. In: TCDB. Saier Lab Bioinformatics, abgerufen am 16. September 2010 (englisch).
- Anne Galinier, Josef Deutscher: Sophisticated Regulation of Transcriptional Factors by the Bacterial Phosphoenolpyruvate: Sugar Phosphotransferase System. In: Journal of Molecular Biology. Band 429, Nr. 6, 24. März 2017, S. 773–789, doi:10.1016/j.jmb.2017.02.006.