Wolfram(VI)-fluorid
Wolfram(VI)-fluorid (WF6), häufig auch Wolframhexafluorid, ist eine farblose, gasförmige Verbindung der Elemente Wolfram und Fluor und gehört zur Stoffgruppe der Hexafluoride. Es ist das dichteste bekannte Gas unter Standardbedingungen. An feuchter Luft raucht es aufgrund von Hydrolyse und besitzt einen stechenden Geruch. Es wird am häufigsten bei der Herstellung von Halbleiterschaltungen und Leiterplatten im Prozess der chemischen Gasphasenabscheidung verwendet; bei seiner Zersetzung verbleibt ein Rückstand von metallischem Wolfram.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Wolfram(VI)-fluorid | |||||||||||||||
| Andere Namen |
Wolframhexafluorid | |||||||||||||||
| Summenformel | WF6 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 297,84 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
17,1 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
1 mg·m−3[1] | |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Wolframhexafluorid wird durch Umsetzung von Wolfram im Fluorstrom bei Temperaturen zwischen 350 und 400 °C erhalten:[4][5]
Das gasförmige Produkt wird kondensiert und von WOF4-Verunreinigungen durch Destillation abgetrennt.[6]
Anstelle von Fluorgas kann auch Chlorfluorid (ClF), Chlortrifluorid (ClF3) oder Bromtrifluorid (BrF3) eingesetzt werden. Ein alternatives Verfahren zur Herstellung von Wolframhexafluorid ist die Umsetzung von Wolframtrioxid (WO3) mit Fluorwasserstoff (HF), BrF3 oder Schwefeltetrafluorid (SF4). Wolframhexafluorid kann auch durch Umwandlung von Wolframhexachlorid (WCl6) erhalten werden:[7]
Aufgrund der chemischen Ähnlichkeit von Molybdän und Wolfram ist als Verunreinigung Molybdänhexafluorid enthalten. Dieses kann durch Reduktion eines WF6-MoF6-Gemisches mit einem beliebigen Element, einschließlich Molybdän, bei mäßig erhöhter Temperatur entfernt werden.[8][9]
Eigenschaften
Physikalische Eigenschaften
Bei Normaldruck und Temperaturen über 17,1 °C ist Wolframhexafluorid ein farbloses diamagnetisches Gas.[7] Im Temperaturbereich von 2,3 bis 17,1 °C ist es eine blassgelbe Flüssigkeit mit einer Dichte von 3,44 g/cm3 bei 15 °C.[7][10]
Bei 2,3 °C gefriert es zu einem weißen Feststoff im kubischen Kristallsystem mit dem Gitterparameter a = 628 pm und zwei Formeleinheiten pro Elementarzelle mit einer berechneten Dichte von 3,99 g·cm−3. Bei −9 °C ist ein Festphasenübergang zu beobachten. Unterhalb dieser Temperatur kristallisiert es im orthorhombischen Kristallsystem in der Raumgruppe Pnma (Raumgruppen-Nr. 62) und vier Formeleinheiten pro Elementarzelle mit einer berechneten Dichte von 4,56 g·cm−3.[2] Die Fluoratome nehmen dabei die hexagonal dichteste Kugelpackung ein.[11]
Temperaturbereich Kristallsystem a [pm] b [pm] c [pm] Dichte (g·cm−3) −9 °C … 2,3 °C[7] kubisch 628 3,99 < −9 °C[2] orthorhombisch 960,3 871,3 504,4 4,56 −140 °C[12] orthorhombisch 946,6 860,8 499,8 4,86
Mit einer außergewöhnlich hohen Dichte von etwa 12,4 g/l[1], etwa 10,3 mal dichter als Luft[1] und etwa halb so groß wie die von Schaumpolystyrol, ist WF6 der schwerste bekannte gasförmige Stoff (Dichte des schwersten elementaren Gases Radon: 9,73 g/l). Die Dichte im festen oder flüssigen Zustand liegt dagegen im für kovalente oder ionische Schwermetallverbindungen typischen Bereich.[13]
Der kritische Punkt liegt bei 179,6 °C, 45,7 bar und 1,28 kg/l; der Tripelpunkt bei 2,4 °C und 0,5597 bar.[1]
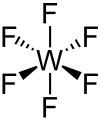
Das WF6-Molekül ist oktaedrisch (Oh); die W–F-Bindungslänge beträgt 182,6 pm.[12] Diese hohe Symmetrie ist in den meisten verwandten Verbindungen zu beobachten. Es ist jedoch festzustellen, dass Wolframhexahydrid (WH6) und Hexamethylwolfram (W(CH3)6) eine trigonal prismatische Struktur einnehmen.[14][15]
Chemische Eigenschaften
Wolframhexafluorid ist sehr giftig und ätzend, da es bei Kontakt mit Wasser unter heftiger Reaktion Fluorwasserstoffsäure bildet. Dabei entstehen Wolframoxyfluoride oder Wolframsäure:[7]
Die hohe Hydrolyseneigung im Gegensatz zu dem auf den ersten Blick ähnlich aufgebauten Schwefelhexafluorid lässt sich durch den deutlich größeren kovalenten Radius des zentralen Wolframatoms erklären, das dadurch weniger sterisch gehindert ist.
Verwendung
In der Halbleiterindustrie
Wolframhexafluorid wird im Prozess der Chemischen Gasphasenabscheidung in der Herstellung von Halbleitern eingesetzt.[16] Bei der Zersetzung der WF6-Moleküle verbleibt ein Rückstand von metallischem Wolfram. Diese Schicht dient als low-resistive metallic interconnect.
Der Ausbau der Halbleiterindustrie in den 1980er- und 1990er-Jahren führte zu einer Zunahme des Verbrauchs an WF6, der bei rund 200 Tonnen pro Jahr weltweit liegt. Wolframmetall ist attraktiv wegen seiner relativ hohen thermischen und chemischen Stabilität sowie niedrigem spezifischen Widerstand (5,6 μΩ·cm) und geringer Elektromigration. Die Verwendung von WF6 ist gegenüber seinen verwandten Verbindungen (wie WCl6 oder WBr6) günstiger, aufgrund seines höheren Dampfdrucks führt es zu höheren Abscheidungsraten. Seit 1967 wurden zwei Abscheidungsverfahren entwickelt, thermische Zersetzung und Reduktion mit Wasserstoff.[17] Die erforderliche WF6-Gasreinheit ist recht hoch und bewegt sich zwischen 99,98 % und 99,9995 % je nach Anwendung.[7]
Andere Verwendungen
Als ein schweres Gas kann WF6 als Puffer verwendet werden, um Gasreaktionen zu kontrollieren. So verlangsamt es beispielsweise die Chemie der Ar/O2/H2-Flamme und reduziert deren Temperatur.[18]
Sicherheitshinweise
Wolframhexafluorid ist eine sehr aggressive Substanz, die jedes Gewebe angreift. Beim Kontakt des Gases mit Körperflüssigkeiten bildet sich Flusssäure, die auf der Haut und den Schleimhäuten der Atemwege brennt. Die Exposition des Menschen gegenüber dem Gas wirkt sich zunächst auf die Augen und Atemwege aus und verursacht Reizungen, Verlust des Sehvermögens, Husten und übermäßige Bildung von Speichel und Auswurf. Nach längerer Exposition führt dies zu Pneumonitis und Lungenödemen mit möglicher Todesfolge. Aufgrund dieser Eigenschaften werden Lagerbehälter mit Teflondichtungen versehen.[19]
Einzelnachweise
- Eintrag zu Wolframhexafluorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Stanley Siegel, David A. Northrop: "X-Ray Diffraction Studies of Some Transition Metal Hexafluorides", in: Inorg. Chem., 1966, 5 (12), S. 2187–2188; doi:10.1021/ic50046a025.
- Johann Schröder, Franz Josef Sieben: "Bildungsenthalpie von Wolframhexafluorid und Wolframpentafluorid", in: Chemische Berichte, 1969, 103 (1), S. 76–81; doi:10.1002/cber.19701030113.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry, 2nd ed., Vol. 1, Academic Press 1963, S. 260–261.
- Homer F. Priest, Carl F. Swinehert: "Anhydrous Metal Fluorides", in: Inorganic Syntheses, Band 3, S. 171–183, 1950, Wiley-Interscience, ISBN 978-0-470-13162-6; doi:10.1002/9780470132340.ch47.
- Patent US6544889: Method for tungsten chemical vapor deposition on a semiconductor substrate. Veröffentlicht am 8. April 2003, Erfinder: Hans Vercamnen, Joris Baele.
- Erik Lassner, Wolf-Dieter Schubert: "Tungsten: Properties, Chemistry, Technology of the Element, Alloys, and Chemical Compounds", Springer 1999, ISBN 0-306-45053-4, S. 111, 168 (eingeschränkte Vorschau in der Google-Buchsuche).
- Patent US5234679: Method of Refining Tungsten Hexafluoride Containing Molybdenum Hexafluoride as an Impurity. Veröffentlicht am 10. August 1993, Erfinder: SUENAGA TAKASHI, OHASHI MITSUYA, YONEDA TAKASHI, KOBAYASHI YOSHIYUKI.
- Patent US6896866: Method for Purification of Tungsten Hexafluoride. Veröffentlicht am 24. Mai 2005, Erfinder: KIKUYAMA HIROHISA, WAKI MASAHIDE, FUJIMOTO KAZUYUK, NAKAGAWA YOSHINORI.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-97.
- J. H. Levy, J. C. Taylor, A. B. Waugh: "Neutron Powder Structural Studies of UF6, MoF6 and WF6 at 77 K", in: Journal of Fluorine Chemistry, 1983, 23 (1), S. 29–36; doi:10.1016/S0022-1139(00)81276-2.
- T. Drews, J. Supeł, A. Hagenbach, K. Seppelt: "Solid State Molecular Structures of Transition Metal Hexafluorides", in: Inorganic Chemistry, 2006, 45 (9), S. 3782–3788; doi:10.1021/ic052029f; PMID 16634614.
- J. Levy: "The Structures of Fluorides XIII: The Orthorhombic Form of Tungsten Hexafluoride at 193 K by Neutron Diffraction", in: Journal of Solid State Chemistry, 1975, 15 (4), S. 360–365; doi:10.1016/0022-4596(75)90292-3
- Arne Haaland, Andreas Hammel, Kristin Rypdal, Hans V. Volden: "The Coordination Geometry of Gaseous Hexamethyltungsten is not Octahedral", in: Journal of the American Chemical Society, 1990, 112 (11), S. 4547–4549; doi:10.1021/ja00167a065.
- Frank Weinhold, Clark R. Landis: "Valency and bonding: a natural bond orbital donor-acceptor perspective", Cambridge University Press 2005, ISBN 0-521-83128-8, S. 427 (eingeschränkte Vorschau in der Google-Buchsuche).
- "Tungsten and Tungsten Silicide Chemical Vapor Deposition".
- Jean Aigueperse, Paul Mollard, Didier Devilliers, Marius Chemla, Robert Faron, Renée Romano, Jean Pierre Cuer: "Fluorine Compounds, Inorganic", in: Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim 2005.
- Semi-conducting metal oxide nanoparticles from a low-pressure premixed H2/O2/Ar flame: Synthesis and Characterization, Cuvillier Verlag, ISBN 3-86727-816-4, S. 52 (eingeschränkte Vorschau in der Google-Buchsuche).
- Tungsten fluoride MSDS (PDF; 24 kB), Linde Gas.
Literatur
- Otto Ruff, Fritz Eisner: "Ueber das Wolframhexafluorid", in: Berichte der deutschen chemischen Gesellschaft, 1905, 38 (1), S. 742–747; doi:10.1002/cber.190503801120.
- Gmelins Handbuch der anorganischen Chemie, System Nr. 54, Wolfram, Teil A, S. 155–157.


