Wolframsäure
Wolframsäure (genauer Orthowolframsäure) ist eine Verbindung aus Wolframtrioxid und Wasser.
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
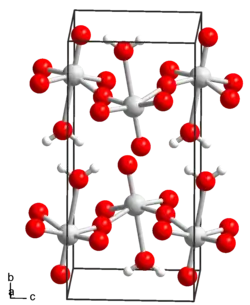 | ||||||||||||||||
| _ W6+ _ O2− _ H+ | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Wolframsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | WO3 · H2O | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 249,85 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
5,5 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| pKS-Wert |
3,5; 4,6[4] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Gewinnung und Darstellung
Wolframsäure entsteht unter anderem beim Ansäuern von Wolframatlösungen und vorsichtigem Erhitzen des zunächst ausfallenden Dihydrats (WO3 · 2 H2O).
So zum Beispiel durch Reaktion von Calciumwolframat mit einer Mischung aus konzentrierter Salzsäure und Salpetersäure.[5]
Eigenschaften
Die Verhältnisformel des Wolframtrioxid-Monohydrats lautet H2WO4, doch existieren im Gegensatz zur scheinbar analog aufgebauten Schwefelsäure (H2SO4) keine diskreten H2WO4-Moleküle. Stattdessen besteht Wolframsäure aus einem Schichtengitter aus WO6-Oktaedern. Die Anionen der Wolframsäure bestehen dagegen, analog der Sulfationen, aus WO42−-Tetraedern.[4] Erstmals isoliert wurde sie von Carl Wilhelm Scheele im Jahr 1781 in Köping. Wolframsäure löst sich leichter in Alkalien als Wolframtrioxid.[2]
Einzelnachweise
- K. C. von Leonhard: Scheelit. In: Handbuch der Oryktognosie, Verlag Mohr and Winter, Heidelberg 1821, S. 594–596 (PDF 233kB; S. 2)
- Eintrag zu Wolframsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Januar 2018.
- Eintrag zu Wolframsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1566.