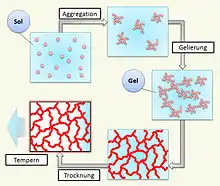
Sol-Gel-Prozess
Der Sol-Gel-Prozess ist ein Verfahren zur Herstellung fester nichtmetallischer anorganischer oder hybridpolymerer Materialien aus kolloidalen Dispersionen, den sogenannten Solen (abgeleitet vom englischen solution – Lösung). Die Ausgangsmaterialien werden auch als Präkursoren bezeichnet. Aus ihnen entstehen in Lösung in ersten Grundreaktionen feinste Teilchen. Durch eine spezielle Weiterverarbeitung der Sole lassen sich Pulver, Fasern, Schichten oder Aerogele erzeugen. Wegen der geringen Größe der zunächst erzeugten Solpartikel im Nanometerbereich lässt sich der Sol-Gel-Prozess als Teil der chemischen Nanotechnologie verstehen.
Präkursoren
Bei den Ausgangsmaterialien für eine Solsynthese handelt es sich oft um Alkoholate von Metallen oder Nichtmetallen, wobei die Eigenschaften von Si-Präkursoren besonders gut untersucht sind[1]:
- Silicium: Tetramethylorthosilicat (TMOS), Tetraethylorthosilicat (TEOS), Tetraisopropylorthosilicat (TPOS).
Werden hier eine oder mehrere der Alkoholatgruppen Si–OR durch einen Kohlenwasserstoffrest R ersetzt, wird die gebildete Bindung hydrolysestabil, d. h. die organischen Reste bleiben während Hydrolyse- und Kondensationsreaktionen fest im Solpartikel gebunden. Unpolare Seitenketten erlauben so die Herstellung hydrophober Materialien. Trägt die Seitenkette funktionale Gruppen, die an einer organischen Polymerisationsreaktion teilnehmen können, lassen sich Hybridpolymere erhalten.
Neben Silicium können viele andere Metalle und Übergangsmetalle im Sol-Gel-Prozess eingesetzt werden:
- Aluminium: Aluminium-(2-propylat), Aluminium-(2-butylat);
- Zirkon: Zirconiumpropylat;
- Titan: Titanethylat, Titan-(2-propylat).
Diese Verbindungen sind hydrolyseempfindlicher als die Silicium-Alkoxide. Durch Komplexierung mit 2,4-Diketonen (β-Diketonen) kann diese Reaktivität deutlich gesenkt werden, was die gemeinsame Verwendung von Präkursoren unterschiedlicher Metalle ermöglicht oder die Beständigkeit von Solen gegen Luftfeuchtigkeit verbessert. Von Übergangsmetallen werden auch Carboxylate wie Acetate und Propionate verwendet, wobei die Löslichkeit der entsprechenden Verbindung im eingesetzten Lösungsmittel eine wichtige Rolle spielt.
Grundreaktionen
Die Hydrolyse von Präkursor-Molekülen und die Kondensation zwischen dabei entstehenden reaktiven Spezies sind die wesentlichen Grundreaktionen des Sol-Gel-Prozesses. Die dabei ablaufenden Vorgänge und die Eigenschaften der Präkursor-Moleküle haben einen entscheidenden Einfluss auf die resultierenden Materialeigenschaften[2].
Hydrolyse
Aus Metallalkoholaten und Wasser entstehen unter Abspaltung von Alkoholmolekülen MOH-Gruppen:
Diese Gleichung beschreibt die partielle Hydrolyse eines Metallalkoholates. Analoge Reaktionen lassen sich für Metallcarboxylate oder -diketonate formulieren, wobei diese Gruppen jedoch eine deutlich höhere hydrolytische Stabilität aufweisen.
Kondensation
In der Realität werden bereits MOH-Gruppen teilweise hydrolysierter Präkursormoleküle unter Wasserabspaltung miteinander kondensieren:
Aus dem Dimer entstehen in der Art einer anorganischen Polykondensationsreaktion Trimere, Tetramere und weitere Oligomere, bis sich schließlich ein Partikel gebildet hat. Je nach Lösungsmittel unterscheidet man zwischen alkoholischen Solen und Hydrosolen. Hydrolyse und Kondensation sind dynamische Reaktionen vieler ineinander greifender Gleichgewichte, die auch von Katalysatoren (Säuren, Basen) beeinflusst werden. Solpartikel können in erheblichem Umfang nicht hydrolysierte Alkoholat-, Carboxylat- oder Diketonatgruppen enthalten. Fortschreitendes Partikelwachstum und die Aggregation von Solteilchen zu Sekundärpartikeln führen zu einem Anstieg der Viskosität. Eine solche „Alterung“ von Beschichtungssolen kann sich nachteilig auf eine industrielle Produktion auswirken. Eine Kontrolle der Teilchengröße ist mittels der Stöber-Synthese möglich.
Gelbildung
Sobald sich zwischen den Wänden des Reaktionsgefäßes ein Netzwerk aus Solpartikeln gebildet hat, spricht man von Gelierung. Das viskos fließende Sol ist in einen viskoelastischen Festkörper übergegangen. Das Gel besteht aus dem Gelgerüst und dem von ihm eingeschlossenen Lösungsmittel, wobei jedoch alle Poren miteinander in Verbindung stehen („interpenetrierendes Netzwerk“). Eine exakte Bestimmung von Gelierzeiten wird erschwert, weil die Gelbildungsdauer auch eine Funktion der Gefäßgröße ist. Außerdem können rheologische Messungen die Ausbildung des Netzwerkes stark beeinflussen.
Weiterverarbeitung
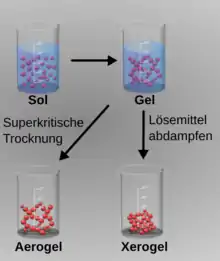
Trocknung von Gelen
Werden Gele bei Normaldruck getrocknet, erhält man Xerogele. Dabei schrumpft der Gelkörper stark, weil durch das Lösungsmittel in den Poren des Gelnetzwerkes hohe Kapillarkräfte wirken. Während der Trocknung kondensieren reaktive Gruppen sich berührender Gelpartikel miteinander, wodurch sich die ursprüngliche Mikrostruktur des Geles verändert.[3] Durch Erhöhung von Druck und Temperatur kann die Porenflüssigkeit von Gelen in den überkritischen Zustand gebracht werden. Weil die Porenflüssigkeit ihre Oberflächenspannung verloren hat, wirken keine Kapillarkräfte mehr. Nach Ablassen des überkritischen Mediums bleiben Aerogele zurück. Theoretisch repräsentiert ein Aerogel die beim Sol-Gel-Übergang entstandene Materialstruktur. Es ist jedoch zu berücksichtigen, dass die hohe Temperatur bei der überkritischen Trocknung das Gelnetzwerk verändert haben kann.
Dichte Formkörper
Die Herstellung unporöser keramischer Formkörper ist wegen der bei Trocknung und Sintern ablaufenden starken Verdichtung ohne Risse problematisch. Zwar lassen sich grundsätzlich Werkstücke glasartiger Zusammensetzung erzeugen[4], Sol-Gel-Techniken haben sich aber hier wegen der im Vergleich zu klassischen Verfahren hohen Kosten nicht durchgesetzt.
Pulver
Das einfache Eintrocknen von Solen führt nicht grundsätzlich zu pulverförmigen Produkten, weil beim Lösungsmittelverlust die Solpartikel aggregieren. Als Folge können sich Niederschläge oder Gelnetzwerke bilden, die bei weiterer Trocknung zu einem Xerogel werden. Um feine Pulverpartikel zu erhalten, können unreaktive Funktionalitäten an der Partikeloberfläche – beispielsweise in Kombination mit einer Sprühtrocknung – geschützt werden.
Fasern
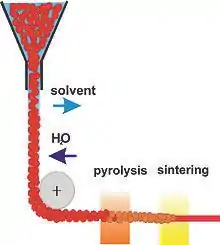
Der Sol-Gel-Prozess bietet die Möglichkeit zur Herstellung von anorganischen und keramischen Fasern. Ausgangsmaterial sind sogenannte Spinnmassen. Unter bestimmten Bedingungen lassen sich Sole im Vakuum bei erhöhter Temperatur zu zähflüssigen Massen einengen, ohne dass sich ein Gelnetzwerk mit kovalenten Bindungen zwischen den Solpartikeln ausbildet. Beim Abkühlen erstarrt das Material glasartig, kann aber wieder aufgeschmolzen werden. Solche wieder aufgeschmolzenen Spinnmassen können durch Düsen gepresst werden. Durch die Kombination aus Scherbelastung bei der Extrusion, Zutritt von Luftfeuchtigkeit und Verdampfen von Restlösungsmittel, bilden sich kovalente Bindungen. Die so entstandene Gelfaser ist im Gegensatz zur Spinnmasse nicht schmelzbar. Es gibt keine universell anwendbaren Regeln zur Synthese funktionierender Spinnmassen. Entsprechende Rezepturen sind oft komplex und basieren auf empirischen Versuchsreihen und Erfahrungen mit den entsprechenden Stoffsystemen. Die Gelfaser kann einen hohen Anteil organischer Restbestandteile enthalten, der durch Trocknungs- und thermische Pyrolyseschritte entfernt werden muss. Durch Sintern bei höheren Temperaturen wird die Faser kristallisiert und verdichtet. Das Material darf während des Spinnvorganges, der Trocknung, der Pyrolyse und dem Sintern beispielsweise nicht durch Rissbildung geschädigt werden, was die Faserentwicklung zu einer wissenschaftlich und technologisch sehr anspruchsvollen Aufgabe macht. Neben keramischen Oxidfasern (Aluminiumoxid, Mullit, Blei-Zirkonat-Titanat, Yttrium-Aluminium-Granat) gibt es auch nichtoxidische Fasern (Siliciumcarbid) beziehungsweise oxidische, nicht-kristalline Systeme Kieselgelfasern.
Sol-Gel-Schichten
Durch nasschemische Beschichtungsverfahren wie Tauch- und Rotationsbeschichtung sowie Rakeln oder Sprühen (Sprühpyrolyse) lassen sich aus Solen Beschichtungen herstellen. Hybridpolymere lassen sich hierbei auch auf thermisch empfindlichen Materialien applizieren. Die für anorganische Sol-Gel-Materialien notwendige Temperaturbehandlung hingegen erlaubt nur die Beschichtung von Metallen, Keramik und Glas.
Kommerzielle Produkte
Das Sol-Gel-Verfahren wird zur Herstellung und Veredlung sehr unterschiedlicher Produkte eingesetzt, weshalb es selten als eigenständige Technologie wahrgenommen wird:
- Poröse Siliciumdioxid-Schichten dienen zur Entspiegelung von Solarkollektoren.
- Unter der Antireflexschicht von Brillengläsern schützt eine Kratzschutzschicht aus Hybridpolymer die Kunststofflinse.
- Durch abwechselnde Sol-Gel-Beschichtung mit niedrigbrechendem Siliciumdioxid und hochbrechendem Titandioxid werden Interferenzfilter für optische Anwendungen, zur Entspiegelung und zur Erzeugung von Farbeffekten in der Beleuchtungsindustrie produziert.
Eine Zusammenstellung von kommerziellen Anwendungen von Sol-Gel-Schichten findet sich in Aegerter et al. 2008[5].
Literatur
- Ulrich Schubert, Nicola Hüsing: Synthesis of Inorganic Materials. 2. revised and updated edition. Wiley-VCH, Weinheim u. a. 2005, ISBN 3-527-31037-1 (englisch).
- C. Jeffrey Brinker, George W. Scherer (Hrsg.): Sol Gel Science. The Physics and Chemistry of Sol-Gel Processing. The Physics and Chemistry of Sol-gel Processing. Academic Press, Boston u. a. 1990, ISBN 0-12-134970-5.
- H. K. Schmidt: Das Sol-Gel-Verfahren. In: Chemie in unserer Zeit. 35, Nr. 3, 2001, ISSN 0009-2851, S. 176–184.
- G. Jonschker: Praxis der Sol-Gel Technologie. Vincentz Network, Hannover 2012. ISBN 978-3-86630-875-6
Einzelnachweise
- Ralph K. Iler: The Chemistry of Silica: Solubility, Polymerization, Colloid and Surface Properties and Biochemistry of Silica: Solubility, Polymerization, Colloid and Surface Properties and Biochemistry. John Wiley & Sons, New York 1979, ISBN 0-471-02404-X.
- Sumio Sakka: Sol–gel technology as representative processing for nanomaterials: case studies on the starting solution. In: Journal of Sol-Gel Science and Technology. Band 46, Nr. 3, 2008, S. 241–249, doi:10.1007/s10971-007-1651-6.
- George W. Scherer: Theory of Drying. In: Journal of the American Ceramic Society. Band 73, Nr. 1, 1990, S. 3–14, doi:10.1111/j.1151-2916.1990.tb05082.x.
- Fikret Kirkbir, Hideaki Murata, Douglas Meyers, S. Ray Chaudhuri, Arnab Sarkar: Drying and sintering of sol-gel derived large SiO2 monoliths. In: Journal of Sol-Gel Science and Technology. Band 6, Nr. 3, 1996, S. 203–217, doi:10.1007/BF00402691.
- M. Aegerter, R. Almeida, A. Soutar, K. Tadanaga, H. Yang, T. Watanabe: Coatings made by sol–gel and chemical nanotechnology. In: Journal of Sol-Gel Science and Technology. Band 47, Nr. 2, 2008, S. 203–236, doi:10.1007/s10971-008-1761-9.