Calciumcyanamid
Calciumcyanamid ist auch bekannt als Kalkstickstoff. Diesen Handelsnamen schlugen 1901 Albert Frank (Sohn von Adolph Frank) und Hermann Freudenberg vor. Beide leiteten von 1899 bis 1908 die Cyanidgesellschaft mbH Berlin.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||||||||
| Name | Calciumcyanamid | |||||||||||||||||||||
| Andere Namen |
Kalkstickstoff | |||||||||||||||||||||
| Summenformel | CaCN2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, hexagonale Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 80,11 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
2,29 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
| |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
Auf ihrer Suche nach einem neuen Verfahren zur Herstellung von Cyaniden zur Goldgewinnung mittels Cyanidlaugung entdeckten Adolph Frank und Nikodem Caro die Eigenschaft von Erdalkalicarbiden, bei hohen Temperaturen atmosphärischen Stickstoff aufzunehmen.[6] Fritz Rothe, einem Mitarbeiter von Frank und Caro, gelang es 1898, Probleme bei der Verwendung von Calciumcarbid zu überwinden und zu klären, dass bei der Reaktion bei rund 1100 °C kein Calciumcyanid, sondern Calciumcyanamid (Kalkstickstoff) gebildet wird. Tatsächlich lässt sich aus Calciumcyanamid durch Schmelzen mit Natriumchlorid in Gegenwart von Kohlenstoff auch das eigentliche Zielprodukt Natriumcyanid gewinnen:[7]
Frank und Caro entwickelten den wegen der hohen Temperaturen apparativ schwierigen Prozess der Kalkstickstoffsynthese – insbesondere durch den Verfahrensschritt der Initialzündung – zu einem großtechnisch handhabbaren kontinuierlichen Herstellungsverfahren. Im Jahr 1901 ließ sich Ferdinand Eduard Polzeniusz ein Verfahren patentieren, das Calciumcarbid in Gegenwart von 10 % Calciumchlorid bei 700 °C zu Kalkstickstoff umsetzt. Der Vorteil einer um ca. 400 °C niedrigeren Reaktionstemperatur wird jedoch durch den hohen Calciumchloridzusatz und die diskontinuierliche Prozessführung relativiert. Gleichwohl haben sich beide Prozesse, das Rothe-Frank-Caro-Verfahren und das Polzeniusz-Krauss-Verfahren in der ersten Hälfte des 20. Jahrhunderts etabliert. Im Rekordjahr 1945 wurden weltweit insgesamt ca. 1,5 Mio. Tonnen nach beiden Verfahren hergestellt.[8] Frank und Caro stellten auch die Bildung von Ammoniak aus Kalkstickstoff fest.[9]
Albert Frank erkannte die fundamentale Bedeutung dieser Reaktion als technischen Durchbruch bei der Bereitstellung von Ammoniak aus Luftstickstoff und empfahl im Jahr 1901 Calciumcyanamid als Stickstoffdünger. Zwischen 1908 und 1919 wurden in Deutschland fünf Kalkstickstoffwerke mit einer Gesamtkapazität von 500.000 Tonnen pro Jahr aufgebaut, da Calciumcyanamid als damals billigster Stickstoffdünger mit zusätzlicher Wirksamkeit gegen Unkräuter und Pflanzenschädlinge große Vorteile gegenüber herkömmlichen Stickstoffdüngern aufwies. Durch die großtechnische Umsetzung der Ammoniak-Direktsynthese nach dem Haber-Bosch-Verfahren erwuchs dem sehr energieintensiven Frank-Caro-Verfahren schon bald ernsthafte Konkurrenz. Der spätestens nach dem Zweiten Weltkrieg wesentlich stickstoffreichere (46 % gegenüber ca. 20 % N-Gehalt), billiger verfügbare und schneller wirksame Harnstoff reduzierte Calciumcyanamid allmählich zum multifunktionalen Stickstoffdünger in Nischenanwendungen. Die schmutzig-schwarze Farbe des stark staubenden, Augen und Schleimhäute reizenden Kalkstickstoffpulvers, sowie dessen Eigenschaft, im menschlichen Körper ein alkoholabbauendes Enzym zu hemmen, so dass bei zeitlich nahegelegenem Alkoholgenuss eine temporäre Anreicherung von Acetaldehyd im Körper und damit Schwindel, Übelkeit und Hitzewallungen die Folge sein können, trugen nicht unerheblich zum Popularitätsverlust des Kalkstickstoffs bei.
Darstellung
Es lässt sich durch exotherme Azotierung von Calciumcarbid bei 1000 °C herstellen.[1] Als Zwischenprodukt entsteht dabei Calciumcyanid. Da die Reaktion exotherm ist, lässt sie sich durch Initialzündung einer kleinen Menge mittels elektrischer Heizstäbe einleiten:
Das technische Verfahren verwendet in einer modernen Variante ein Gemisch aus ca. 80 Gew.% Calciumcarbid, 20 Gew.% Kalkstickstoff und < 1 Gew.% Calciumfluorid als Reaktionsbeschleuniger. Die Reaktion verläuft in einem Drehofen bei 1050 °C unter Stickstoff in einer Azotierausbeute von > 93 %, einem Restcarbidgehalt von ca. 0,1 % und einem N-Gehalt des erzeugten Kalkstickstoffs von > 24,5 %.[10] Steht eine billige Harnstoffquelle zur Verfügung, kann auch ein bei wesentlich niedrigeren Temperaturen ablaufender Zweistufenprozess zur Herstellung von Kalkstickstoff genutzt werden. Im ersten Schritt wird dabei aus Harnstoff und Calciumoxid bei ca. 250 °C Calciumcyanat erzeugt, das im zweiten Schritt bei ca. 750 °C zu reinem Calciumcyanamid in bis zu 97%iger Ausbeute und einem N-Gehalt des erzeugten Kalkstickstoffs von bis zu 34 % umgesetzt wird.[11]
Verwendung
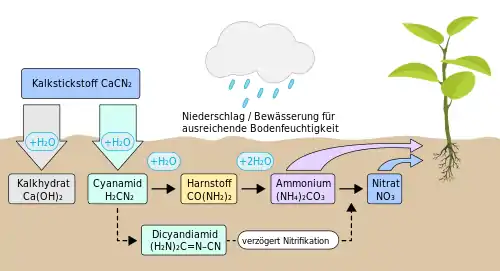
Calciumcyanamid dient als Ausgangsstoff für die Synthese von Cyanamid, Dicyandiamid, Melamin, Thioharnstoff oder Guanidinen.
Unter der Bezeichnung Kalkstickstoff gehört es zu den in der Europäischen Union zugelassenen Düngemitteln und hat wegen des im Zuge der Umsetzung zu pflanzenverfügbaren Stickstoffformen entstehenden Cyanamids eine abtötende Wirkung auf verschiedene Unkräuter, tierische Schädlinge, Weideparasiten sowie Plasmodien von Plasmodiophora brassicae. Für letzteren Einsatzzweck war Kalkstickstoff in den 1980er-Jahren von der seinerzeit noch für die Pflanzenschutzmittelzulassung verantwortlichen Biologischen Bundesanstalt als Pflanzenschutzmittel zugelassen.
Eigenschaften
Handelsübliches Calciumcyanamid ist meist noch mit Kohlenstoff, Calciumoxid, Eisen und Aluminium verunreinigt. Es hat dann gewöhnlich eine graue bis schwarze Farbe. Beim Lösen in Wasser zersetzt es sich zu Ammoniak und Calciumcarbonat.
Calciumcyanamid müsste nach der Röntgenstrukturanalyse[12] eigentlich als Calciumcarbodiimid bezeichnet werden, weil es zwei Doppelbindungen zwischen dem zentralen C- und den beiden N-Atomen enthält. Ein echtes Cyanamid mit einer C-N-Einfach- und einer C-N-Dreifachbindung liegt dagegen mit dem Bleicyanamid PbCN2 vor.[13] Die ungenaue Bezeichnung für CaCN2 geht vermutlich auf die Nähe zum Cyanamidmolekül H2CN2 (mit Einfach- und Dreifachbindung) zurück sowie auf die Tatsache, dass die strukturellen Verhältnisse im festen Zustand gegen Ende des 19. Jahrhunderts noch unbekannt waren.[14]
Sicherheitshinweise
Calciumcyanamid kann in Verbindung mit Ethanol zu Hyperämie der Haut, Schwindel und Atemnot führen. Auslöser der Alkoholunverträglichkeitsreaktion ist das im Körper gebildete Cyanamid, das wie das als Alkoholaversivum eingesetzte Disulfiram durch Hemmung der Acetaldehyddehydrogenase die Anhäufung des toxischen Acetaldehyds im Blutkreislauf induziert.[15] Die Vergiftungssymptome treten bei späterem Kontakt mit Alkohol oder weiteren acetaldehydbildenden Substanzen auch längerfristig erneut in abgeschwächter Form auf. Dies ist als Kalkstickstoff-Krankheit bekannt.
Weblinks
- Umwandlung von Kalkstickstoff im Boden auf www.alzchem.com, abgerufen am 14. März 2017
- Potential risks to human health and the environment from the use of calcium cyanamide as fertiliser (PDF 1534 kB, Scientific Committee on Health and Environmental Risks, 2016)
Einzelnachweise
- Eintrag zu Kalkstickstoff. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Oktober 2014.
- Eintrag zu Calciumcyanamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Eintrag zu Calcium cyanamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 31. Oktober 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 156-62-7 bzw. Calciumcyanamid), abgerufen am 2. November 2015.
- Stoffliste (MAK-Werte und TRK-Werte), Verordnung des Bundesministers für Arbeit über Grenzwerte für Arbeitsstoffe sowie über krebserzeugende und fortpflanzungsgefährdende (reproduktionstoxische) Arbeitsstoffe (Grenzwerteverordnung 2021 – GKV), Österreich, abgerufen am 27. August 2021.
- Deutsches Reichspatent DRP 88363, „Verfahren zur Darstellung von Cyanverbindungen aus Carbiden“, Erfinder: A. Frank, N. Caro, erteilt am 31. März 1895.
- H.H. Franck, W. Burg: Zur Chemie des Kalkstickstoffes. V. In: Zeitschrift für Elektrochemie und angewandte physikalische Chemie, Bd. 40, 1934, S. 686–692. doi:10.1002/bbpc.19340401004
- ACS Chemical Landmarks 1998, "Discovery of the commercial processes for making calcium carbide and acetylene".
- Angewandte Chemie, Band 29, Ausgabe 16, Seite R97, 25. Februar 1916.
- DE-Patent 3705049C2, Anmelder: SKW Trostberg AG, erteilt am 1. August 1991.
- US-Patent 5,753,199, Anmelder: SKW Trostberg AG, erteilt am 19. Mai 1998.
- N.-G. Vannerberg, Acta Chem. Scand. 1962, 16, 2263–2266. doi:10.3891/acta.chem.scand.16-2263
- X. Liu, A. Decker, D. Schmitz, R. Dronskowski, Z. Anorg. Allg. Chem. 2000, 626, 103–105. doi:10.1002/(SICI)1521-3749(200001)626:1%3C103::AID-ZAAC103%3E3.0.CO;2-7
- X. Liu, P. Müller, P. Kroll, R. Dronskowski, W. Wilsmann, R. Conradt, ChemPhysChem 2003, 4, 725–731. doi:10.1002/cphc.200300635
- „Aversionsmittel stärken langfristige Alkoholabstinenz“, Forschungsmeldung der Max-Planck-Gesellschaft, 9. Januar 2006.


