Staurolith
Das Mineral Staurolith (Kreuzstein) ist ein häufig vorkommendes Inselsilikat mit der allgemeinen chemischen Zusammensetzung M2+4Al18Si8O46(OH)2. In dieser vereinfachten Strukturformel steht M2+ für zweiwertige Kationen, vorwiegend Eisen (Fe2+), Magnesium (Mg2+) und Zink (Zn2+) in beliebigen Mischungsverhältnissen. Nach den Gehalten dieser Kationen werden in der Staurolithgruppe vier Minerale unterschieden:
- Staurolith (Eisenstaurolith): (Fe2+)2Al9Si4O23(OH)[1]
- Magnesiostaurolith: Mg(Mg,Li)3(Al,Mg)18Si8O44(OH)4[1]
- Zinkstaurolith: Zn2Al9Si4O23(OH)[1]
| Staurolith | |
|---|---|
 | |
| Allgemeines und Klassifikation | |
| Andere Namen |
Kreuzstein |
| Chemische Formel | (Fe2+)2Al9Si4O23(OH)[1] |
| Mineralklasse (und ggf. Abteilung) |
Inselsilikate mit tetraederfremden Anionen (Neso-Subsilikate) |
| System-Nr. nach Strunz und nach Dana |
9.AF.30 (8. Auflage: VIII/B.03) 52.02.03.01 |
| Kristallographische Daten | |
| Kristallsystem | monoklin |
| Kristallklasse; Symbol | monoklin-prismatisch 2/m |
| Raumgruppe (Nr.) | C/2m (Nr. 12) |
| Häufige Kristallflächen | {110}, {101}, {010}, {001} |
| Zwillingsbildung | oft kreuzförmige Durchdringungszwillinge (90° rechtwinklig und 60° schiefwinklig) |
| Physikalische Eigenschaften | |
| Mohshärte | 7 bis 7,5 |
| Dichte (g/cm3) | 3,65 bis 3,83 |
| Spaltbarkeit | unvollkommen |
| Bruch; Tenazität | muschelig, uneben, spröd |
| Farbe | rotbraun bis braunschwarz |
| Strichfarbe | weiß |
| Transparenz | durchscheinend bis undurchsichtig |
| Glanz | Glas-, Fettglanz matt |
| Kristalloptik | |
| Brechungsindizes | nα = 1,736 bis 1,747 nβ = 1,740 bis 1,754 nγ = 1,745 bis 1,762 |
| Doppelbrechung | δ = 0,009 bis 0,015 |
| Optischer Charakter | zweiachsig positiv |
| Pleochroismus | schwach: farblos/hellgelb/gelbrot – farblos/hellgelb/gelbrot – hellgelb/gelborange/rosarot |
| Weitere Eigenschaften | |
| Besondere Merkmale | typische kreuzförmige Kristallzwillinge |
Staurolithe kristallisieren im monoklinen Kristallsystem und entwickeln überwiegend prismatische bis tafelige Kristalle und charakteristisch-kreuzförmige Kristallzwillinge, aber auch körnige bis massige Aggregate in rotbrauner bis braunschwarze Farbe.
Etymologie und Geschichte
Der Name des Minerals leitet sich aus dem Griechischen ab und bedeutet Kreuzstein (σταυρóς „Kreuz“, λíθος „Stein“), spielt also auf die häufig zu findende kreuzförmige Verzwillingung an. Aus diesem Grunde wurden größere Kristalle oft von Christen als Schmuck oder Amulett getragen. Insbesondere in den Schweizer Alpen waren sie unter dem Namen Basler Taufstein weit verbreitet.
Klassifikation
In der mittlerweile veralteten, aber noch gebräuchlichen 8. Auflage der Mineralsystematik nach Strunz gehörte der Staurolith zur Mineralklasse der „Silikate und Germanate“ und dort zur Abteilung der „Inselsilikate mit tetraederfremden Anionen (Neso-Subsilikate)“, wo er zusammen mit Gerstmannit, Magnesiostaurolith und Zinkstaurolith die unbenannte Gruppe VIII/B.03 bildete.
Die seit 2001 gültige und von der International Mineralogical Association (IMA) verwendete 9. Auflage der Strunz’schen Mineralsystematik ordnet den Staurolith ebenfalls in die Klasse „Silikate und Germanate“ und dort in die Abteilung der „Inselsilikate (Nesosilikate)“. Diese Abteilung ist allerdings weiter unterteilt nach der möglichen Anwesenheit weiterer Anionen sowie der Koordination der beteiligten Kationen, so dass das Mineral entsprechend seiner Zusammensetzung in der Unterabteilung der „Inselsilikate mit zusätzlichen Anionen; Kationen in [4]er-, [5]er- und/oder nur [6]er-Koordination“ zu finden ist, wo es ebenfalls zusammen mit Magnesiostaurolith und Zinkstaurolith die unbenannte Gruppe 9.AF.30 bildet.
Auch die vorwiegend im englischen Sprachraum gebräuchliche Systematik der Minerale nach Dana ordnet den Staurolith in die Klasse der „Silikate und Germanate“, dort allerdings in die Abteilung der „Inselsilikate: SiO4-Gruppen und O, OH, F und H2O“ ein. Hier ist er zusammen mit Magnesiostaurolith und Zinkstaurolith in der unbenannten Gruppe 52.02.03 innerhalb der Unterabteilung der „Inselsilikate: SiO4-Gruppen und O, OH, F und H2O mit Kationen in [4] und >[4]-Koordination“ zu finden.
Chemismus
Die Zusammensetzung von Staurolith ist von Bedeutung, weil aus dem Auftreten von Staurolith Rückschlüsse auf die Bildungsbedingungen des staurolithführenden Gesteins gezogen werden können. Dies geschieht mit der Zielsetzung, die Druck- und Temperaturgeschichte eines Gesteins zu ermitteln und daraus die Bewegung von ganzen Gesteinsformationen in der Erdkruste zu rekonstruieren.
Zur Ermittlung solcher Druck- und Temperaturdaten müssen Mineralreaktionen berechnet werden. Hierfür benötigt man zum einen Informationen über die Zusammensetzung aller beteiligten Minerale und zum anderen detaillierte Kenntnisse der intrakristallinen Verteilung der Elemente auf die verschiedenen Positionen der Mineralstruktur.
Elementgehalte
Die eingangs angegebene chemische Formel gibt eine vereinfachte Zusammensetzung von Staurolith wieder. Die Komplexität der Kristallchemie von Staurolith erschließt sich erst, wenn die Gehalte schwer analysierbarer Elemente wie Lithium und Wasserstoff sowie die Verteilung der Elemente auf die verschiedenen Kationenpositionen berücksichtigt wird. In der Mineralogie haben sich Strukturformeln für die Notation von Mineralzusammensetzungen durchgesetzt, weil sie zusätzlich noch strukturelle Informationen enthalten. Eine vereinfachte Strukturformel für Staurolith lautet:
(Fe,Mg,Zn,Co,Ni,Mn,Li,Al)2-4(Al,Cr,Ti,Mg,Fe)18(Si,Al)8O40(O,OH)8.
In dieser Formel sind die Elementgehalte der Positionen T2 und M4 in der ersten Klammer (Fe,...)2-4 zusammengefasst. Die zweite Klammer enthält die Elemente der Aluminiumoktaeder M1,2,3 und die dritte Klammer die Elemente des Siliziumtetraeders T1. O40 sind die Sauerstoffionen der Sauerstoffpositionen O2,3,4,5, während (O,OH)8 die Zusammensetzung der Sauerstoffposition O1 wiedergibt. Letzteres ist das Sauerstoffion, über das die Oktaeder M3 und M4 verknüpft sind und an das die Wasserstoffionen gebunden sind (OH-Gruppen).
Eine Durchsicht von knapp 550 publizierten Zusammensetzungen natürlicher Staurolithe liefert folgendes Bild der Elementkonzentrationen:
- Si4+: 7 bis 8 apfu (Atome pro Formeleinheit), im Mittel: 7,72 apfu
- Al3+: 16,1 bis 19,5 apfu, im Mittel: 17,8 apfu
- Ti4+: 0 bis 0,35 apfu, im Mittel: 0,1 apfu
- Cr3+: 0 bis 1,4 apfu, im Mittel: 0 apfu
- Fe3+: 0 bis 0,36 apfu, häufig nicht bestimmt
- Fe2+: 0,15 bis 3,9 apfu, im Mittel: 2,7 apfu
- Mg2+: 0 bis 3 apfu, im Mittel: 0,7 apfu
- Zn2+: 0 bis 2,8 apfu, im Mittel: 0,4 apfu
- Co2+: 0 bis 2,1 apfu, im Mittel: 0 apfu
- Mn2+: 0 bis 0,45 apfu, im Mittel: 0,06 apfu
- Li+: 0 bis 1,6 apfu, oft nicht bestimmt
- H+: 1,8 bis 4,6 apfu, oft nicht bestimmt
Elementverteilungen
Alle Si4+-Ionen befinden sich auf der T1-Position. Sind weniger als 8 Siliziumionen pro Formeleinheit vorhanden, werden die verbleibenden T1-Plätze mit Aluminiumionen gefüllt. Der Ladungsausgleich erfolgt über den Einbau von einem Wasserstoffion pro Aluminiumion auf T1.
Fast alle dreiwertigen Kationen sowie Ti4+ und ungefähr 10 Prozent aller zweiwertigen Kationen werden auf den Oktaederpositionen M1,2,3 eingebaut. Eine Ausnahme bildet Zn2+, das nur auf der Tetraederposition T2 eingebaut wird. Der Ladungsausgleich für den Einbau eines zweiwertigen Kations anstelle eines dreiwertigen erfolgt über den Einbau eines Wasserstoffions pro zweiwertigem Kation auf der Position M1,2,3.
Die größte Variation in der Zusammensetzung von Staurolith verursachen die zweiwertigen Kationen. In der Natur kommen alle Zusammensetzungen zwischen reinen Eisen-Staurolithen sowie Magnesium- oder Zink-Staurolithen vor, aber keine Magnesium-Zink-Staurolithe. Der überwiegende Anteil der zweiwertigen Kationen, etwa 80 bis 90 Prozent, sowie Lithium und geringe Mengen Aluminium und dreiwertiges Eisen werden auf der Tetraederposition T2 eingebaut. Der Ladungsausgleich für den Einbau von dreiwertigen anstelle der zweiwertigen Kationen erfolgt über eine Reduzierung der Wasserstoffionengehalte.
Ungefähr 5 bis 10 Prozent der zweiwertigen Kationen mit Ausnahme von Zink wird in der ansonsten leeren M4-Oktaederposition eingebaut. Da eine gleichzeitige Besetzung benachbarter T2- und M4-Positionen ausgeschlossen werden kann, müssen für jede besetzte M4-Position zwei T2-Positionen leer sein. Der erforderliche Ladungsausgleich erfolgt über den Einbau von zwei zusätzlichen Wasserstoffionen pro besetzte M4-Position.
Kristallstruktur
In fast allen gesteinsbildenden Silikaten wie etwa Glimmern, Pyroxenen, Amphibolen und Olivinen werden zweiwertige Kationen in Oktaederlücken eingebaut. Die Staurolithstruktur ist interessant, weil sie eine der wenigen Silikatstrukturen ist, in der zweiwertige Kationen vorwiegend in Tetraederlücken auftreten. Dies hat eine deutlich sichtbare Konsequenz: Eisenhaltige Staurolithe sind gelblich braun, während Minerale mit zweiwertigen Eisenionen in oktaedrischer Koordination intensiv grün gefärbt sind. Weniger offensichtlich ist, dass Staurolith eine Ausnahme von einer der Daumenregeln der Kristallchemie darstellt, der Druck-Koordinationsregel: Sie besagt, dass mit steigendem Druck die Anzahl der ein Kation umgebenden Anionen, die so genannte Koordinationszahl, zunimmt. Staurolith bildet sich im Zuge aufsteigender Metamorphose aus Mineralen, in denen die zweiwertigen Kationen oktaedrisch koordiniert sind, zum Beispiel Chloritoid. Die Bildung von Staurolith bei steigenden Druck geht also mit einer Erniedrigung der Kationenkoordination einher.
Atompositionen
Die Struktur der Staurolithe kann in guter Näherung als kubisch dichteste Kugelpackung von Sauerstoffanionen (O2−) beschrieben werden. Die Kationen sitzen hierbei in den Lücken zwischen den Sauerstoffanionen. In dichtesten Kugelpackungen gibt es zwei verschiedene Arten solcher Lücken, die sich in der Anzahl der angrenzenden Kugeln (Sauerstoffanionen in diesem Fall) unterscheiden:
- Tetraederlücken sind Lücken zwischen vier Sauerstoffanionen. Die Sauerstoffatome befinden sich an den Ecken einer tetraederförmigen Lücke.
- Oktaederlücken sind Lücken zwischen sechs Sauerstoffanionen. Die Sauerstoffatome befinden sich an den Ecken einer oktaederförmigen Lücke.
Im Falle der Staurolithstruktur ist die kubisch dichteste Kugelpackung verzerrt. Die Oktaederlücken sind nicht alle gleich groß und ihre Form weicht von einer idealen Oktaederform ab. Gleiches gilt für die Tetraederlücken. Die Symmetrie der Staurolithstruktur ist daher nicht kubisch, sondern monoklin und wird durch die Raumgruppe C2/m beschrieben. Der monokline Winkel β schwankt zwischen 90.0° und 90,64°.
Die verschiedenen Kationen, die die Zusammensetzung der Staurolithe ausmachen, verteilen sich in erster Linie entsprechend ihrer Größe auf die verschiedenen Positionen der Staurolithstruktur. Die Staurolithstruktur weist zwei verschiedene Tetraederlücken auf:
- Die Lücke T1 enthält alle Siliciumionen (Si4+) und meistens kleine Mengen von Aluminiumionen (Al3+). Diese Tetraederposition ist immer vollständig besetzt.
- Die Lücke T2 enthält den größten Teil aller zweiwertigen Kationen (Fe2+, Mg2+, Zn2+, Co2+). Diese Position ist oft nicht vollständig besetzt, das heißt, es gibt leere T2-Tetraederlücken.
Neben den Tetraederlücken gibt es vier verschiedene Oktaederpositionen:
- Lücken M1A und M1B enthalten Aluminiumionen (Al3+) sowie geringe Mengen zweiwertiger Kationen, vor allem Magnesium. Diese Positionen sind immer vollständig besetzt.
- Lücke M2 enthält Aluminiumionen (Al3+) sowie sehr geringe Mengen zweiwertiger Kationen, vor allem Magnesium. Diese Position ist immer vollständig besetzt.
- Lücken M3A und M3B enthalten Aluminiumionen (Al3+) sowie geringe Mengen zweiwertiger Kationen, vor allem Magnesium. Diese Position ist nur zur Hälfte besetzt. Die Verteilung von Kationen und Leerstellen auf die M3-Oktaederpositionen M3A und M3B ist hauptsächlich verantwortlich für die Variation des monoklinen Winkels β. Bei vollständiger Ordnung, d. h. M3A ist vollständig besetzt mit Kationen und M3B ist vollkommen leer, erreicht β seinen maximalen Wert von 90,64°. Bei vollkommen gleichmäßiger Verteilung von Kationen und Leerstellen auf die M3A- und M3B-Oktaeder geht β auf 90,0° zurück. In diesem Grenzfall erreicht die Staurolithstruktur orthorhombische Symmetrie in der Raumgruppe Ccmm.
- Lücken M4A und M4B enthalten geringe Mengen zweiwertiger Kationen und sind ansonsten leer.
Die Wasserstoffionen (Protonen H+) liegen nicht in den Lücken der Kugelpackung, sondern auf deren begrenzenden Kanten und Flächen. Alle Protonen im Staurolith sind an Sauerstoffionen gebunden, die die Spitze eines T2-Tetraeders bilden. Drei H-Positionen sind bekannt:
- Positionen H1A und H1B: Die Protonen liegen in der Begrenzungsfläche eines leeren M3-Oktaeders und bilden gegabelte Wasserstoffbrückenbindungen zu zwei weiteren Sauerstoffen.
- Position H2: Die Protonen liegen auf einer Kante eines leeren T2-Tetraeders und bilden eine lineare Wasserstoffbrückenbindung.
- Position H3A und H3B: Die Protonen liegen in der Begrenzungsfläche eines leeren M4-Oktaeders und bilden gegabelte Wasserstoffbrückenbindungen zu zwei weiteren Sauerstoffen.
Verknüpfungen der Koordinationspolyeder
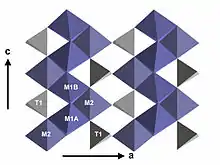
Die voll besetzten Aluminium-Oktaeder M1 und M2 sind miteinander über gemeinsame Kanten zu zickzackförmigen Ketten verknüpft. Diese Oktaederketten verlaufen parallel zur kristallographischen c-Achse. Die Silizium-Tetraeder sind in der Struktur isoliert, das bedeutet, sie sind nicht über gemeinsame Ecken, Kanten oder Flächen miteinander verbunden; Staurolith ist daher ein Inselsilikat. Die Silizium-Tetraeder verknüpfen die Aluminium-Oktaederketten in Richtung der kristallographischen a-Achse. Sie bilden zusammen mit den Aluminium-Oktaederketten eine der zwei großen Baueinheiten, die die Staurolithstruktur ausmachen: Eine Alumosilikatschicht parallel zur a-c-Ebene. Sie entspricht in Struktur und Zusammensetzung der b-c-Ebene der Kyanitstruktur. Dies ist die strukturelle Erklärung für die in der Natur zu beobachtende epitaktische Verwachsung von Staurolith und Kyanit.
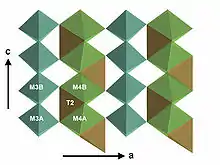
Die zweite große Baueinheit der Staurolithstruktur ist eine Eisen-Aluminium-Oxid-Hydroxidschicht, die ebenfalls parallel zur a-c-Ebene liegt. Sie baut sich aus den M3-, M4- und T2-Positionen wie folgt auf: Die M3-Oktaeder sind über gemeinsame Kanten zu Ketten in c-Richtung verknüpft, ebenso die M4-Oktaeder. Entlang der kristallographischen a-Achse ist jeder M3-Oktaeder über gemeinsame Ecken mit zwei M4-Oktaedern verknüpft. Dementsprechend ist jeder M4-Oktaeder über gemeinsame Ecken mit zwei M3-Oktaedern verknüpft. Die T2-Tetraeder liegen zwischen den M3- und M4-Oktaedern. Jeder M4-Oktaeder ist über gemeinsame Flächen mit zwei T2-Tetraedern verknüpft. Wegen dieser Flächerverknüpfung sind die Abstände der Kationenpositionen in M4 und T2 so klein, dass eine gleichzeitige Besetzung benachbarter T2- und M4-Positionen ausgeschlossen werden kann. Alle Wasserstoffionen (Protonen) sind an die Sauerstoffionen gebunden, über welche die M3- und M4-Oktaeder in a-Richtung verknüpft sind. Je nach Besetzung der angrenzenden Kationenpositionen M3, M4 und T2 sind die Protonenpositionen entweder leer (M3 besetzt) oder eine der drei Positionen ist besetzt.
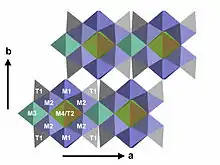
Die Staurolithstruktur kann nun als Wechsellagerung dieser beiden Schichten in b-Richtung aufgefasst werden. Eine T2-M3-M4-Schicht wird von zwei Alumosilikatschichten (T1-M1-M2) umschlossen. Die Alumosilikatschichten durchdringen die T2-M3-M4-Schicht, so dass die M2-Oktaeder der beiden Alumosilikatschichten über gemeinsame Kanten miteinander verbunden sind. Diese recht dicht gepackten Alumosilikat-T2-M3-M4-Alumosilikat-Sandwiches sind in Richtung der kristallographischen b-Achse nur über die Ecken der Silikattetraeder T1 miteinander verbunden.
Eigenschaften
Staurolith ist nur unvollkommen spaltbar, bricht uneben muschelig und zeigt in reiner Form Glas- oder Fettglanz. Die häufig anzutreffenden makroskopisch sichtbaren Kristalle haben eine säulige Erscheinungsform (Habitus). Sie sind oft größer als die Kristalle umgebender Minerale und werden dann als Porphyroblasten bezeichnet. Eine morphologische Besonderheit des Stauroliths ist, dass er häufig in einer charakteristischen Kreuzform als Kristallzwilling vorkommt; der Winkel zwischen den Kristallen beträgt entweder 90 oder ungefähr 60 Grad.
Modifikationen und Varietäten
Der früher ebenfalls zur Staurolithgruppe gezählte Lusakit gilt mittlerweile nicht mehr als eigenständiges Mineral, sondern als cobalthaltige Varietät von Staurolith. Er ist von blauer bis schwarzer Farbe mit cobaltblauer Strichfarbe und wurde nach seinem Fundort Lusaka in Sambia benannt.[2][3]
Bildung und Fundorte

Eisenreicher Staurolith ist ein charakteristischer Bestandteil amphibolithfazieller metamorpher Pelite, vorwiegend von Glimmerschiefern. Hier tritt er zusammen mit Mineralen der Glimmergruppe (Muskovit, Biotit), Granatgruppe (Almandin), Alumosilikate (Kyanit, Sillimanit, Andalusit), Quarz sowie Chloritoid und Chloritgruppe auf.
Bei aufsteigender Metamorphose bildet sich Staurolith ab etwa 500 °C aus Chloritoid über verschiedene Mineralreaktionen, zum Beispiel gemäß der Reaktionsgleichung
- Chloritoid + Alumosilikat = Staurolith + Chlorit + Wasser
Bei Temperaturen zwischen 600 °C und 750 °C wird Staurolith über diverse Mineralreaktionen wieder abgebaut, etwa gemäß der Gleichung
- Staurolith + Muskovit + Quarz = Granat + Biotit + Alumosilikat + Wasser
Der Stabilitätsbereich von eisenreichen Staurolithen ist daher auf einen engen Temperaturbereich (500 °C – 750 °C) beschränkt. Gesteine, deren Metamorphose diesen Temperaturbereich nicht erreicht oder diesen überschritten hat, enthalten keinen Staurolith. Dies macht eisenreichen Staurolith zu einem Indexmineral für mittelgradige Metamorphose von Peliten (tonigen Sedimenten).
Die Gleichgewichtslagen der Staurolith-bildenden und Staurolith-abbauenden Reaktionen schneiden sich bei etwa 600 °C und 15 Kilobar. Dies bedeutet, dass eisenreiche Staurolithe oberhalb dieses Druckes, der einer Tiefe von etwa 50 Kilometern entspricht, nicht mehr vorkommen.
Die Stabilität von Staurolith hängt stark von dessen Zusammensetzung ab. Einbau von Magnesium statt Eisen verschiebt das Stabilitätsfeld von Staurolith zu höheren Drücken und Temperaturen, Einbau von Zink statt Eisen erweitert die Staurolithstabilität zu höheren Drücken und kleineren Temperaturen.
Daneben kommt Staurolith aufgrund seiner großen Härte und Verwitterungsbeständigkeit auch in Flusssedimenten als Seifenmineral vor.
Fundorte liegen innerhalb Europas in der Steiermark in Österreich und im italienischen Südtirol, dort insbesondere bei Sterzing, daneben bei Monte Campione in der Schweiz, in der Bretagne in Frankreich, im Spessart sowie in Schottland. In Amerika ist Staurolith unter anderem in den US-Bundesstaaten Georgia, Maine, Montana, New Hampshire, New Mexico, North Carolina, Tennessee und Virginia zu finden, in Afrika kommt er in Sambia und Namibia vor, und in Russland lässt er sich zum Beispiel im Keivy-Gebirge auf der Kola-Halbinsel nachweisen.
Verwendung

Staurolith bildet nur selten Kristalle in guter Schmuckstein-Qualität aus, die dann in verschiedenen Schliffformen vor allem für Sammler angeboten werden. In North Carolina werden die typischen kreuzförmigen Kristallzwillinge regional unter dem Namen Elfenstein (fairy stone) als Amulette verkauft.
Die Varietät Lusakit wird im afrikanischen Sambia abgebaut und als blaues Pigment genutzt.
Siehe auch
Literatur
- M. A. Marzouki, B. Souvignier, M. Nespolo: The staurolite enigma solved. In: Acta Crystallographica. A70, Nr. 4, 2014, S. 348–353, doi:10.1107/S2053273314007335.
- F. C. Hawthorne, L. Ungaretti, R. Oberti, F. Caucia, A. Callegari: The crystal-chemistry of staurolites I: Crystal structure and site populations. In: Can. Mineral. Band 31, 1993, S. 551–582. (PDF)
- F. C. Hawthorne, L. Ungaretti, R. Oberti, F. Caucia, A. Callegari: The crystal-chemistry of staurolites II: Order-disorder and the monoclinic orthorhombic phase transition. In: Can. Mineral. Band 31, 1993, S. 583–596. (PDF)
- F. C. Hawthorne, L. Ungaretti, R. Oberti, F. Caucia, A. Callegari: The crystal-chemistry of staurolites III: Local order and chemical composition. In: Can. Mineral. Band 31, 1993, S. 597–616. (PDF)
- J. D. H. Donnay, G. Donnay: The staurolite story. In: Tschermaks mineralogische und petrographische Mitteilungen. Band 31, Nr. 1-2, 1983, S. 1–15, doi:10.1007/BF01084757.
- Martin Okrusch, Siegfried Matthes: Mineralogie. Eine Einführung in die spezielle Mineralogie, Petrologie und Lagerstättenkunde. 7., vollständige überarbeitete und aktualisierte Auflage. Springer Verlag, Berlin u. a. 2005, ISBN 3-540-23812-3, S. 86.
- Petr Korbel, Milan Novák: Mineralien-Enzyklopädie (= Dörfler Natur). Nebel Verlag, Eggolsheim 2002, ISBN 3-89555-076-0, S. 204.
- Walter Schumann: Edelsteine und Schmucksteine. Alle Arten und Varietäten der Welt. 1600 Einzelstücke. 13. überarbeitete und erweiterte Auflage. BLV Verlag, München u. a. 2002, ISBN 3-405-16332-3, S. 228.
Weblinks
- Mineralienatlas:Staurolith (Wiki)
- Webmineral – Staurolite (englisch)
- MinDat – Staurolite (englisch)
Einzelnachweise
- IMA/CNMNC List of Mineral Names (englisch, PDF 1,8 MB)
- Hans Jürgen Rösler: Lehrbuch der Mineralogie. 4., durchgesehene und erweiterte Auflage. Deutscher Verlag für Grundstoffindustrie, Leipzig 1979, ISBN 3-342-00288-3, S. 490.
- Helmut Schröcke, Karl-Ludwig Weiner: Mineralogie. Ein Lehrbuch auf systematischer Grundlage. de Gruyter, Berlin/ New York 1981, ISBN 3-11-006823-0, S. 700.
