Resveratrol
Resveratrol ist eine organische Verbindung mit der Summenformel C14H12O3 aus der Gruppe der Polyphenole. Es zählt zu den Phytoalexinen mit antioxidativen Eigenschaften.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
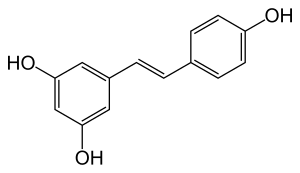 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Resveratrol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C14H12O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 228,25 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
254 °C (Zersetzung)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte und Namensgebung
Die Erstbeschreibung und Benennung als Resveratrol erfolgte in Japan im Jahr 1939 durch Michio Takaoka.[5][6] Er isolierte die Verbindung aus der Heilpflanze Veratrum grandiflorum. Im Jahr 1963 wurde Resveratrol aus den Wurzeln von Reynoutria japonica isoliert.[7][8] Der Name Resveratrol kann als Kofferwort aufgefasst werden, der aufgrund der chemischen Verwandtschaft aus der ersten Silbe der Bezeichnung von Resorcinolen, dem Gattungsnamen Veratrum und der systematischen Endung „-ol“ für Alkohole zusammengesetzt ist. 1976 gelang der Nachweis von Resveratrol in Weinbeeren.
Vorkommen
In der Natur existieren beide Isomere des Resveratrols, wobei die trans-Form weitaus häufiger vorkommt als die cis-Form. Daneben existieren auch noch die abgeleiteten Glucoside, die auch als Piceide bezeichnet werden.
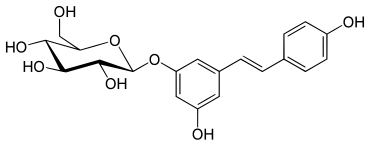
Resveratrol findet sich in einer Anzahl von Pflanzen und pflanzlichen Lebensmitteln, vor allem in Weintrauben, Himbeeren, Maulbeeren, Pflaumen, Erdnüssen[7] und im Japanischen Staudenknöterich.[9] Resveratrol wurde in mindestens 72 Pflanzenarten gefunden.[10] In Rotwein (vor allem im Pinot Noir und im St. Laurent, unabhängig vom Anbaugebiet) ist die Konzentration im Allgemeinen höher als in Weißwein. Die Konzentration liegt bei zwischen 0 und 14,3 mg/l trans-Resveratrol.[11] Weißwein und Rosé enthalten niedrigere Konzentrationen an Resveratrol, aber im Verhältnis mehr cis-Resveratrol.[12]
| Produkt | Resveratrol (mg pro 100 ml bzw. g)[13] | |
|---|---|---|
| Mittelwert | Spanne | |
| Preiselbeere | 3,0 | 3,0-3,0 |
| Rote Johannisbeere | 1,57 | 1,75-1,75 |
| Erdbeeren | 0,35 | 0,35-0,35 |
| Rotwein | 0,27 | 0 – 2,78 |
| Roséwein | 0,12 | 0,005 – 0,29 |
| Weißwein | 0,04 | 0,00 – 0,17 |
| Schaumwein | 0,009 | 0,008 – 0,01 |
| Traubensaft (weiß) | 0,00508 | 0,00 – 0,01 |
In seiner Funktion als Phytoalexin schützt es Pflanzen in feuchten Perioden vor Parasiten und Pilzinfektionen. So wird es von den Rebstöcken hauptsächlich in den Blättern und Beerenschalen bei Befall durch falschen Mehltau oder Botrytis gebildet. Stress, wie beispielsweise ultraviolettes Licht, führt ebenfalls zu erhöhter Resveratrolbildung.
Eigenschaften

Resveratrol ist ein in Alkohol und Ölen gut und in Wasser gering löslicher weißer Feststoff. Chemisch gesehen ist Resveratrol ein Stilbenoid, ein Derivat des Stilben. In Pflanzen wird es unter der katalytischen Einwirkung des Enzyms Stilbensynthase produziert.[14]
Resveratrol kommt als trans- und cis-Isomer vor. Die trans-Form kann unter Einwirkung von UV-Strahlung in die cis-Form umgewandelt werden.[15] trans-Resveratrol ist die stabilere Form der beiden Isomeren.[16]
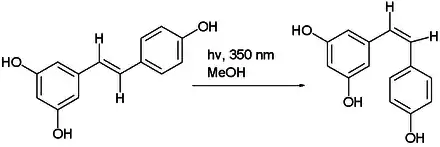
In der Haut von Trauben, wie im Trester, übersteht Resveratrol den Gärungsprozess und lange Lagerzeiten.[17]
Biochemie
Resveratrol wurde als Pan-Assay-Interferenzmaterial identifiziert, das in vielen verschiedenen Laboruntersuchungen positive Ergebnisse liefert.[18] Seine Fähigkeit zu vielfältigen Interaktionen kann auf direkte Auswirkungen auf Zellmembranen zurückzuführen sein.[19] Bis 2015 wurden viele spezifische biologische Ziele für Resveratrol identifiziert, darunter NQO2 (allein und in Interaktion mit AKT1), GSTP1, Östrogenrezeptor beta, CBR1 und Integrin αVβ. Es war damals unklar, ob einer oder alle dieser Faktoren für die beobachteten Effekte in Zellen und Modellorganismen verantwortlich sind.[20]
In vitro-Studien deuten darauf hin, dass Resveratrol Sirtuin 1 aktiviert, obwohl dies ein gerichteter Effekt von seinen unmittelbaren biologischen Ziel(en) sein kann.[21][22] Die Signaltransduktion scheint über PGC-1α zu laufen, wodurch Mitochondrien betroffen sind.[23] In Zellen, die mit Resveratrol behandelt wurden, wurde ein Anstieg der Wirkung von MnSOD (SOD2)[24] und der GPER-Aktivität beobachtet.[25] In vitro zeigte sich Resveratrol als Agonist von Peroxisom proliferatoraktiviertem Rezeptor-Gamma (PPARG), einem Kernrezeptor aus der pharmakologischen Forschung zur möglichen Behandlung von Typ-2-Diabetes.[26] Resveratrol erhöht die Konzentrationen der Serum- und der Knochen-alkalischen Phosphatase.[27]
Eine Möglichkeit, Resveratrol beim Menschen zu verabreichen, kann durch direkte Absorption über den Speichel sein. Die Funktionsfähigkeit einer solchen Applikationsmethode ist jedoch aufgrund der geringen Wasserlöslichkeit des Moleküls unwahrscheinlich.[28][29] Die Bioverfügbarkeit von Resveratrol liegt aufgrund der umfangreichen hepatischen Glucuronidierung und Sulfatierung bei etwa 0,5 %.[30] Resveratrol wird im Körper weitgehend verstoffwechselt, mit der Leber und der Lunge als Hauptorte seines Stoffwechsels.[31]
Wirkung
Bis 2019 hat die über Jahrzehnte hinweg durchgeführte umfangreiche Forschung zu Resveratrol in zahlreichen Labormodellen menschlicher Krankheiten keine Anti-Krankheitswirkung in randomisierten klinischen Studien auf den Menschen gezeigt.[32][33] In-vitro-Studien haben Hinweise auf eine mögliche Wirksamkeit gegen Krebszellen erbracht. Andere Studien haben denkbare positive Effekte der Substanz bei Krankheiten wie Arteriosklerose, Herzkrankheiten, auf Proteine, die mit der Alzheimer-Krankheit[34] in Verbindung gebracht werden, bei Arthritis und manchen Autoimmunkrankheiten zeigen können.
Langlebigkeit
Es gibt bislang keine ausreichenden Beweise für eine Wirkung von Resveratrol auf die Langlebigkeit beim Menschen.[32][33][35][36] Eine systematische Überprüfung (Meta-Analyse) der bestehenden Resveratrol-Forschung im Jahr 2011 ergab, dass es weder genügend Beweise für ihre Wirkung auf Langlebigkeit oder menschliche Krankheiten gab, noch Empfehlungen für die Aufnahme über die üblicherweise aus diätetischen Quellen erhaltene Menge hinaus geben konnte, die auf weniger als 4 mg/Tag geschätzt wurde.[37] Ein Großteil der Untersuchungen mit positiven Auswirkungen wurde an Tieren durchgeführt, wobei die klinische Forschung am Menschen unzureichend war.[33][37] Ebenso erfolgte eine Meta-Analyse 2012.[38] Resveratrol wird weiterhin an Tieren und Menschen erforscht.[39][40] Resveratrol fördert, genauso wie eine kalorienarme Ernährung (Kalorienrestriktion), die Expression der Sirtuin-Gene wie Sir2. Dadurch wurde in manchen Studien bei verschiedenen Versuchstieren eine lebensverlängernde Wirkung beobachtet.[41] Mehrere Versuche diese Studien zu wiederholen scheiterten, es gab aber auch eine erfolgreiche Wiederholung.[42] In einer Tierversuchsstudie bekamen Mäuse eine besonders fettreiche Diät. Die gleichzeitige Gabe von Resveratrol verringerte dabei deutlich die Gewichtszunahme. Unter besonders hohen Resveratrol-Dosen konnte eine Verdoppelung der Ausdauerleistung beobachtet werden.[43][44]
Krebs
Es gibt bislang keine ausreichenden Beweise für eine Anti-Krebs-Wirkung von Resveratrol bei Menschen.[33][45] Auch wenn hohe Dosen von Resveratrol verwendet werden, sind die Ergebnisse von Studien an Versuchstieren oder klinischen Studien am Menschen über die Auswirkungen von Resveratrol auf Krebs inkonsistent.[45][46] Resveratrol könnte bei der Abtötung von Krebszellen helfen, indem es hemmend auf ein Protein einwirkt, welches für das Überleben von Krebszellen entscheidend ist. Dieses als NF-κB (Nukleärer Faktor kappa B) bezeichnete Schlüsselprotein findet sich in den Kernen aller Zellen. Dort ist es verantwortlich für die Aktivierung von Genen, die für das Überleben der Zellen verantwortlich sind. Resveratrol wirkt so auf NF-κB ein, dass dieses seine überlebensfördernde Wirkung nicht mehr entfalten kann.[47] Dies wiederum leitet bei den betroffenen Krebszellen die Apoptose, d. h. Selbstzerstörung ein. Forscher hoffen, dass der Einsatz von NF-κB-Inhibitoren wie Resveratrol die Wirksamkeit bereits etablierter Therapieansätze gegen Krebs deutlich steigern kann. Allerdings könnte die Wasserunlöslichkeit von Resveratrol noch ein Problem darstellen: Möglicherweise kann es vom Körper nicht in ausreichender Menge resorbiert werden und so seine Wirkung gegen Krebs und Herz-Kreislauf-Erkrankungen nicht ausreichend entfalten. Neueste Erkenntnisse zeigen auch eine vom NF-kB unabhängige Wirkung des Resveratrols auf diverse Krebszellen. So bewirkt es in diesen eine Senkung der Expression des Proteins Bcl-2, welches die entarteten Zellen vor dem Zelltod schützt. Gleichzeitig konnte man eine erhöhte Expression des zelltodfördernden (proapoptotischen) Proteins Bax feststellen.[48]
In Zusammenhang mit Krebs muss stets erwähnt werden, dass die meisten Studien mit Resveratrol in vitro oder in Tiermodellen gemacht wurden. Es herrscht ein Mangel an klinischen Studien, und mögliche Interaktionen mit einer Chemotherapie sollten stets bedacht und genau erwogen werden. Zwei Studien verdeutlichen diesen Aspekt. In Ratten, denen humane Krebszellen implantiert wurden, hat Resveratrol die Wirkung der Chemotherapeutika Cisplatin und Doxorubicin verbessert und gleichzeitig eine kardioprotektive Wirkung entfaltet, also die Herzzellen vor der Toxizität dieser Wirkstoffe geschützt.[49] Wurde Resveratrol gleichzeitig mit dem Wirkstoff Paclitaxel (Taxol) gegen Krebszellen in vitro verabreicht, so schwächte es die krebstötende Wirkung des Paclitaxel ab. Dies ist darauf zurückzuführen, dass Resveratrol den Eintritt der Krebszellen in die S-Phase des Zellzyklus hemmt und die Wirkung des Paclitaxel sich genau in dieser Phase entfaltet. Die Vorbehandlung der Krebszellen zu einem früheren Zeitpunkt, also vor der Chemotherapie mit Paclitaxel, führte wiederum zu einer synergistischen Wirkung und verursachte einen vermehrten Zelltod der behandelten Krebszellen.[50]
Neurologische Studien
Resveratrol wird derzeit auf sein Potenzial hin untersucht, Folgeschäden nach Ischämie zu begrenzen, wie Schlaganfall oder akutes Hirntrauma,[51] und seine mögliche Auswirkung auf die Kognition.[52] Die Aktivierung von NF-κB spielt auch im Krankheitsverlauf der Multiplen Sklerose eine Rolle. NF-κB-Inhibitoren könnten deshalb auch hier in Zukunft eine therapeutische Option darstellen.[53][54] Resveratrol könnte eine neuroprotektive Wirkung beim Glaukom haben.[55] Ein erhöhter Augeninnendruck erhöht den oxidativen Stress an der Netzhaut und Trabekelmaschenwerk.[56] Dieser führt zu erhöhten Entzündungsmarkern wie Interleukin-1α, Interleukin-6, Interleukin-8 und zur schnelleren Zellalterung durch oxidative Spezies wie Lipofuscin in den Zellen des Trabekelmaschenwerkes und des Sehnerves. Resveratrol verringert die Expression dieser Stoffe und wirkt daher antioxidativ und antiapoptotisch im Trabekelmaschenwerk und in den Neuronen des Sehnerves.[57]
Herz-Kreislauf-Studien
Es gibt bislang keine ausreichenden Beweise für eine Wirkung von Resveratrol bei Herz-Kreislauf-Erkrankungen.[33][58] Eine Meta-Analyse von 2015 fand eine Abnahme des systolischen Blutdrucks um 11,9 mmHg bei Resveratrol-Dosen von 150 mg/Tag.[59] Eine 2018er Meta-Analyse ergab dagegen keinen Einfluss auf systolischen oder diastolischen Blutdruck; eine Teilanalyse ergab einen systolischen Druckabfall von 2 mmHg nur durch Resveratroldosen von 300 mg pro Tag und nur bei diabetischen Menschen.[60] Eine Meta-Analyse 2015 fand keinen Effekt auf den systolischen oder diastolischen Blutdruck; eine Unteranalyse fand eine 11,90-mmHg-Reduktion des systolischen Blutdrucks aus Resveratroldosen von 150 mg pro Tag.[59] Im Tierexperiment war Resveratrol in der Lage, die Aortenwurzeldiameter bei Mäusen mit Marfan-Syndrom signifikant zu reduzieren.[61] Resveratrol hat keinen Einfluss auf die Blutfettwerte.[62]
Diabetes
Eine Überprüfung im Jahr 2015 ergab wenig Beweise für den Einsatz von Resveratrol zur Behandlung von Diabetes mellitus.[63] Eine Meta-Analyse aus dem Jahr 2015 ergab wenig Hinweise auf eine Wirkung von Resveratrol auf Diabetes Biomarker.[64] Es gibt keine ausreichenden Beweise für einen Einfluss von Resveratrol auf das metabolische Syndrom.[33][65][64][66]
Haut
Trotz umfangreicher In-vitro- und Tierforschung gibt es keine Beweise dafür, dass Resveratrol, das oral oder topisch eingenommen wird, irgendeine Wirkung auf die menschliche Haut hat.[67] Es wurden Vorstudien über Resveratrol durchgeführt, um sein Potenzial als Therapie für Melanom zu untersuchen.[68][69]
Nebenwirkungen
In einer klinischen Studie zur Alzheimer-Krankheit und Resveratrol waren die häufigsten Nebenwirkungen Durchfall, Gewichtsverlust und Übelkeit.[52] In einer Studie zu Blutdruck und Resveratrol wurde eine verstärkte Darmperistaltik und weicher Stuhl beschrieben, sowie bei einer Person ein juckender Ausschlag.[60]
Handel
Mittlerweile kann man Resveratrol-Präparate in den USA als Nahrungsergänzungsmittel im freien Verkauf erwerben. Auch in Deutschland werden inzwischen Resveratrol-Präparate, meist aus Weintraubenextrakt, produziert und zum Kauf angeboten. Der Pharmakonzern GlaxoSmithKline kaufte für 720 Millionen US-Dollar die auf die Herstellung von Resveratrol und andere Wirkstoffe aus dem Anti-Aging-Bereich spezialisierte Biotechfirma Sirtris.[70] Doch die Hoffnungen erfüllten sich nicht, so dass der Konzern sein Engagement rund um Resveratrol 2011 beendete.[71]
Seit 2016 stellt die Firma EVOLVA Resveratrol mit Hilfe von Fermentation her.[72]
Chinesische Wissenschaftler haben durch Einschleusung eines zusätzlichen Gens der Stilbensynthase eine Rebsorte entwickelt, die sechsmal so viel Resveratrol in den Rotwein-Trauben aufweist wie die Ausgangssorte.[73] Zudem kann das Gen in andere Pflanzen eingeschleust werden, die dann Resveratrol produzieren. Dies wurde versuchsweise bei Silber-Pappeln (Populus alba) erfolgreich durchgeführt.[74]
Literatur
- N. Namasivayam: Chemoprevention in experimental animals. In: Annals of the New York Academy of Sciences. Band 1215, Januar 2011, S. 60–71; doi:10.1111/j.1749-6632.2010.05873.x; PMID 21261642. (Review).
- Fan Yeung, Jamie E. Hoberg, Catherine S. Ramsey, Michael D. Keller, David R. Jones, Roy A. Frye, Marty W. Mayo: Modulation of NF‐κB‐dependent transcription and cell survival by the SIRT1 deacetylase. In: EMBO J. 23, 2004, S. 2369–2380; doi:10.1038/sj.emboj.7600244; PMID 15152190; PMC 423286 (freier Volltext).
- M. Jang u. a.: Cancer Chemopreventive Activity of Resveratrol, a Natural Product Derived from Grapes. In: Science. 275, 1997, S. 218–220; doi:10.1126/science.275.5297.218; PMID 8985016.
- National Toxicology Program des NIH: Resveratrol (Memento vom 11. Januar 2012 im Internet Archive) (PDF; 1,9 MB).
- Sung-Jun Park, Faiyaz Ahmad u. a.: Resveratrol Ameliorates Aging-Related Metabolic Phenotypes by Inhibiting cAMP Phosphodiesterases. In: Cell. 148, 2012, S. 421–433; doi:10.1016/j.cell.2012.01.017; PMID 22304913; PMC 3431801 (freier Volltext).
Weblinks
- http://www.resveratrol.de/ – Stand 2015,
- https://www.trauben-zauber.de/sekundaerepflanzenstoffe/resveratrol/ – Zusammenfassung von Resveratrolstudien. Stand 2019.
- Österreichische Apotheker-Zeitung: Mediterrane sekundäre Pflanzenstoffe Resveratrol, Olivenpolyphenole und Lycopin in der Prävention altersbedingter Erkrankungen – Rotwein, Oliven, Tomaten (Memento vom 15. Dezember 2006 im Internet Archive), 60(4), 2006, S. 182.
- Lebenserhaltende Maßnahme: Rotwein trinken. Auf: wissenschaft.de vom 7. Februar 2006. Über eine in der Fachzeitschrift Current Biology (2006) veröffentlichte Studie.
- Bernd Kleine-Gunk: Resveratrol: Schlüssel für ein langes Leben? In: Pharmazeutische Zeitung. 29/2007.
- Chemie im Alltag: In vino vis vitalis – liegt im Rotwein die Lebenskraft?
- Volker Mrasek: Resveratrol: Pflanzlicher Abwehrstoff mit wundersamen Wirkungen, Deutschlandfunk – Forschung Aktuell (Molekül der Woche), 19. Oktober 2011.
- J. Blech: Heilkraft des Hungerns. In: Der Spiegel. 50, 2006, vom 11. Dezember 2006, S. 154–156.
Einzelnachweise
- Eintrag zu RESVERATROL in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Datenblatt Resveratrol (PDF) bei Calbiochem, abgerufen am 7. Dezember 2015.
- Eintrag zu Resveratrol in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Datenblatt Resveratrol bei Sigma-Aldrich, abgerufen am 19. Dezember 2021 (PDF).
- Takaoka M: Resveratrol, a New Phenolic Compound, from Veratrum grandiflorum. In: Journal of the Chemical Society of Japan. 60, Nr. 11, 1939, S. 1090–1100. doi:10.1246/nikkashi1921.60.1090.
- Michio Takaoka: The Phenolic Substances of White Hellebore (Veratrum Grandiflorum Loes. Fill). V. In: Nippon Kagaku Kaishi. 61, Nr. 10, 1940, S. 1067–1069. doi:10.1246/nikkashi1921.61.1067.
- J. M. Sales, A. V. Resurreccion: Resveratrol in peanuts. In: Critical Reviews in Food Science and Nutrition. Band 54, Nummer 6, 2014, S. 734–770, doi:10.1080/10408398.2011.606928, PMID 24345046.
- Nonomura, Kanagawa: Chemical constituents of Polygonaceous plants. I. studies on the components of Ko-jo-kon. (Polygonum cuspidatum SIEB et ZUCC). In: Yakugaku Zasshi. 83, Nr. 10, 1963, S. 988–990. doi:10.1248/yakushi1947.83.10_988.
- M. Jasiński, L. Jasińska, M. Ogrodowczyk: Resveratrol in prostate diseases – a short review. In: Central European Journal of Urology. Band 66, Nummer 2, 2013, S. 144–149, doi:10.5173/ceju.2013.02.art8, PMID 24579014, PMC 3936154 (freier Volltext).
- K. P. Bhat, J. M. Pezzuto: Cancer chemopreventive activity of resveratrol. In: Annals of the New York Academy of Sciences. Band 957, Mai 2002, S. 210–229, doi:10.1111/j.1749-6632.2002.tb02918.x, PMID 12074974.
- Ulrik Stervbo, Ole Vang, Christine Bonnesen: A review of the content of the putative chemopreventive phytoalexin resveratrol in red wine. In: Food Chemistry. 101, 2007, S. 449, doi:10.1016/j.foodchem.2006.01.047.
- Raul Zamora-Ros, Cristina Andres-Lacueva, Rosa M. Lamuela-Raventós, Toni Berenguer, Paula Jakszyn, Carmen Martínez, María J. Sánchez, Carmen Navarro, María D. Chirlaque, María-José Tormo, Jose R. Quirós, Pilar Amiano, Miren Dorronsoro, Nerea Larrañaga, Aurelio Barricarte, Eva Ardanaz, Carlos A. González: Concentrations of resveratrol and derivatives in foods and estimation of dietary intake in a Spanish population: European Prospective Investigation into Cancer and Nutrition (EPIC)-Spain cohort. In: British Journal of Nutrition. 100, 2008, S. 188, doi:10.1017/S0007114507882997.
- Showing all foods in which the polyphenol Resveratrol is found - Phenol-Explorer. In: phenol-explorer.eu. Abgerufen am 14. November 2019.
- K. Hanhineva u. a.: Stilbene synthase gene transfer caused alterations in the phenylpropanoid metabolism of transgenic strawberry (Fragaria x ananassa). In: J Exp Bot. 60, 2009, S. 2093–2106; PMID 19443619.
- R. M. Lamuela-Raventos: Direct HPLC Analysis of cis- and trans-Resveratrol and Piceid Isomers in Spanish Red Vitis vinifera Wines. In: J Agric Food Chem 43, 1995, S. 281–283; doi:10.1021/jf00050a003.
- J. Prokop u. a.: Resveratrol and its glycon piceid are stable polyphenols. In: J Med Food. 9, 2006, S. 11–14; doi:10.1089/jmf.2006.9.11; PMID 16579722.
- A. A. Bertelli u. a.: Stability of resveratrol over time and in the various stages of grape transformation. In: Drugs Exp Clin Res. 24, 1998, S. 207–211; PMID 10051967.
- J. Baell, M. A. Walters: Chemistry: Chemical con artists foil drug discovery. In: Nature. Band 513, Nummer 7519, September 2014, S. 481–483, doi:10.1038/513481a, PMID 25254460.
- H. I. Ingólfsson, P. Thakur, K. F. Herold, E. A. Hobart, N. B. Ramsey, X. Periole, D. H. de Jong, M. Zwama, D. Yilmaz, K. Hall, T. Maretzky, H. C. Hemmings, C. Blobel, S. J. Marrink, A. Koçer, J. T. Sack, O. S. Andersen: Phytochemicals perturb membranes and promiscuously alter protein function. In: ACS Chemical Biology. Band 9, Nummer 8, August 2014, S. 1788–1798, doi:10.1021/cb500086e, PMID 24901212, PMC 4136704 (freier Volltext).
- O. Vang: Resveratrol: challenges in analyzing its biological effects. In: Annals of the New York Academy of Sciences. Band 1348, Nummer 1, August 2015, S. 161–170, doi:10.1111/nyas.12879, PMID 26315294.
- D. Beher, J. Wu, S. Cumine, K. W. Kim, S. C. Lu, L. Atangan, M. Wang: Resveratrol is not a direct activator of SIRT1 enzyme activity. In: Chemical Biology & Drug Design. Band 74, Nummer 6, Dezember 2009, S. 619–624, doi:10.1111/j.1747-0285.2009.00901.x, PMID 19843076.
- M. Pacholec, J. E. Bleasdale, B. Chrunyk, D. Cunningham, D. Flynn, R. S. Garofalo, D. Griffith, M. Griffor, P. Loulakis, B. Pabst, X. Qiu, B. Stockman, V. Thanabal, A. Varghese, J. Ward, J. Withka, K. Ahn: SRT1720, SRT2183, SRT1460, and resveratrol are not direct activators of SIRT1. In: Journal of Biological Chemistry. Band 285, Nummer 11, März 2010, S. 8340–8351, doi:10.1074/jbc.M109.088682, PMID 20061378, PMC 2832984 (freier Volltext).
- M. Lagouge, C. Argmann, Z. Gerhart-Hines, H. Meziane, C. Lerin, F. Daussin, N. Messadeq, J. Milne, P. Lambert, P. Elliott, B. Geny, M. Laakso, P. Puigserver, J. Auwerx: Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alpha. In: Cell. Band 127, Nummer 6, Dezember 2006, S. 1109–1122, doi:10.1016/j.cell.2006.11.013, PMID 17112576.
- L. A. Macmillan-Crow, D. L. Cruthirds: Invited review: manganese superoxide dismutase in disease. In: Free Radical Research. Band 34, Nummer 4, April 2001, S. 325–336, doi:10.1080/10715760100300281, PMID 11328670.
- E. R. Prossnitz, M. Barton: Estrogen biology: new insights into GPER function and clinical opportunities. In: Molecular and Cellular Endocrinology. Band 389, Nummer 1–2, Mai 2014, S. 71–83, doi:10.1016/j.mce.2014.02.002, PMID 24530924, PMC 4040308 (freier Volltext).
- L. Wang, B. Waltenberger, E. M. Pferschy-Wenzig, M. Blunder, X. Liu, C. Malainer, T. Blazevic, S. Schwaiger, J. M. Rollinger, E. H. Heiss, D. Schuster, B. Kopp, R. Bauer, H. Stuppner, V. M. Dirsch, A. G. Atanasov: Natural product agonists of peroxisome proliferator-activated receptor gamma (PPARγ): a review. In: Biochemical Pharmacology. Band 92, Nummer 1, November 2014, S. 73–89, doi:10.1016/j.bcp.2014.07.018, PMID 25083916, PMC 4212005 (freier Volltext).
- M. Asis, N. Hemmati, S. Moradi, K. C. Nagulapalli Venkata, E. Mohammadi, M. H. Farzaei, A. Bishayee: Effects of resveratrol supplementation on bone biomarkers: a systematic review and meta-analysis. In: Annals of the New York Academy of Sciences. [elektronische Veröffentlichung vor dem Druck] September 2019, doi:10.1111/nyas.14226, PMID 31490554.
- N. V. Madhav, A. K. Shakya, P. Shakya, K. Singh: Orotransmucosal drug delivery systems: a review. In: Journal of Controlled Release : official journal of the Controlled Release Society. Band 140, Nummer 1, November 2009, S. 2–11, doi:10.1016/j.jconrel.2009.07.016, PMID 19665039.
- A. C. Santos, F. Veiga, A. J. Ribeiro: New delivery systems to improve the bioavailability of resveratrol. In: Expert Opinion on Drug Delivery. Band 8, Nummer 8, August 2011, S. 973–990, doi:10.1517/17425247.2011.581655, PMID 21668403.
- T. Walle, F. Hsieh, M. H. DeLegge, J. E. Oatis, U. K. Walle: High absorption but very low bioavailability of oral resveratrol in humans. In: Drug Metabolism and Disposition: The Biological Fate of Chemicals. Band 32, Nummer 12, Dezember 2004, S. 1377–1382, doi:10.1124/dmd.104.000885, PMID 15333514.
- S. Sharan, S. Nagar: Pulmonary metabolism of resveratrol: in vitro and in vivo evidence. In: Drug Metabolism and Disposition: The Biological Fate of Chemicals. Band 41, Nummer 5, Mai 2013, S. 1163–1169, doi:10.1124/dmd.113.051326, PMID 23474649, PMC 3629805 (freier Volltext).
- Resveratrol. Micronutrient Information Center, Linus Pauling Institute, Oregon State University, Corvallis, OR. 11. Juni 2015. Abgerufen am 26. August 2019.
- Resveratrol. MedlinePlus, National Library of Medicine, US National Institutes of Health. 1. April 2019. Abgerufen am 22. September 2019.
- K. Ono, M. M. Condron, L. Ho u. a.: Effects of grape seed-derived polyphenol on amyloid beta-protein self-assembly and cytotoxicity. In: Journal of Biological Chemistry 283, 2008, S. 32176–32187; doi:10.1074/jbc.M806154200; PMID 18815129; PMC 2583320 (freier Volltext).
- Fernández AF, Fraga MF, Fraga: The effects of the dietary polyphenol resveratrol on human healthy aging and lifespan. In: Epigenetics. 6, Nr. 7, Jul 2011, S. 870–874. doi:10.4161/epi.6.7.16499. PMID 21613817.
- H. R. Warner: NIA's Intervention Testing Program at 10 years of age. In: Age. Band 37, Nummer 2, 2015, S. 22, doi:10.1007/s11357-015-9761-5, PMID 25726185, PMC 4344944 (freier Volltext).
- O. Vang, N. Ahmad, C. A. Baile, J. A. Baur, K. Brown, A. Csiszar, D. K. Das, D. Delmas, C. Gottfried, H. Y. Lin, Q. Y. Ma, P. Mukhopadhyay, N. Nalini, J. M. Pezzuto, T. Richard, Y. Shukla, Y. J. Surh, T. Szekeres, T. Szkudelski, T. Walle, J. M. Wu: What is new for an old molecule? Systematic review and recommendations on the use of resveratrol. In: PLOS ONE. Band 6, Nummer 6, 2011, S. e19881, doi:10.1371/journal.pone.0019881, PMID 21698226, PMC 3116821 (freier Volltext).
- K. L. Hector, M. Lagisz, S. Nakagawa: The effect of resveratrol on longevity across species: a meta-analysis. In: Biology Letters. Band 8, Nummer 5, Oktober 2012, S. 790–793, doi:10.1098/rsbl.2012.0316, PMID 22718956, PMC 3440975 (freier Volltext).
- Pangeni R, Sahni JK, Ali J, Sharma S, Baboota S, Sahni, Ali, Sharma, Baboota: Resveratrol: review on therapeutic potential and recent advances in drug delivery. In: Expert Opinion on Drug Delivery. 11, Nr. 8, 2014, S. 1285–1298. doi:10.1517/17425247.2014.919253. PMID 24830814.
- J. Tomé-Carneiro, M. Larrosa, A. González-Sarrías, F. A. Tomás-Barberán, M. T. García-Conesa, J. C. Espín: Resveratrol and clinical trials: the crossroad from in vitro studies to human evidence. In: Current Pharmaceutical Design. Band 19, Nummer 34, 2013, S. 6064–6093, doi:10.2174/13816128113199990407, PMID 23448440, PMC 3782695 (freier Volltext).
- D. A. Sinclair und L. Guarente: Schlüssel zur Langlebigkeit. In: Spektrum der Wissenschaft. Oktober 2006, S. 34–41.
- B. P. Hubbard, A. P. Gomes, H. Dai, J. Li, A. W. Case, T. Considine, T. V. Riera, J. E. Lee, S. Y. E, D. W. Lamming, B. L. Pentelute, E. R. Schuman, L. A. Stevens, A. J. Y. Ling, S. M. Armour, S. Michan, H. Zhao, Y. Jiang, S. M. Sweitzer, C. A. Blum, J. S. Disch, P. Y. Ng, K. T. Howitz, A. P. Rolo, Y. Hamuro, J. Moss, R. B. Perni, J. L. Ellis, G. P. Vlasuk, D. A. Sinclair: Evidence for a Common Mechanism of SIRT1 Regulation by Allosteric Activators. In: Science. 339, 2013, S. 1216–1219, doi:10.1126/science.1231097.
- R. Khamsi: Red wine compound boosts athletic endurance. In: New Scientist. vom 16. November 2006.
- M. Lagouge u. a.: Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alpha. In: Cell. 127, 2006, S. 1109–1122, doi:10.1016/j.cell.2006.11.013, PMID 17112576.
- L. G. Carter, J. A. D'Orazio, K. J. Pearson: Resveratrol and cancer: focus on in vivo evidence. In: Endocrine-Related Cancer. Band 21, Nummer 3, Juni 2014, S. R209–R225, doi:10.1530/ERC-13-0171, PMID 24500760, PMC 4013237 (freier Volltext).
- M. Athar, J. H. Back, X. Tang, K. H. Kim, L. Kopelovich, D. R. Bickers, A. L. Kim: Resveratrol: a review of preclinical studies for human cancer prevention. In: Toxicology and Applied Pharmacology. Band 224, Nummer 3, November 2007, S. 274–283, doi:10.1016/j.taap.2006.12.025, PMID 17306316, PMC 2083123 (freier Volltext).
- U. P. Singh u. a.: Resveratrol (trans-3, 5, 4'-trihydroxystilbene) induces SIRT1 and down-regulates NF-κB activation to abrogate DSS-induced colitis. In: J Pharmacol Exp Ther. November 2009; doi:10.1124/jpet.109.160838; PMID 19940103; PMC 2835444 (freier Volltext).
- H. B. Zhou u. a.: Anticancer activity of resveratrol on implanted human primary gastric carcinoma cells in nude mice In: World J Gastroenterol. 2005, S. 280–284; doi:10.3748/wjg.v11.i2.280; PMID 15633232; PMID 15633232.
- Y. A. Rezk u. a.: Use of resveratrol to improve the effectiveness of cisplatin and doxorubicin: study in human gynecologic cancer cell lines and in rodent heart. In: Am J Obstet Gynecol. 2006, S. e23–e26; doi:10.1016/j.ajog.2005.11.030; PMID 16647892.
- Q.Q. Mao u. a.: Resveratrol confers resistance against taxol via induction of cell cycle arrest in human cancer cell lines. In: Molecular Nutrition & Food Research. 2010, S. 1574–1584; doi:10.1002/mnfr.200900392 PMID 20521268.
- M. S. Lopez, R. J. Dempsey, R. Vemuganti: Resveratrol neuroprotection in stroke and traumatic CNS injury. In: Neurochemistry International. Band 89, Oktober 2015, S. 75–82, doi:10.1016/j.neuint.2015.08.009, PMID 26277384, PMC 4587342 (freier Volltext).
- T. Ahmed, S. Javed, S. Javed, A. Tariq, D. Šamec, S. Tejada, S. F. Nabavi, N. Braidy, S. M. Nabavi: Resveratrol and Alzheimer's Disease: Mechanistic Insights. In: Molecular Neurobiology. Band 54, Nummer 4, 05 2017, S. 2622–2635, doi:10.1007/s12035-016-9839-9, PMID 26993301.
- Die Auswirkungen der Multiplen Sklerose mildern. (Memento vom 7. Januar 2016 im Internet Archive) Presseinformation der Georg-August-Universität Göttingen vom 9. August 2006.
- K. S. Schindler u. a.: SIRT1 activation confers neuroprotection in experimental optic neuritis. In: Invest Ophthalmol Vis Sci. 48, 2007, S. 3602–3609; doi:10.1167/iovs.07-0131; PMID 17652729; PMC 1964753 (freier Volltext).
- M. Mozaffarieh u. a.: The Potential Value of Natural Antioxidative Treatment in Glaucoma. In: J Flammer Surv Ophthalmol. 53, 2008, S. 479–505; doi:10.1016/j.survophthal.2008.06.006; PMID 18929760.
- Q. Liu u. a.: Oxidative Stress Is an Early Event in Hydrostatic Pressure–Induced Retinal Ganglion Cell Damage. In: Invest Ophthalmol Vis Sci. 48, 2007, S. 4580–4589; doi:10.1167/iovs.07-0170; PMID 1789828.
- C. Luna u. a.: Resveratrol prevents the expression of glaucoma markers induced by chronic oxidative stress in trabecular meshwork cells. In: Food Chem Toxicol. 47, 2009, S. 198–204; doi:10.1016/j.fct.2008.10.029; PMID 19027816.
- Tomé-Carneiro J, Gonzálvez M, Larrosa M, Yáñez-Gascón MJ, García-Almagro FJ, Ruiz-Ros JA, Tomás-Barberán FA, García-Conesa MT, Espín JC, Gonzálvez, Larrosa, Yáñez-Gascón, García-Almagro, Ruiz-Ros, Tomás-Barberán, García-Conesa, Espín: Resveratrol in primary and secondary prevention of cardiovascular disease: a dietary and clinical perspective. In: Annals of the New York Academy of Sciences. 1290, Nr. 1, Jul 2013, S. 37–51. bibcode:2013NYASA1290...37T. doi:10.1111/nyas.12150. PMID 23855464.
- Y. Liu, W. Ma, P. Zhang, S. He, D. Huang: Effect of resveratrol on blood pressure: a meta-analysis of randomized controlled trials. In: Clinical Nutrition. Band 34, Nummer 1, Februar 2015, S. 27–34, doi:10.1016/j.clnu.2014.03.009, PMID 24731650.
- F. Fogacci, G. Tocci, V. Presta, A. Fratter, C. Borghi, A. F. Cicero: Effect of resveratrol on blood pressure: A systematic review and meta-analysis of randomized, controlled, clinical trials. In: Critical Reviews in Food Science and Nutrition. Band 59, Nummer 10, 2019, S. 1605–1618, doi:10.1080/10408398.2017.1422480, PMID 29359958.
- Stijntje Hibender, Romy Franken, Cindy van Roomen, Anique Ter Braake, Ingeborg van der Made: Resveratrol Inhibits Aortic Root Dilatation in the Fbn1C1039G/+ Marfan Mouse Model. In: Arteriosclerosis, Thrombosis, and Vascular Biology. Band 36, Nr. 8, August 2016, S. 1618–1626, doi:10.1161/ATVBAHA.116.307841, PMID 27283746, PMC 4961273 (freier Volltext).
- F. Haghighatdoost, M. Hariri: Effect of resveratrol on lipid profile: An updated systematic review and meta-analysis on randomized clinical trials. In: Pharmacological Research. Band 129, 03, 2018, S. 141–150, doi:10.1016/j.phrs.2017.12.033, PMID 29305228.
- M. de Ligt, S. Timmers, P. Schrauwen: Resveratrol and obesity: Can resveratrol relieve metabolic disturbances? In: Biochimica et Biophysica Acta. Band 1852, Nummer 6, Juni 2015, S. 1137–1144, doi:10.1016/j.bbadis.2014.11.012, PMID 25446988.
- H. A. Hausenblas, J. A. Schoulda, J. M. Smoliga: Resveratrol treatment as an adjunct to pharmacological management in type 2 diabetes mellitus–systematic review and meta-analysis. In: Molecular Nutrition & Food Research. Band 59, Nummer 1, Januar 2015, S. 147–159, doi:10.1002/mnfr.201400173, PMID 25138371.
- Poulsen MM, Jørgensen JO, Jessen N, Richelsen B, Pedersen SB, Jørgensen, Jessen, Richelsen, Pedersen: Resveratrol in metabolic health: an overview of the current evidence and perspectives. In: Annals of the New York Academy of Sciences. 1290, Nr. 1, Jul 2013, S. 74–82. bibcode:2013NYASA1290...74P. doi:10.1111/nyas.12141. PMID 23855468.
- A. Chaplin, C. Carpéné, J. Mercader: Resveratrol, Metabolic Syndrome, and Gut Microbiota. In: Nutrients. Band 10, Nummer 11, November 2018, S. 1651, doi:10.3390/nu10111651, PMID 30400297, PMC 6266067 (freier Volltext).
- M. Ndiaye, C. Philippe, H. Mukhtar, N. Ahmad: The grape antioxidant resveratrol for skin disorders: promise, prospects, and challenges. In: Archives of Biochemistry and Biophysics. Band 508, Nummer 2, April 2011, S. 164–170, doi:10.1016/j.abb.2010.12.030, PMID 21215251, PMC 3060966 (freier Volltext)
- M. Uzarska, R. Czajkowski, R. A. Schwartz, A. Bajek, B. Zegarska, T. Drewa: Chemoprevention of skin melanoma: facts and myths. In: Melanoma Research. Band 23, Nummer 6, Dezember 2013, S. 426–433, doi:10.1097/CMR.0000000000000016, PMID 24077511.
- H. C. Pal, K. M. Hunt, A. Diamond, C. A. Elmets, F. Afaq: Phytochemicals for the Management of Melanoma. In: Mini Reviews in Medicinal Chemistry. Band 16, Nummer 12, 2016, S. 953–979, doi:10.2174/1389557516666160211120157, PMID 26864554, PMC 4980238 (freier Volltext).
- Matthew Herper: Why Glaxo Bought Sirtris. In: Forbes. 24. April 2008 (forbes.com [abgerufen am 1. September 2017]).
- Aaron Saenz: GSK Drops Resveratrol. Could the Embattled Supplement Live on in Other Forms? In: Singularity Hub. 17. Januar 2011, abgerufen am 1. September 2017.
- Cornelius and Evolva bring new fermented resveratrol to market Pressemitteilung der Evolva, abgerufen am 1. May 2021
- F. Chaohong Fan u. a.: Agrobacterium-mediated genetic transformation of grapevine (Vitis vinifera L.) with a novel stilbene synthase gene from Chinese wild Vitis pseudoreticulata. In: Plant Cell, Tissue and Organ Culture. 92, 2008, S. 197–206; doi:10.1007/s11240-007-9324-2.
- A. Giorcelli u. a.: Expression of the stilbene synthase (StSy) gene from grapevine in transgenic white poplar results in high accumulation of the antioxidant resveratrol glucosides. In: Transgenic Res. 13, 2004, S. 203–214; PMID 15359598.
