Integrine
Integrine sind Eiweißmoleküle, die in allen tierischen Zellen mit Ausnahme der Erythrozyten vorkommen. Sie sind dauerhaft in der Zellmembran verankert und durchqueren die Zellmembran. Sie zählen damit zu den Transmembranproteinen.
Übersicht
Integrine verbinden Zellen mit anderen Zellen sowie mit der Extrazellulären Matrix (EZM). Weiterhin sind sie für die Signalübermittlung zwischen Zellen und deren Umgebung bedeutsam.[1] Integrine gehören zur Gruppe der Adhäsionsmoleküle und sind Rezeptoren für extrazelluläre Proteine. Mindestens drei weitere Proteine spielen bei der Zell-Zell- und Zell-Matrix-Interaktion bzw. -Kommunikation eine wichtige Rolle – die Cadherine, CAMs (Zelladhäsionsmoleküle) und Selectine.
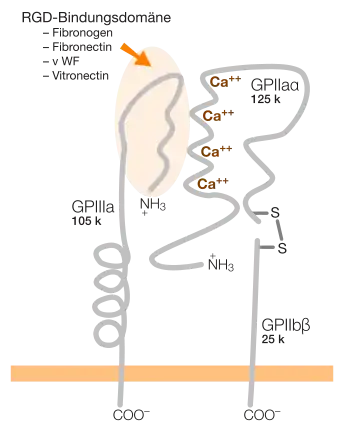
Die extrazelluläre Proteindomäne dieser Transmembranproteine hat Bindungsstellen mit einem RGD-Peptid, etwa bei Fibronektin für αVβ3 und α5β1 Integrin, oder für „Nicht-RGD-Proteine“ wie interzelluläre Adhäsionsmoleküle (ICAMs), Kollagene und Laminin (bei Epithelzellen).
Integrine sind Glykoproteine, d. h. sie tragen an ihrer Oberfläche mehrere Zuckerketten. Vom Aufbau her sind sie Heterodimere, bestehen also aus zwei verschiedenen, miteinander verbundenen Glykoprotein-Ketten. Beim Menschen lassen sich aus den bisher bekannten 18 alpha- und 8 beta-Untereinheiten 24 verschiedene Integrine aufbauen[2]. In anderen Studien wird von 19 alpha- und 8 beta-Untereinheiten ausgegangen, welche 25 Integrin-Heterodimere bilden[3]. Zusätzlich gibt es für mehrere alpha- und beta-Untereinheiten verschiedene Isoformen durch alternatives Splicing.
Es gibt verschiedene Möglichkeiten, Integrine zu unterteilen. Eine strukturelle Unterscheidung beruht auf der Präsenz einer zusätzlichen α-I-Domäne in der alpha-Untereinheit. 9 der 24 Integrine haben diese zusätzliche Domäne[4]. Integrine mit der α-I-Domäne binden an Liganden nur mittels dieser Domäne. Alle anderen Integrine (ohne die α-I-Domäne) binden Liganden dagegen gemeinsam mit der alpha- und der beta-Untereinheit. Integrine mit α-I-Domäne sind nur bei Wirbeltieren zu finden, was mit der Entstehung des inneren Skeletts und des adaptiven Immunsystems bei Wirbeltieren in Zusammenhang gebracht wird[5].
Integrine haben selbst keine enzymatische Funktion und machen keine direkte Verbindung an das Zytoskelett. Stattdessen interagieren Integrine mit einer Vielzahl von Adapterproteinen. Gemeinsam mit diesen Adaptern bilden Integrine fokale Adhäsionen (Verknüpfung zu Aktinfilamenten) bzw. Hemidesmosomen (nur α6β4-Integrin; Verknüpfung zu Intermediärfilamenten).
Integrine spielen eine wichtige Rolle bei vielen Prozessen innerhalb des Körpers. Sie können z. B. Viren binden, die gerichtete Wanderung von weißen Blutzellen in Entzündungsherde ermöglichen oder bestimmte Schritte der Blutgerinnung vermitteln.
Aktivierung und Inaktivierung von Integrinen
Die Aktivität von Integrinen unterliegt einer strikten Regulation. Physiologisch ist dies z. B. wichtig für αIIbβ3 Integrin, das an der Oberfläche von Thrombozyten zu finden ist. Eine Aktivierung dieses Integrins führt zur Bindung von Proteinen im umgebenden Blutplasma (z. B. Fibronektin und Fibrinogen) und dadurch zur Bildung eines Thrombus. Während dies wichtig bei der Wundheilung ist, führt eine fälschliche, pathologische Aktivierung zu einer Thrombose.
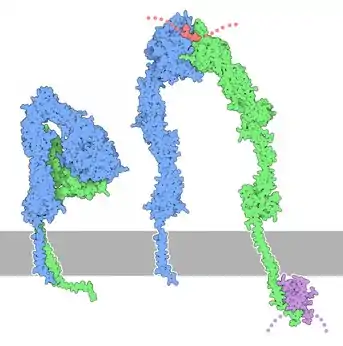
Allgemein wird die Aktivität von Integrinen von außen durch die Präsenz von Liganden oder von innen durch zelluläre Adapterproteine reguliert ("outside-in" und "inside-out" Aktivierung). Änderungen in der Aktivität sind an konformationelle Änderungen gekoppelt. Im inaktiven Zustand zeigen die Kopfdomänen beider Untereinheiten in Richtung Zellmembran, wodurch Integrine gebeugt, oder geknickt erscheinen ("bent state"). Integrin-Aktivierung führt zum Aufrichten der alpha- und beta-Untereinheit ("extended state"). Bei fortschreitender Aktivierung trennen sich die Transmembrandomänen der beiden Untereinheiten und stehen für Bindung an andere Proteine und an das Aktin-Zytoskelett bereit (siehe Abbildung)[4]. Die beiden wichtigsten Proteine für Integrin-Aktivierung sind Talin und Kindlin[6].
Über Integrin-Inaktivierung ist wesentlich weniger bekannt, als über die Aktivierung. Es gibt Adapterproteine, die Integrine im inaktiven Zustand halten. Bei aktivierten Integrinen dagegen, verlieren Talin und Kindlin ihre Bindung an das Integrin und erlauben dadurch die Rückkehr in die inaktive Konformation[7]. Eine andere Möglichkeit der Inaktivierung beinhaltet die Entfernung von Integrinen von der Zellmembran mittels Endozytose.
In der gesamten Integrinfamilie gibt es jedoch verschiedene Ausnahmen zu diesen Punkten und viele Integrine sind noch nicht ausreichend erforscht.
Wahrnehmung mechanischer und chemischer Signale
Integrine nehmen chemische Signale durch Bindung an extrazelluläre Proteine der EZM wahr oder durch intrazelluläre Adapterproteine und posttranslationale Modifikationen. In den letzten Jahren wurde aber auch für viele Integrine gezeigt, dass sie mechanische Signale wahrnehmen können. Integrine sind extrazellulär an Proteine der EZM verknüpft und intrazellulär über Adapterproteine wie Talin und Vinculin an das Aktin-Zytoskelett. Molekulare Simulationen lassen vermuten, dass Zugkraft entlang dieser EZM-Integrin-Aktin Achse zu einer stärkeren Trennung der alpha- und beta-Untereinheit innerhalb der Zelle führt. Dadurch fördert Zugkraft den aktiven Zustand von Integrinen (siehe oben zu Aktivierung und Inaktivierung von Integrinen). Für einige Integrine gibt es mittlerweile experimentelle Belege für diese Modell-Vorhersagen[8][9]. Dies hat Auswirkungen für manche Krankheiten wie Krebs oder Fibrosen, die mit einer Versteifung der EZM einhergehen.
Neben einem Einfluss von Zugkraft auf die Konformation von Integrinen, wird auch die Bindung an Liganden direkt beeinflusst. Für mehrere Integrin-Ligand Kombinationen wurde gezeigt, dass Zugkräfte die Lebensdauer der Bindung verlängern ("catch bond")[10]. Normale chemische Bindungen brechen dagegen eher bei zunehmender Zugspannung ("slip bond"). Verschiedene weitere Oberflächenrezeptoren zeigen ein ähnliches Verhalten.
Darüber hinaus sind Integrin-vermittelte fokale Adhäsionen ebenfalls sensitiv für mechanische Signale und tragen zur Wahrnehmung mechanischer Signale durch eine Zelle bei. Mittels der Verknüpfung zum Aktin-Zytoskelett sind Integrine letztlich auch mit dem Zellkern in Verbindung und nehmen Einfluss auf die Lokalisierung von Transkriptionsfaktoren und damit auf die Genregulation.
Integrine und Viren
Viele Viren nutzen Integrine zum Anheften an die Zelloberfläche bei der Aufnahme in die Zelle.[4][11] Wegen der großen Anzahl von Integrinmolekülen in der Zellmembran und deren raschen Austauschs durch Endozytose (Halbwertszeit an der Zelloberfläche unter 15 min)[12] sind sie häufig genutzte Einfallstore bei der Infektion einer Wirtszelle. Zu den Integrin-bindenden Viren gehören unter anderem Adenoviren, humanes Cytomegalovirus, Epstein-Barr-Virus, HIV-1, Maul-und-Klauenseuche-Virus, humanes Papillomavirus und Ebola-Virus.[13] Viren benutzen zur Zelladhäsion sowohl das RGD-Peptid als auch abweichende Peptid-Sequenzen, um an Integrine zu binden. SARS-CoV-2 weist im Unterschied zu SARS-CoV eine RGD-Sequenz auf.[14] Ob SARS-CoV-2 dadurch an Integrine bindet und diese zur Infektion nutzt, ist noch nicht erforscht.
Ist der Integrin-Typ, der von einem bestimmten Virus erkannt wird, bekannt, so kann man durch dessen Inhibition erfolgreich Infektionen in der Zellkultur unterdrücken. Auf Organismusebene konnte ein Schutz vor viraler Infektion durch Inhibierung von Integrinen aber noch nicht gezeigt werden.
Integrin-Antagonisten als Arzneistoffe
Die Veränderung der Bindung zwischen Integrinen und an sie bindende Moleküle ist heute zu einem wichtigen Ziel der Entwicklung neuer Arzneistoffe geworden. Anwendungsmöglichkeiten bestehen u. a. bei entzündlichen Erkrankungen (z. B. Morbus Crohn oder Colitis ulcerosa) oder in der Onkologie. Das erste Integrin-bezogene Medikament, das für den Markt zugelassen wurde, war 1994 allerdings das blutgerinnungshemmende Abciximab[4].
- Natalizumab, ein Hemmer der Bindung zwischen dem auf weißen Blutzellen vorkommenden Integrin α4β1 (VLA4 = engl. «very late antigen 4») mit VCAM-1 (engl. «vascular cell adhesion molecule 1») und Fibronektin, wurde bereits als Arzneimittel zur Behandlung der schubförmig verlaufenden multiplen Sklerose zugelassen[15]. Mit dem Rasterkraftmikroskop konnte die Bindungskraft von VLA4/VCAM-1 – Rezeptoren zwischen lebenden Zellen untersucht werden[16]. Natalizumab wurde mit einem erhöhten Risiko für die Entwicklung einer progressiven multifokalen Leukenzephalopathie (PML) in Zusammenhang gebracht[17].
- Vedolizumab ist ein humanisierter monoklonaler Antikörper aus Gruppe der Integrin-Antagonisten und in der EU und in den USA zur Behandlung von Erwachsenen mit mittelschwerer bis schwerer aktiver Colitis ulcerosa oder mittelschwerem bis schwerem aktiven Morbus Crohn zugelassen[18][19][20][21]. Vedolizumab bindet an α4β7 Integrin.
- Lifitegrast, ein Hemmer der LFA-1/ICAM-1-Interaktion wird der in der Behandlung des trockenen Auges (Keratoconjunctivitis sicca) verwendet.
Auflistung aller Integrine
| Name | Synonyme | Vorkommen | Liganden |
|---|---|---|---|
| α1β1 | VLA-1 | Fibroblasten, Osteoblasten | Kollagen |
| α2β1 | VLA-2 | Fibroblasten | Kollagen |
| α3β1 | VLA-3 | Epithelzellen | Laminin |
| α4β1 | VLA-4 | VCAM, Fibronektin | |
| α4β7 | VCAM | ||
| α5β1 | VLA-5; Fibronektin Rezeptor | Fibroblasten, Endothelzellen | Fibronektin |
| α6β1 | VLA-6; Laminin Rezeptor | Epithelzellen | Laminin |
| α6β4 | Epithelzellen | Laminin | |
| α7β1 | Muskelzellen | Laminin | |
| α8β1 | |||
| α9β1 | lymphatische Gefäße | Tenascin, Proteasen, Fibronektin | |
| α10β1 | Kollagen | ||
| α11β1 | Kollagen | ||
| αVβ1 | TGFβ, Vitronektin, Fibronektin | ||
| αVβ3 | Vitronektinrezeptor | Fibroblasten, Endothelzellen | Vitronektin, Osteopontin, Fibronektin, Fibrinogen, Thyroxin, TETRAC |
| αIIbβ3 | GPIIbIIIa; Fibrinogenrezeptor | Thrombozyten | Fibrinogen, Fibronektin |
| αVβ5 | Fibroblasten, retinales Pigmentepithel | Vitronektin, Fibronektin | |
| αVβ6 | Epithelzellen | TGFβ | |
| αVβ8 | Nervengewebe | TGFβ | |
| αDβ2 | ICAM | ||
| αLβ2 | LFA-1 | ICAM | |
| αMβ2 | Mac-1 | ICAM | |
| αXβ2 | ICAM | ||
| αEβ7 | E-Cadherin |
Siehe auch
Literatur
- Richard O. Hynes: Integrins: versatility, modulation and signaling in cell adhesion. In: Cell. Band 69, 1992, S. 11–25.
Einzelnachweise
- Evans EA, Calderwood DA. Forces and bond dynamics in cell adhesion. Science 2007; 316:1148-53, PMID 17525329.
- Hynes R. Integrins: bidirectional, allosteric signaling machines Cell 2002; 110:673-87, PMID 12297042.
- Humphries M.J.: Integrin structure. In: Biochem. Soc. Trans.. 28, Nr. 4, 2000, S. 311–339. doi:10.1042/0300-5127:0280311. PMID 10961914.
- Michael Bachmann, Sampo Kukkurainen, Vesa P. Hytönen, Bernhard Wehrle-Haller: Cell Adhesion by Integrins. In: Physiological Reviews. Band 99, Nr. 4, 1. Oktober 2019, ISSN 0031-9333, S. 1655–1699, doi:10.1152/physrev.00036.2018.
- Mark S. Johnson, Ning Lu, Konstantin Denessiouk, Jyrki Heino, Donald Gullberg: Integrins during evolution: Evolutionary trees and model organisms. In: Biochimica et Biophysica Acta (BBA) - Biomembranes. Band 1788, Nr. 4, April 2009, S. 779–789, doi:10.1016/j.bbamem.2008.12.013 (Online [abgerufen am 30. April 2020]).
- David A. Calderwood, Iain D. Campbell, David R. Critchley: Talins and kindlins: partners in integrin-mediated adhesion. In: Nature Reviews Molecular Cell Biology. Band 14, Nr. 8, August 2013, ISSN 1471-0072, S. 503–517, doi:10.1038/nrm3624, PMID 23860236, PMC 4116690 (freier Volltext) – (Online [abgerufen am 30. April 2020]).
- Daniel Bouvard, Jeroen Pouwels, Nicola De Franceschi, Johanna Ivaska: Integrin inactivators: balancing cellular functions in vitro and in vivo. In: Nature Reviews Molecular Cell Biology. Band 14, Nr. 7, Juli 2013, ISSN 1471-0072, S. 430–442, doi:10.1038/nrm3599 (Online [abgerufen am 30. April 2020]).
- Pontus Nordenfelt, Hunter L. Elliott, Timothy A. Springer: Coordinated integrin activation by actin-dependent force during T-cell migration. In: Nature Communications. Band 7, Nr. 1, Dezember 2016, ISSN 2041-1723, S. 13119, doi:10.1038/ncomms13119, PMID 27721490, PMC 5062559 (freier Volltext) – (Online [abgerufen am 30. April 2020]).
- Michael Bachmann, Markus Schäfer, Vasyl V. Mykuliak, Marta Ripamonti, Lia Heiser: Induction of ligand promiscuity of αVβ3 integrin by mechanical force. In: Journal of Cell Science. 19. März 2020, ISSN 0021-9533, S. jcs.242404, doi:10.1242/jcs.242404.
- Yunfeng Chen, Lining Ju, Muaz Rushdi, Chenghao Ge, Cheng Zhu: Receptor-mediated cell mechanosensing. In: Molecular Biology of the Cell. Band 28, Nr. 23, 7. November 2017, ISSN 1059-1524, S. 3134–3155, doi:10.1091/mbc.e17-04-0228 (Online [abgerufen am 30. April 2020]).
- ViralZone page. Abgerufen am 30. April 2020.
- Patrick T. Caswell, Jim C. Norman: Integrin Trafficking and the Control of Cell Migration: Integrin Trafficking and Cell Migration. In: Traffic. Band 7, Nr. 1, Januar 2006, S. 14–21, doi:10.1111/j.1600-0854.2005.00362.x (Online [abgerufen am 30. April 2020]).
- Hosni A. M. Hussein, Lia R. Walker, Usama M. Abdel-Raouf, Sayed A. Desouky, Abdel Khalek M. Montasser: Beyond RGD: virus interactions with integrins. In: Archives of Virology. Band 160, Nr. 11, November 2015, ISSN 0304-8608, S. 2669–2681, doi:10.1007/s00705-015-2579-8 (Online [abgerufen am 30. April 2020]).
- Christian JA Sigrist, Alan Bridge, Philippe Le Mercier: A potential role for integrins in host cell entry by SARS-CoV-2. In: Antiviral Research. Band 177, Mai 2020, S. 104759, doi:10.1016/j.antiviral.2020.104759.
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Tysabri.
- Eibl RH and Benoit M: Molecular resolution of cell adhesion forces.. In: IEE Proc Nanobiotechnol.. 151, Nr. 3, 2004, S. 128–132. doi:10.1049/ip-nbt:20040707. PMID 16475855.
- Eugene O. Major: Progressive Multifocal Leukoencephalopathy in Patients on Immunomodulatory Therapies. In: Annual Review of Medicine. Band 61, Nr. 1, Februar 2010, ISSN 0066-4219, S. 35–47, doi:10.1146/annurev.med.080708.082655 (Online [abgerufen am 30. April 2020]).
- FDA approves Entyvio to treat ulcerative colitis and Crohn's disease, PM der Food and Drug Administration (FDA) vom 20. Mai 2014, abgerufen am 21. Oktober 2014
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Entyvio.
- Zusammenfassung des EPAR für die Öffentlichkeit, EPAR auf deutsch, abgerufen am 21. Oktober 2014.
- Entyvio Fachinformation, Rote Liste, Fachinfo-Service, abgerufen am 21. Oktober 2014.