Kalorienrestriktion
Kalorienrestriktion, auch kalorische Restriktion oder Kalorienbeschränkung genannt, ist die Bezeichnung für eine Diät mit einer gegenüber der Ernährung ad libitum („nach Belieben“) um 10 bis 50 Prozent reduzierten Zufuhr von Energie aus Lebensmitteln (siehe: physiologischer Brennwert) über die Ernährung.[1][2] Ziel ist es, dadurch eine höhere Lebenserwartung oder zumindest eine verzögertes Altern oder gesundheitsfördernde Wirkung zu erzielen,[3] ohne dass sich dabei eine Unterernährung einstellen soll. In der englischsprachigen Fachliteratur werden die Begriffe caloric restriction, calorie restriction oder dietary restriction für die Kalorienrestriktion verwendet.
Bei einer Reihe von Modellorganismen konnte auf diese Weise ein gesundheitsfördernder und lebensverlängernder Effekt nachgewiesen werden. Bei einigen Spezies oder Züchtungen konnte allerdings keine Verlängerung der Lebenserwartung festgestellt werden. Die Verlängerung der Lebenserwartung bei manchen Nagetierstämmen um bis zu 50 %[4] ist unter anderem vom Genom und dem Geschlecht abhängig.[5]
Zuverlässige Daten über einen lebensverlängernden Effekt durch Kalorienrestriktion beim Menschen liegen nicht vor. Während der Effekt im Tiermodell überwiegend anerkannt wird, wird die Übertragbarkeit auf den Menschen kontrovers diskutiert. Die Wirkmechanismen sind hypothetisch und ungeklärt.
Geschichte

Der Venezianer Luigi Cornaro (1467–1565) schrieb in seinem autobiografischen Traktat Discorsi della vita sobria (Vom mäßigen Leben), das er im Alter von 83 Jahren verfasste, sein hohes Alter und seine Gesundheit dem Umstand zu, dass er eine strenge Diät (Kalorienrestriktion) befolgte. Dabei aß Cornaro gerade so viel, wie zum Überleben notwendig war. Die Nahrung wählte er dabei nicht nach seinem Geschmack, sondern nach gesundheitlichen Aspekten aus.[6][7]
Francis Peyton Rous stellte 1914 in Tierversuchen fest, dass durch eine Reduzierung des Nahrungsangebotes bei Ratten die Häufigkeit von Tumoren verringert und das Leben der Tiere verlängert werden kann. In den 1930er Jahren stellten Clive McCay und Kollegen nach ähnlichen Tierversuchen die Hypothese auf, dass die Lebensverlängerung durch Kalorienrestriktion bei Ratten auf eine verringerte Wachstumsrate zurückzuführen sei. Eine molekularbiologische Erklärung dafür hatten sie nicht.
Der lebensverlängernde Effekt der Kalorienrestriktion wurde 1934 von dem US-amerikanischen Biochemiker Clive Maine McCay (1898–1967) und Mary F. Crowell (beide Cornell University) beschrieben.[8][9][10] McCay und Crowell stellten bei ihren Versuchen mit Ratten fest, dass die dauerhafte Reduzierung der Nahrungsmenge – unter Sicherstellung einer adäquaten Ernährung – die Lebenserwartung der Tiere signifikant erhöht.[11] Ein Teil der Versuchstiere bekam dabei 33 Prozent weniger Nahrung als die Vergleichsgruppe, die ad libitum („nach Belieben“) ernährt wurde, wodurch die Lebenserwartung der erstgenannten Tiere um fast 50 Prozent verlängert wurde.
Morris Ross führte in den 1960er und 1970er Jahren weitere Experimente mit Ratten durch und konnte dabei McCays Hypothese untermauern.[12][13]
Ross konnte in seinen Versuchsreihen feststellen, dass die Zusammensetzung der Nahrung – im Vergleich zur Kalorienrestriktion – einen deutlich geringeren Effekt zur Lebensverlängerung hat.[14] Richard Weindruch und Roy Walford zeigten in den 1980er Jahren durch Experimente mit Mäusen, dass Kalorienrestriktion auch dann, wenn sie erst bei ausgewachsenen Tieren eingeleitet wird, das Leben verlängern kann.[15] Sie schlossen daraus, dass weniger eine verzögerte Reifung die Hauptursache für die Lebensverlängerung ist, sondern dass die Kalorienrestriktion offensichtlich den Prozess des Alterns selbst positiv mediiert.[14] In der zweiten Hälfte des 20. Jahrhunderts experimentierte die sowjetische Ärztin Galina Schatalowa mit der Kalorienrestriktion in Kombination mit Rohkost.
Während der 1980er und frühen 1990er Jahren begannen Forscher eine ernsthafte Diskussion über Studien zur Kalorienrestriktion unter Teilnahme von Menschen. In der Folge wurden Studien unter anderem mit Rhesusaffen (Macaca mulatta) durchgeführt, die zeigen konnten, dass die positiven Ergebnisse von anderen Tierarten auch auf Primaten übertragbar sind.[16]
In den 1990er Jahren begann auch eine intensive Erforschung der Effekte der Kalorienrestriktion bei dem Fadenwurm Caenorhabditis elegans. 1998 veröffentlichten Bernard Lakowski und Siegfried Hekimi, dass Mutationen, die den Rachen des Wurmes verändern und die Nahrungsaufnahme beschränken, die Lebenserwartung um 50 % erhöhen.[17]
Im Biosphäre-2-Experiment sollten sich die Studienteilnehmer vollständig aus dem inneren Stoffkreislauf eines geschlossenen Gebäudekomplexes ernähren. Roy Walford nahm von 1991 bis 1993 an dem Experiment teil. Als die Studienteilnehmer feststellen mussten, dass sie ihre Fähigkeit zur Produktion von Nahrungsmitteln überschätzt hatten, regte Walford eine Kalorienrestriktion an. Während sieben Achteln ihres zweijährigen Aufenthaltes konsumierten die acht Probanden eine kalorienarme (7300 bis 8900 kJ pro Tag) Ernährung vor allem aus Gemüse, Obst, Nüssen, Getreide und Hülsenfrüchten. Walford berichtete, dass die gesunden, schlanken Versuchsteilnehmer mit vergleichbaren physiologischen, hämatologischen, hormonellen und biochemischen Veränderungen reagierten wie die Versuchstiere in Kalorienrestriktions-Studien.[18]
Wirkung bei verschiedenen Lebewesen
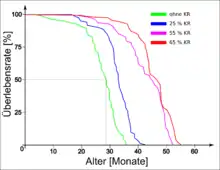
.jpg.webp)
Ähnliche Versuche wie die mit Mäuse wurden seit 1934 mit den unterschiedlichsten Spezies und variierten Versuchsbedingungen durchgeführt. Bei vielen Spezies wird nicht nur die mittlere Lebensdauer der Versuchstiere, sondern auch ihre maximale Lebensdauer erhöht. Die Häufigkeit altersbedingter Erkrankungen sinkt entsprechend.[20] Der Effekt des Zuwachses an maximaler Lebenserwartung stellt sich bei Nagetieren sowohl bei Beginn der Diät in der frühen Lebensphase (1. bis 3. Monat), als auch im mittleren Lebensabschnitt (12. Monat), ein.[21][22] Wird dagegen mit der Kalorienrestriktion in einem späteren Lebensabschnitt der Versuchstiere begonnen, beispielsweise im 17. oder 24. Monat von Mäusen, so kehrt sich der Effekt um und die Lebensspanne der Versuchstiere verkürzt sich.[23]
Die Kalorienrestriktion wurde unter anderem an Backhefe (Saccharomyces cerevisiae),[24][25] dem Fadenwurm Caenorhabditis elegans,[17] der Fruchtfliege Drosophila melanogaster,[26] Mäusen,[19] Ratten,[8] Hunden[27] und an nichtmenschlichen Primaten[21][22][28] untersucht.
Sowohl in einer Studie mit Rhesusaffen[29] des US-amerikanischen National Institute on Aging, als auch in einer Studie an Drosophila[30] wurde vermutet, dass die Lebensverlängerung nicht nur von der Kalorienrestriktion, sondern auch von der Zusammensetzung der Nahrung abhängt.
Allgemeine Kritik
Verschiedene Erkenntnisse lassen Zweifel an der Vorstellung aufkommen, dass Kalorienrestriktion den Alterungsprozess verlangsamt, den altersbedingten Rückgang der physiologischen Fitness verzögert oder die Lebensdauer von Organismen aus verschiedenen phylogenetischen Gruppen verlängert.[31] Positive Effekte der Kalorienrestriktion sind nicht universell:
Bei Fruchtfliegen sind positive Effekte der Kalorienrestriktion bei sorgfältiger Kontrolle der Nährstofffraktionen nicht reproduziert.[32]
Der durch Kalorienrestriktion bedingte Anstieg der Lebenserwartung ist teilweise noch nicht einmal unter den verschiedenen Stämmen der gleichen Spezies reproduzierbar.[31]
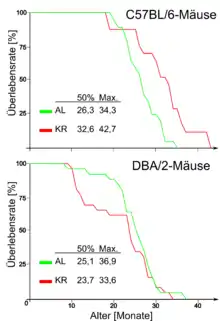
So führt Kalorienrestriktion nicht bei allen Mäusestämmen zu einer Lebensverlängerung.[23] Bei 19 bis 27 % der untersuchten Mäuserassen wurde durch eine Kalorienrestriktion von 40 % gar eine Verkürzung der Lebenserwartung festgestellt.[33][34]
Die in Versuchen häufig eingesetzte C57BL/6-Maus neigt bei unbeschränktem Nahrungsangebot (ad libitum) zu Übergewicht. Bei diesen Tieren ist der Effekt der Kalorienrestriktion signifikant. DBA/2-Mäuse dagegen bleiben auch bei ad-libitum-Ernährung schlank. Bei Mäusen aus diesem Stamm führt die Kalorienrestriktion zu keiner Lebensverlängerung. DBA/2-Mäuse verbrauchen bei gleicher Energiezufuhr mehr Sauerstoff als C57BL/6-Mäuse, das heißt ihre Stoffwechselrate ist erhöht – sie sind schlechtere „Futterverwerter“.[35] Bereits in früheren Versuchen wurde festgestellt, dass die Kalorienrestriktion am erfolgreichsten bei Mäusen verläuft, die im frühen Erwachsenenalter stark zugenommen haben.[36] Die Ergebnisse dieser Studien werden dahingehend interpretiert, dass die Lebensspanne mehr durch das Gleichgewicht von Energiezufuhr und Energieverbrauch beeinflusst wird. Nur bei zu Übergewicht, beziehungsweise Adipositas, neigenden Versuchstieren kann die Kalorienrestriktion eine Lebensverlängerung bewirken.[37]
Die o. g. NIA-Studie an Rhesusaffen fand keine Lebensverlängerung.[29] In einer Langzeitstudie, die am Wisconsin National Primate Research Center über den Zeitraum von 20 Jahren an Rhesusaffen durchgeführt wurde, konnte dagegen ein signifikant besser Gesundheitszustand und eine deutlich erhöhte Lebenserwartung in der Gruppe von Tieren festgestellt werden, die in diesem Zeitraum nur ein reduziertes Nahrungsangebot bekam. So lebten in dieser Gruppe noch 80 % der Tiere, während es in der normal ernährten Vergleichsgruppe nur noch 50 % waren. Darüber hinaus konnte bei den Tieren mit Kalorienrestriktion ein deutlich verzögertes Auftreten (late-onset) von altersassoziierten Erkrankungen wie Diabetes, Krebs und Hirnatrophie, sowie von kardiovaskulären Vorfällen beobachtet werden. Die Autoren der Studie kommen zu dem Ergebnis, dass Kalorienrestriktion bei dieser Primatenspecies den Alterungsprozess verzögert.[38][39]
Wirkung beim Menschen
Die bei den Versuchstieren zu beobachtenden hormonellen und metabolischen Effekte der Kalorienrestriktion, wie niedrigere Körpertemperatur, reduzierte Stoffwechselrate und geringerer oxidativer Stress, konnten auch am Menschen nachgewiesen werden.[20][40] Des Weiteren wurden im Serum niedrigere Werte für Basalinsulin („Fasteninsulin“), profibrotische Proteine, verschiedene Wachstumsfaktoren – wie beispielsweise PDGF und TGF-α – als auch Zytokine wie Tumornekrosefaktor-α nachgewiesen.[41][42][43][44][45] Gesichert ist auch die Erkenntnis, dass eine langfristige Kalorienrestriktion eine wirksame Vorbeugung gegen Diabetes mellitus Typ II, Bluthochdruck und Arteriosklerose ist, die zusammen die Hauptursachen für Morbidität, Behinderungen und Mortalität beim Menschen sind.[11]
Langlebigkeit
Es gibt derzeit keinen wissenschaftlichen Beweis dafür, dass eine dauerhafte Kalorienrestriktion – bei adäquater Ernährung des Menschen – im Vergleich zu einem schlanken Erwachsenen zu einer Verlängerung der Lebenserwartung führt.[46] Unbestritten ist, dass starkes Übergewicht, das heißt Adipositas, zu einer Verkürzung der mittleren und maximalen Lebenserwartung führt. Allerdings bestätigten Reviews, dass Kalorienrestriktion (oder auch Intervallfasten) bei gesunden Erwachsenen wahrscheinlich zu ähnlicher Lebenserweiterung – Verlängerungen der Gesundheits- und Lebensspanne – führen, wie sie bei Tierversuchen festgestellt wurden. Sie beschreiben die gesundheitlichen Auswirkungen und die molekularen Mechanismen solcher Phasen zu denen Autophagie zählt. Ein Problem wissenschaftlicher Untersuchungen dazu ist, dass die relativ lange Lebensdauer von Menschen es schwer macht derartige Interventionen direkt zu testen.[47][48] Zeiträume, in denen man die Kalorienaufnahme auf ein konstantes Defizit beschränkt können mit Intervallfasten (Perioden mit Intervallen, in denen man keine Nahrung, sondern nur z. B. Wasser und Tee/Kaffee zu sich nimmt) und Varianten der mediterranen Ernährung kombiniert werden, welche in der Regel langfristige kardiovaskuläre Vorteile bewirkt und die Langlebigkeit ebenfalls erhöhen könnte.[49] Welche Protokolle (etwa Dauer und Höhe des Kaloriendefizits) und Kombinationen (siehe z. B. Kalorienrestriktionmimetikum, Wirkungen des Kaffees und AMPK) mit Kalorienrestriktion beim Menschen allgemein und je nach Person[48] wirksam oder am wirksamsten sind, ist noch unbekannt.
Evolutionstheoretische Gegenargumente
Es gibt evolutionstheoretische Argumente dafür, dass Kalorienrestriktion bei Primaten, deren Ordnung auch die Menschenaffen inklusive des Menschen mit einschließt, keine oder nur eine geringe positive Wirkung auf die Lebensdauer hat:
Nach der Disposable-Soma-Theorie zur Evolution des Alterns müsste sich eine drastische Einschränkung der Energiezufuhr entweder auf die Reproduktion oder auf die Lebensdauer eines Organismus negativ auswirken, da nur die für den Stoffwechsel nicht benötigte Energie für die Reproduktion oder für Reparatur und Instandhaltung des Körpers (körperliche Integrität) aufgewendet werden kann. Die Disposable-Soma-Theorie stellt die Vermutung auf, dass ein Organismus seine Energie im Zustand des Mangels zuungunsten des Fortpflanzungsaufwands auf Reparatur und Instandhaltung kanalisiert wodurch ein längeres Leben auf Kosten der Reproduktionsfähigkeit möglich würde.[50]
Dieser Umstand lässt sich evolutionär herleiten, insofern eine akute Hungersnot einen negativen Effekt auf das Überleben von Nachkommen haben kann und es darum in dieser Zeitperiode weniger sinnvoll ist, Energie in Nachkommen zu investieren (die möglicherweise nicht bis zur Geschlechtsreife überleben), als in die Reparatur und Instandhaltung des eigenen Körpers.[50][51] Letzteres erhöht die Wahrscheinlichkeit, nach dem Abklingen des Nahrungsmangels Nachkommen zu zeugen, die dann eine bessere Überlebenschance haben.
Wird die Kalorienaufnahme von Nagetieren beschränkt, kann tatsächlich eine Beeinträchtigung des reproduktiven Systems beobachtet werden: Die erhöhte Langlebigkeit, die bei Nagetieren aus kalorischer Restriktion resultiert, geht stets mit einem dramatischen Rückgang der Fortpflanzungsfähigkeit einher.[52] Normalerweise erreichen viele Nager die Geschlechtsreife im Alter von einem Monat und Weibchen sind in der Lage, alle anderthalb Monate ihr Körpergewicht in Nachkommen zu produzieren.[52] Die Fortpflanzungsstrategie von Nagetieren besteht im Allgemeinen in einer frühen Reproduktion, die mit einer vergleichsweise geringen Lebenserwartung einhergeht.
Primaten auf der anderen Seite durchleben eine langsame Individualentwicklung bei geringer Vermehrungsrate, kombiniert mit einer längeren Lebensspanne als Nicht-Primaten mit vergleichbarer Körpergröße und einer deutlich längeren Lebensdauer als Nagetiere.[52] Daraus wird die Schlussfolgerung gezogen, dass die Kalorienrestriktion bei Primaten und Menschen nicht analog zu Wirbellosen und kleinen Säugetieren wirkt, weil auch beim Menschen die reproduktive Investition gering, die Lebensspanne jedoch hoch ist.
Eine andere Hypothese besagt, dass die mögliche Lebensverlängerung durch Kalorienrestriktion nicht proportional zur Lebensdauer ist, sondern bei allen betrachteten Arten außerhalb der Tropen bei ungefähr einem Jahr liegt.[53] Als Grund hierfür wird vermutet, dass die Variabilität der Nahrungsverfügbarkeit besonders vom jährlichen Rückgang der pflanzlichen Biomasse im Winter abhängt und somit unabhängig von der Größe eines Organismus, seiner Phylogenese oder absoluten Lebensdauer ist. [Diese These wird nach der Veröffentlichung[54] von Aubrey de Grey aus 2005 gelegentlich als weather hypothesis (Wetter-Hypothese) referenziert.] Die Theorie lässt demnach nur eine Lebensverlängerung um 5 bis 14 Monate erwarten, was auch mit Untersuchungen bei verschiedenen Modellorganismen übereinstimmt.[53][54]
Risiken der Kalorienrestriktion beim Menschen
Speziell in den USA haben die tierexperimentellen Ergebnisse dazu geführt, dass – insbesondere in Kalifornien[37] – die Kalorienrestriktion viele praktizierende Anhänger gefunden hat. Ein Teil der Anhänger hat sich zur Calorie Restriction Society zusammengeschlossen. Eine übertriebene Kalorienreduktion birgt immer die Gefahr einer Mangelernährung, was sich auf körperliche und geistige Gesundheit negativ auswirken kann. Vor möglichen Essstörungen bei der Kalorienrestriktion wird immer wieder gewarnt. Andererseits zeigte eine Studie, dass die Kalorienrestriktion nicht zu einer Häufung von Anorexie oder Bulimie führt. Die psychologischen Effekte der Kalorienrestriktion wurden in dieser Studie als positiv bewertet.[55]
Eine langfristige Unterernährung kann neben positiven Effekten auch zu verschiedenen Mangelerkrankungen führen. Bei Minderjährigen können Entwicklungsstörungen auftreten. Die Kälteempfindlichkeit kann zunehmen.[56] Der Eisprung kann bei Frauen mit sehr geringem BMI ausgesetzt werden, was in einer temporären Unfruchtbarkeit resultiert.[56] Beim Minnesota Starvation Experiment wurden bei einer sechsmonatigen Kalorienrestriktion mit 90%igem Kohlenhydratanteil bei männlichen Erwachsenen Anämie, Ödeme in den unteren Extremitäten, Muskelschwund, Schwäche, neurologische Beeinträchtigungen, Schwindel, Reizbarkeit, Lethargie und Depression beobachtet.[57] Eine kurzfristige Kalorienrestriktion kann zu Muskelschwund und verringerter Knochendichte führen.[58] In Personen mit geringem Körperfettanteil kann eine Kalorienrestriktion schädlich sein.[59]
Mechanismus
Die Ursachen der Lebensverlängerung von Modellorganismen durch die kalorische Restriktion sind noch nicht aufgeklärt. Der diesem Effekt zugrundeliegende Mechanismus ist unbekannt. Möglicherweise entsteht die Verlängerung der Lebenszeit aus der Verbesserung des Gesundheitszustandes durch die Abwesenheit von Übergewicht und dem späteren Einsetzen altersbedingter Erkrankungen des metabolischen Syndroms wie Herz-Kreislauf-Erkrankungen und Diabetes mellitus Typ II.
Studien, die mit Mäusen durchgeführt wurden, deuten darauf hin, dass die mit Kalorienrestriktion einhergehende Lebensverlängerung nicht einfach eine Folge von Schlankheit ist, die durch die Kalorienbeschränkung hervorgerufen wird. Die maximale Lebensdauer männlicher Ratten, die durch körperliche Bewegung eine niedrige Körperfettmasse hielten, stieg nicht an, sehr wohl jedoch die von Mäusen, die bei einer bewegungsarmen Lebensweise allein durch Kalorienrestriktion ein niedriges Körpergewicht hielten.[60]
Die Kalorienrestriktion in Ratten erzeugt lösliche Faktoren im Blutserum, die bei menschlichen Zellkulturen eine Lebensverlängerung hervorrufen.[61] Verschiedene Mechanismen werden diskutiert:
Verminderung von oxidativem Stress
Es gibt Hinweise dafür, dass der oxidative Stress durch die verminderte Nahrungsaufnahme reduziert wird und sich dadurch das primäre Altern verzögert. Das primäre Altern ist der Prozess von Zellen und Organen, der – bei Abwesenheit von Krankheiten – die maximale Lebensspanne definiert (unvermeidliches Altern). Das sekundäre Altern wird durch äußere Faktoren wie beispielsweise Erkrankungen, Umweltfaktoren, Lebensstil und körperliche Aktivität bestimmt (vermeidbares Altern).[62] Der oxidative Stress findet vor allem in den Mitochondrien, den Kraftwerken der Zellen, statt.[63][64] Durch Resveratrol kann der Effekt der Kalorienrestriktion in manchen Mäusestämmen teilweise induziert werden.[65] In Hefen dient das Protein Rim15, eine Glucose-gehemmte Proteinkinase, als Sensor von Nährstoffkonzentrationen sowie der Einleitung der Meiose und ist notwendig für eine Lebenszeitverlängerung in Hefen.[66] Jedoch wurde in einer Meta-Analyse auch davon berichtet, dass eine Kalorienrestriktion – entgegen früheren Ergebnissen – in Hefen nicht zu einer Verlängerung der Lebenszeit führt, sondern die Ergebnisse in Hefen teilweise auf methodischen Artefakten beruhen.[67]
Hormesis
Einer gegenteiligen Hypothese zufolge soll der oxidative Stress Reaktive Sauerstoffspezies (engl. reactive oxygen species, ROS) den Zellstoffwechsel positiv stimulieren (Hormesis), was den Gesundheitsvorteil der Kalorienrestriktion wie auch von Fasten, oxidativen Pflanzenstoffen im Kohlgemüse, und Körpertraining erkläre.[68]
Im Gegensatz zur Theorie der freien Radikale wird dabei angenommen, dass eine mit Kalorienrestriktion verbundene erhöhte Bildung von reaktiven Sauerstoffspezies in den Mitochondrien eine adaptive Reaktion verursacht, die die Stressresistenz erhöht.[69]
Aktivierung von Sirtuin-1 und verminderte Expression des mTOR-Rezeptors
Die signalregulierenden Enzyme Sirtuin-1 (Sirt1) in Säugetieren bzw. Sirtuin Sir2 in Hefen könnten eine Rolle spielen.[70] Die Zellen der kalorisch restriktiv ernährten Versuchstiere produzieren Sirt1 in größeren Mengen.[71] Eine erhöhte Produktion von Sirt1 vermindert wiederum die Expression des mTOR-Rezeptors (mammalian Target of Rapamycin),[72] der ebenfalls mit dem Alterungsprozess in Zusammenhang steht. Durch Verabreichung von Rapamycin, das an den mTOR-Rezeptor andockt, kann die Lebenserwartung von Mäusen signifikant verlängert werden.[73][74] Melatonin wird ebenfalls aufgrund einer Sirtuin-Aktivierung untersucht.[65]
„Neuprogrammierung“ von Stoffwechsel und Genexpression
Einer anderen Theorie zufolge wird durch die langfristige reduzierte Nahrungsaufnahme der Stoffwechsel neu „programmiert“.[75] So wurde bei Mäusen unter kalorischer Restriktion eine veränderte Genexpression festgestellt. So werden einerseits die Gene, die in den Energiestoffwechsel involviert sind, überexprimiert,[76] während auf der anderen Seite über 50 pro-inflammatorische Gene herunterreguliert werden.[77][78] Möglicherweise wird die Regeneration von manchen Stammzellen verstärkt.[79] Durch Metformin lässt sich in manchen Mäusestämmen ein ähnlicher Effekt induzieren.[5]
Vermehrte Bildung von Ketonkörpern
Sowohl Kalorienrestriktion als auch die ketogene Diät besitzen bei verschiedenen Tiermodellen neurologischer Erkrankungen therapeutisches Potenzial.[80] Unter Kalorienrestriktion kommt es zu einem Übergang vom Glucosestoffwechsel zur Nutzung von Ketonkörpern. Ketonkörper können als alternative Energiequelle für Gehirnzellen verwendet werden, wenn die Glucoseverfügbarkeit mangelhaft ist.[81]
Ketonkörper schützen Neuronen gegen verschiedene Arten von neuronalen Verletzungen. Dies ist ein Erklärungsansatz für die günstige Wirkung der Kalorienrestriktion im Tiermodell neurologischer Erkrankungen.[81]
Vermehrte Autophagozytose
Autophagozytose oder Autophagie, auch als „zellulären Selbstverdauung“ bezeichnet, ist ein zellulärer Signalpfad, der beim Abbau von Proteinen und Organellen beteiligt ist, und bei verschiedenen Krankheiten eine Rolle spielt. Fehlfunktionen der Autophagie werden mit Neurodegeneration, mikrobiellen Infektionen und Altern in Verbindung gebracht.
Mehrere Hinweise deuten darauf hin, dass Autophagie Bedeutung für die Effekte der Kalorienrestriktion hat: Die Effizienz der Autophagie nimmt mit zunehmendem Alter ab; die Abnahme der Autophagie geht mit Veränderungen der Biomarker des Alterns einher; die altersabhängige Veränderung der Autophagie wird im Experiment durch Kalorienrestriktion verhindert; wird eine Abnahme der Effizienz der Autophagie verhindert, ähneln die Effekte denen der Kalorienrestriktion; eine lang anhaltende Hemmung der Autophagie beschleunigt den Prozess des Alterns; eine lang anhaltende Stimulation der Autophagie verzögert hingegen den Alterungsprozess bei Ratten; die Stimulation der Autophagie können ältere Zellen vor einer Anhäufung von veränderter mitochondrialer DNA bewahren; die Stimulation der Autophagie lindert altersbedingte Hypercholesterinämie bei Nagern.[82]
Ein vergleichbarer Effekt wurde bei Pflanzen beobachtet, deren Belichtung reduziert wurde.[83]
Verminderte Schilddrüsenhormone
Die Plasmaspiegel der Schilddrüsenhormone Trijodthyronin (T3), Thyroxin (T4) und Thyroid-stimulierendes Hormon (TSH) wurden in Rhesusaffen (Macaca mulatta) gemessen, die einer 30 % CR-Diät unterworfen waren. Der T3-Wert im Plasma sank im Vergleich zur Kontrollgruppe. Angesichts der Auswirkungen der Schilddrüsenachse auf den Stoffwechsel könnte dies ein Mechanismus sein, über den eine CR-Diät ihre gesundheitlichen Vorteile vermittelt.[84]
Kalorienrestriktions-Mimetika
Auch wenn die Ergebnisse von humanen Studien einen positiven Effekt der Kalorienrestriktion auf die Lebenserwartung von Menschen belegen sollten, so ist die nötige Reduktion der Zufuhr von Nahrungsenergie über die entsprechende Dauer und mit dem entsprechenden Grad für die Mehrzahl von Menschen nicht praktikabel oder erwünscht. Daher werden auch sogenannte Kalorienrestriktions-Mimetika[85] (engl. CR mimetics) erforscht. Das Ziel dieser Strategie ist es, Verbindungen zu entdecken, welche die Wirkungen einer Kalorienrestriktion im menschlichen Körper nachahmen, indem sie beispielsweise auf denselben metabolischen Bahnen wirken, ohne dass eine tatsächliche Beschränkung der Kalorienzufuhr erforderlich wäre.[86][87]
Allerdings sind weitere Studien erforderlich, um festzustellen, ob Kalorienrestriktions-Mimetika tatsächlich einen Einfluss auf die Lebenserwartung von Menschen haben.[60]
Auswahl möglicher Kalorienrestriktions-Mimetika
Ingram zufolge kommen als Stoffe zur Nachahmung der Kalorienrestriktion im menschlichen Körper verschiedene Stoffe in Frage:[86]
- 2-Desoxy-D-glucose ist ein Stoff, der Ketogenese einleiten kann,[88] lässt Ratten etwas weniger Körpergewicht aufbauen als Kontrolltiere und führt zu einer signifikanten Senkung der Körpertemperatur und des Nüchtern-Seruminsulinspiegels, womit gewisse Effekte der Kalorienrestriktion simuliert wurden.[89]
- Metformin, ein oral einzunehmendes Antidiabetikum, lässt bei Ratten die Krebsinzidenz sinken und verlangsamt das Fortschreiten der Krankheit. Es verringert ebenso das Auftreten kardiovaskulärer Krankheiten und verlängert die Lebensspanne.[90]
- Glipizid ist wie Metformin ein oral einzunehmendes Antidiabetikum, das dabei hilft, den Blutzuckerspiegel zu kontrollieren. Es wirkt durch teilweise Blockierung der Kalium-Kanäle der Beta-Zellen der Langerhans-Inseln.[91]
- Rosiglitazon verhindert die Fettsäuren-induzierte Insulinresistenz durch Verminderung der Glucoseinfusionsrate und verbessert die Insulin-vermittelte Unterdrückung der hepatischen Glucoseproduktion. Darüber hinaus verbessert es die systemische Beseitigung von nicht-veresterten Fettsäuren.[92]
- Pioglitazon gehört ebenso wie Rosiglitazon zu der Stoffklasse der Thiazolidindione/Glitazone.
- Soja-Isoflavone scheinen kardioprotektive Effekte zu besitzen, die denen der Kalorienrestriktion ähneln, wie eine Verringerung des LDL-Cholesterins, eine Hemmung von proinflammatorischen Zytokinen, Stimulierung der Stickstoffmonoxid-Produktion, potentielle Reduzierung von LDL-Partikeln, Hemmung der Thrombozyten-Aggregation und eine Verbesserung der vaskulären Reaktivität.[93]
- Resveratrol erhöht die Überlebensrate von fettleibigen Mäusen gegenüber eine Kontrollgruppe aus mageren, unbehandelten Tieren. Das Hinzufügen von Resveratrol zur Ernährung von mageren Mäusen resultiert bewirkt jedoch keine weitere Zunahme der Lebensdauer.[94]
- Rimonabant gehört zu den Endocannabinoiden, Cannabis-ähnliche Substanzen, die den Appetit und die Energiebilanz regulieren können. Rimonabant ist ein Cannabinoid-1-Rezeptor-Blocker. Durch Überstimulation des Endocannabinoid-Rezeptors im Hypothalamus stimuliert es die Fettsäuresynthese (Lipogenese), vermutlich indem es den Adiponektinspiegel erhöht. Diese Lipogenese reduziert intraabdominelles Fett. Rimonabant verbessert darüber hinaus das Lipidprofil und die Glucosetoleranz.[95]
- Adiponectin, ein von Fettzellen sezerniertes Hormon, verringert bei fettleibigen Mäusen eine Insulin-Resistenz durch eine Verringerung des Triglyceridgehalt in Muskeln und Leber.[96]
- Sirolimus/Rapamycin hemmt, wenn es Mäusen mit der Nahrung verabreicht wurde, den mTOR-Signalweg und resultierte in einer deutlich erhöhten Lebensdauer im Vergleich zu Kontrollmäusen.[97]
- Acipimox hemmt die Freisetzung von Fettsäuren aus dem Fettgewebe und reduziert die Blutkonzentration von LDL-Partikeln, einhergehend mit einer Reduzierung des Triglycerid- und Cholesterinspiegels.[95]
Unerwünschte Arzneimittelwirkung von Kalorienrestriktions-Mimetika
Abhängig von ihrer Wirkstoffklasse, weisen die oben genannten CR-Mimetika unterschiedliche Nebenwirkungen/unerwünschte Arzneimittelwirkungen auf:
- Sirolimus inhibiert IL-2 und andere Cytokin-Receptor-abhängige Signalkaskaden und entfaltet so eine stark immunsuppressive Wirkung.[98]
- Metformin kann in seltenen Fälle eine Laktatazidose verursachen.[99]
- Rimonabant kann Durchfall, Schwindel und Übelkeit verursachen, sowie Atemwegsinfektionen begünstigen. Weitere mögliche unerwünschte Wirkungen sind Suizidgedanken, Gedächtnisstörungen und vermutlich auch Krampfanfälle.[100]
- Rosiglitazon kann – besonders in Kombination mit Insulin – Gewichtszunahme und Hypercholesterinämie, Blutarmut, sowie Ödeme, verursachen.[101]
- Pioglitazon kann sowohl Körpergewicht als auch die Wassermenge im Körper ansteigen lassen und erhöht auch das Frakturrisiko.[102] Ebenso könnte es möglicherweise das Risiko für Blasenkrebs erhöhen.[103]
- Adiponektin ist bei Frauen mit erhöhten Plasmaspiegeln mit erhöhtem Demenzrisiko assoziiert.[104]
Literatur
Fachzeitschriften (Reviews)
- L. Fontana: Extending Healthy Life Span From Yeast to Humans. In: Science 328, 2010, S. 321–326. PMID 20395504.
- J. E. Morley u. a.: Antiaging, longevity and calorie restriction. In: Current Opinion in Clinical Nutrition and Metabolic Care 13, 2010, S. 40–45. doi:10.1097/MCO.0b013e3283331384 PMID 19851100.
- J. Skrha: Effect of caloric restriction on oxidative markers. In: Adv Clin Chem 47, 2009, S. 223–247. PMID 19634782.
- J. V. Smith u. a.: Energy restriction and aging. In: Curr Opin Clin Nutr Metab Care 7, 2004, S. 615–622. PMID 15534428.
Fachbücher
- E. J. Masoro: Caloric Restriction: A Key to Understanding and Modulating Aging. Verlag Elsevier Health Sciences, 2002, ISBN 0-444-51162-8.
Populärwissenschaftliche Artikel
- R. Weindruch: Länger leben bei karger Kost? In: Spektrum der Wissenschaft, Dossier 4, 2008, S. 18–26.
- J. Blech: Heilkraft des Hungerns. In: Der Spiegel. Nr. 50, 2006, S. 154 (online).
- P. Bethge, L. Höflinger, J. Koch: Die Biologie des Hungerns. In: Der Spiegel. Nr. 13, 2011, S. 154 (online).
Weblinks
- A. F. H. Pfeiffer: Kalorische Restriktion: der Schlüssel zum ewigen Leben im Erwachsenenalter? (PDF; 2,1 MB) Deutsches Institut für Ernährungsforschung.
- Caloric Restriction May Not Extend Life Span. University of Southern California, Pressemitteilung (englisch).
- A. Jahn: Hungrig alt werden. In: Spektrum direkt, 9. Juli 2009.
- Calorie Restriction Society (englisch).
- J. Gutwald: Kalorienrestriktion als Präventionsmaßnahme: Was kann der verantwortungsvolle Präventionsmediziner empfehlen? (PDF; 1,2 MB) Masterarbeit, Dresden International University.
Einzelnachweise
- H. Pijl: Longevity. The allostatic load of dietary restriction. In: Physiology & behavior. Band 106, Nummer 1, April 2012, ISSN 1873-507X, S. 51–57, doi:10.1016/j.physbeh.2011.05.030, PMID 21663754.
- K. Dorshkind u. a.: The ageing immune system: is it ever too old to become young again? In: Nat Rev Immunol 9, 2009, S. 57–62. PMID 19104499.
- G. D. Kolovou, V. Kolovou, S. Mavrogeni: We are ageing. In: BioMed Research International, Band 2014, 2014, ISSN 2314-6141, S. 808307, doi:10.1155/2014/808307, PMID 25045704, PMC 4090574 (freier Volltext).
- J. R. Speakman, S. E. Mitchell: Caloric restriction. In: Molecular Aspects of Medicine, Band 32, Nummer 3, Juni 2011, S. 159–221, ISSN 1872-9452, doi:10.1016/j.mam.2011.07.001, PMID 21840335.
- L. Mulvey, A. Sinclair, C. Selman: Lifespan modulation in mice and the confounding effects of genetic background. In: Journal of genetics and genomics = Yi chuan xue bao. Band 41, Nummer 9, September 2014, S. 497–503, ISSN 1673-8527, doi:10.1016/j.jgg.2014.06.002, PMID 25269675, PMC 4257991 (freier Volltext).
- Louis Cornaro: The Art of Living Long. ins Englische übersetzt von W. F. Butler. Verlag Springer, 1903, ISBN 978-0-8261-2695-5 S. XXIII (eingeschränkte Vorschau in der Google-Buchsuche).
- A. J. Carlson, F. Hoelzel: Apparent Prolongation of the Life Span of Rats by Intermittent Fasting. In: Journal of Nutrition, Band 31, 1946, S. 363–375, PMID 21021020.
- C. M. McCay und M. F. Crowell: Prolonging the Life Span. In: The Scientific Monthly 39, 1934, S. 405–414; JSTOR 15813.
- C. M. McCay u. a.: The effect of retarded growth upon the length of the life span and upon the ultimate body size. In: J Nutr, 79, 1935, S. 63–79.
- C. M. McCay u. a.: The effect of retarded growth upon the length of life span and upon the ultimate body size. 1935. In: Nutrition, 5, 1989, S. 155–171. PMID 2520283.
- L. Fontana: The scientific basis of caloric restriction leading to longer life. In: Curr Opin Gastroenterol 25, 2009, S. 144–150. PMID 19262201 (Review).
- M. H. Ross: Length of life and nutrition in the rat. In: The Journal of Nutrition. Band 75, Oktober 1961, ISSN 0022-3166, S. 197–210, PMID 14494200.
- M. H. Ross: Length of life and caloric intake. In: The American Journal of Clinical Nutrition, Band 25, Nummer 8, August 1972, S. 834–838, ISSN 0002-9165, PMID 5046728.
- R. B. McDonald, J. J. Ramsey: Honoring Clive McCay and 75 years of calorie restriction research. In: The Journal of Nutrition, Band 140, Nummer 7, Juli 2010, S. 1205–1210, ISSN 1541-6100, doi:10.3945/jn.110.122804, PMID 20484554, PMC 2884327 (freier Volltext).
- R. Weindruch, R. L. Walford: Dietary restriction in mice beginning at 1 year of age: effect on life-span and spontaneous cancer incidence. In: Science, Band 215, Nummer 4538, März 1982, S. 1415–1418, PMID 7063854.
- R. J. Colman, T. M. Beasley u. a.: Caloric restriction reduces age-related and all-cause mortality in rhesus monkeys. In: Nature Communications, Band 5, 2014, S. 3557, ISSN 2041-1723, doi:10.1038/ncomms4557, PMID 24691430, PMC 3988801 (freier Volltext).
- B. Lakowski, S. Hekimi: The genetics of caloric restriction in Caenorhabditis elegans. In: PNAS. Band 95, Nummer 22, Oktober 1998, ISSN 0027-8424, S. 13091–13096, PMID 9789046, PMC 23719 (freier Volltext).
- R. L. Walford, D. Mock u. a.: Calorie restriction in biosphere 2: alterations in physiologic, hematologic, hormonal, and biochemical parameters in humans restricted for a 2-year period. In: The Journals of Gerontology. Series A, Biological sciences and medical sciences, Band 57, Nummer 6, Juni 2002, S. B211–B224, ISSN 1079-5006, PMID 12023257.
- R. Weindruch u. a.: The retardation of aging in mice by dietary restriction: longevity, cancer, immunity and lifetime energy intake. In: Journal of Nutrition Band 116, 1986, S. 641–654. PMID 3958810.
- T. Hofer u. a.: One year of caloric restriction and exercise in humans and the effects on DNA and RNA oxidation levels in white blood cells and urine. In: Rejuvenation Res, 11, 2008, S. 793–799. PMID 18729811.
- M. A. Lane u. a.: Caloric restriction and aging in primates: Relevance to humans and possible CR mimetics. In: Microsc Res Tech, 59, 2002, S. 335–338. PMID 12424798 (Review).
- J. Wanagat u. a.: Caloric intake and aging: mechanisms in rodents and a study in nonhuman primates. In: Toxicol Sci, 52, 1999, S. 35–40. PMID 10630588 (Review).
- M. J. Forster u. a.: Genotype and age influence the effect of caloric intake on mortality in mice. In: FASEB J, 17, 2003, S. 690–692. PMID 12586746.
- S. J. Lin u. a.: Requirement of NAD and SIR2 for life-span extension by calorie restriction in Saccharomyces cerevisiae. In: Science, 289, 2000, S. 2126–2128. PMID 11000115.
- S. J. Lin u. a.: Calorie restriction extends Saccharomyces cerevisiae lifespan by increasing respiration. In: Nature, 418, 2002, S. 344–348. PMID 12124627.
- W. Mair u. a.: Calories do not explain extension of life span by dietary restriction in Drosophila. In: PLoS Biol 3, 2005, e223. PMID 16000018.
- D. F. Lawler u. a.: Diet restriction and ageing in the dog: major observations over two decades. In: Br J Nutr 99, 2007, S. 1–13. PMID 1806283.
- R. Weindruch: The retardation of aging by caloric restriction: studies in rodents and primates. In: Toxicol Pathol, 24, 1996, S. 742–745. PMID 8994305.
- J. A. Mattison, G. S. Roth u. a.: Impact of caloric restriction on health and survival in rhesus monkeys from the NIA study. In: Nature, Band 489, Nummer 7415, September 2012, S. 318–321. doi:10.1038/nature11432. PMID 22932268.
- W. Mair, M. D. Piper, L. Partridge: Calories do not explain extension of life span by dietary restriction in Drosophila. In: PLoS Biology, Band 3, Nummer 7, Juli 2005, ISSN 1545-7885, S. e223, doi:10.1371/journal.pbio.0030223, PMID 16000018, PMC 1140680 (freier Volltext).
- R. S. Sohal, M. J. Forster: Caloric restriction and the aging process: a critique. In: Free radical biology & medicine, Band 73, August 2014, S. 366–382, ISSN 1873-4596, doi:10.1016/j.freeradbiomed.2014.05.015, PMID 24941891, PMC 4111977 (freier Volltext) (Review).
- K. P. Lee, S. J. Simpson u. a.: Lifespan and reproduction in Drosophila: New insights from nutritional geometry. In: Proceedings of the National Academy of Sciences, Band 105, Nummer 7, Februar 2008, S. 2498–2503, ISSN 1091-6490, doi:10.1073/pnas.0710787105, PMID 18268352, PMC 2268165 (freier Volltext).
- C. Y. Liao, B. A. Rikke, T. E. Johnson, V. Diaz, J. F. Nelson: Genetic variation in the murine lifespan response to dietary restriction: from life extension to life shortening. In: Aging Cell. Band 9, Nummer 1, Februar 2010, ISSN 1474-9726, S. 92–95, doi:10.1111/j.1474-9726.2009.00533.x, PMID 19878144, PMC 3476836 (freier Volltext).
- B. A. Rikke, C. Y. Liao, M. B. McQueen, J. F. Nelson, T. E. Johnson: Genetic dissection of dietary restriction in mice supports the metabolic efficiency model of life extension. In: Experimental Gerontology. Band 45, Nummer 9, September 2010, ISSN 1873-6815, S. 691–701, doi:10.1016/j.exger.2010.04.008, PMID 20452416, PMC 2926251 (freier Volltext).
- R. S. Sohal: Life span extension in mice by food restriction depends on an energy imbalance. In: J Nutr 139, 2009, S. 533–539. doi:10.3945/jn.108.100313 PMID 19141702.
- M. H. Ross u. a.: Dietary practices and growth responses as predictors of longevity. In: Nature 262, 1976, S. 548–553. PMID 958413.
- Lebensverlängerung: Mythos der Kalorienrestriktion widerlegt. (Nicht mehr online verfügbar.) In: aerzteblatt.de. 26. Januar 2009, archiviert vom Original am 18. Mai 2015; abgerufen am 1. Mai 2015. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- R. J. Colman, R. M. Anderson u. a.: Caloric restriction delays disease onset and mortality in rhesus monkeys. In: Science. Band 325, Nummer 5937, Juli 2009, S. 201–204, ISSN 1095-9203. doi:10.1126/science.1173635. PMID 19590001. PMC 2812811 (freier Volltext).
- rme: Anti-Aging: Kalorienrestriktion lässt Affen länger leben. (Memento des Originals vom 15. Oktober 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: aerzteblatt.de vom 10. Juli 2009.
- L. K. Heilbronn u. a.: Effect of 6-month calorie restriction on biomarkers of longevity, metabolic adaptation, and oxidative stress in overweight individuals: a randomized controlled trial. In: JAMA 295, 2006, S. 1539–1548. PMID 16595757
- L. Fontana, T. E. Meyer u. a.: Long-term calorie restriction is highly effective in reducing the risk for atherosclerosis in humans. In: Proceedings of the National Academy of Sciences. Band 101, Nummer 17, April 2004, ISSN 0027-8424, S. 6659–6663, doi:10.1073/pnas.0308291101, PMID 15096581, PMC 404101 (freier Volltext).
- L. Fontana u. a.: Calorie restriction or exercise: effects on coronary heart disease risk factors. A randomized, controlled trial. In: Am J Physiol Endocrinol Metab 293, 2007, S. E197–202. PMID 17389710
- E. P. Weiss u. a.: Improvements in glucose tolerance and insulin action induced by increasing energy expenditure or decreasing energy intake: a randomized controlled trial. In: Am J Clin Nutr, Band 84, 2006, S. 1033–1042. PMID 17093155
- D. E. Larson-Meyer u. a.: Effect of calorie restriction with or without exercise on insulin sensitivity, beta-cell function, fat cell size, and ectopic lipid in overweight subjects. In: Diabetes Care 29, 2006, S. 1337–1344. PMID 16732018
- T. E. Meyer u. a.: Long-term caloric restriction ameliorates the decline in diastolic function in humans. In: J Am College Cardiol 47, 2006, S. 398–402. PMID 16412867.
- Stephan Schleim: Auf der Suche nach dem Jungbrunnen: das Beispiel Kalorienreduktion. In: heise.de. 31. August 2012, abgerufen am 11. Mai 2015.
- Cara L. Green, Dudley W. Lamming, Luigi Fontana: Molecular mechanisms of dietary restriction promoting health and longevity. In: Nature Reviews Molecular Cell Biology. 13. September 2021, ISSN 1471-0080, S. 1–18. doi:10.1038/s41580-021-00411-4.
- Kenneth A. Wilson, Manish Chamoli, Tyler A. Hilsabeck, Manish Pandey, Sakshi Bansal, Geetanjali Chawla, Pankaj Kapahi: Evaluating the beneficial effects of dietary restrictions: A framework for precision nutrigeroscience. In: Cell Metabolism. 22. September 2021, ISSN 1550-4131. doi:10.1016/j.cmet.2021.08.018.
- James H. O’Keefe, Noel Torres-Acosta, Evan L. O’Keefe, Ibrahim M. Saeed, Carl J. Lavie, Sarah E. Smith, Emilio Ros: A Pesco-Mediterranean Diet With Intermittent Fasting. In: Journal of the American College of Cardiology. 76, Nr. 12, September 2020, S. 1484–1493. doi:10.1016/j.jacc.2020.07.049. PMID 32943166.
- D. P. Shanley, T. B. Kirkwood: Calorie restriction and aging: a life-history analysis. In: Evolution; international journal of organic evolution. Band 54, Nummer 3, Juni 2000, ISSN 0014-3820, S. 740–750, PMID 10937249.
- E. J. Masoro, S. N. Austad: The evolution of the antiaging action of dietary restriction: a hypothesis. In: The journals of gerontology. Series A, Biological sciences and medical sciences. Band 51, Nummer 6, November 1996, ISSN 1079-5006, S. B387–B391, PMID 8914486.
- J. P. Phelan, M. R. Rose: Why dietary restriction substantially increases longevity in animal models but won’t in humans. In: Ageing research reviews. Band 4, Nummer 3, August 2005, ISSN 1568-1637, S. 339–350, doi:10.1016/j.arr.2005.06.001, PMID 16046282 (Review).
- J. R. Speakman, S. E. Mitchell: Caloric restriction. In: Molecular aspects of medicine. Band 32, Nummer 3, Juni 2011, ISSN 1872-9452, S. 159–221, doi:10.1016/j.mam.2011.07.001, PMID 21840335 (Review).
- A. D. de Grey: The unfortunate influence of the weather on the rate of ageing: why human caloric restriction or its emulation may only extend life expectancy by 2-3 years. In: Gerontology. Band 51, Nummer 2, 2005 Mar-Apr, ISSN 0304-324X, S. 73–82, doi:10.1159/000082192, PMID 15711074 (Review).
- D. A. Williamson u. a.: Is Caloric Restriction Associated With Development of Eating-Disorder Symptoms? Results From the CALERIE Trial. In: Health Psychology, Band 27, 2008, S. S32–S42. PMID 18248104.
- E. Marzetti, S. E. Wohlgemuth, S. D. Anton, R Bernabei, C. S. Carter, C Leeuwenburgh: Cellular mechanisms of cardioprotection by calorie restriction: state of the science and future perspectives. In: Ncbi.nlm.nih.gov (Hrsg.): Clin. Geriatr. Med.. 25, Nr. 4, 19. Oktober 2012, S. 715–32, ix. doi:10.1016/j.cger.2009.07.002. PMID 19944269. PMC 2786899 (freier Volltext).
- A. Keys, J. Brozek, A. Henschels, O. Mickelsen, H. Taylor: The Biology of Human Starvation, 1950, Band 2, University of Minnesota Press, Minneapolis. S. 1133.
- John E Morley, Elie Chahla, Saad Alkaade: Antiaging, longevity and calorie restriction. In: Current Opinion in Clinical Nutrition and Metabolic Care. 13, Nr. 1, 2010, S. 40–5. doi:10.1097/MCO.0b013e3283331384. PMID 19851100.
- L. Fontana, S. Klein: Aging, Adiposity, and Calorie Restriction. In: JAMA. 297, Nr. 9, 2007, S. 986–94. doi:10.1001/jama.297.9.986. PMID 17341713.
- L. Fontana, S. Klein: Aging, adiposity, and calorie restriction. In: JAMA. Band 297, Nummer 9, März 2007, ISSN 1538-3598, S. 986–994, doi:10.1001/jama.297.9.986, PMID 17341713 (Review).
- R. de Cabo, L. Liu, A. Ali, N. Price, J. Zhang, M. Wang, E. Lakatta, P. M. Irusta: Serum from calorie-restricted animals delays senescence and extends the lifespan of normal human fibroblasts in vitro. In: Aging. Band 7, Nummer 3, März 2015, ISSN 1945-4589, S. 152–166, PMID 25855056.
- M. Tostlebe: Disproportionalität der Aktivitäten der mitochondrialen Atmungskettenkomplexe im Myokard und in der Skelettmuskulatur im Alter. Dissertation, Martin-Luther-Universität Halle-Wittenberg, 2005.
- A. Csiszar u. a.: Anti-oxidative and anti-inflammatory vasoprotective effects of caloric restriction in aging: role of circulating factors and SIRT1. In: Mech Ageing Dev 130, 2009, S. 518–527. PMID 19549533.
- J. Skrha: Effect of caloric restriction on oxidative markers. In: Adv Clin Chem 47, 2009, S. 223–247. PMID 19634782.
- M. R. Ramis, S. Esteban u. a.: Caloric restriction, resveratrol and melatonin: Role of SIRT1 and implications for aging and related-diseases. In: Mechanisms of ageing and development. [elektronische Veröffentlichung vor dem Druck] März 2015, ISSN 1872-6216, doi:10.1016/j.mad.2015.03.008, PMID 25824609.
- S. Nagarajan, A. L. Kruckeberg, K. H. Schmidt, E. Kroll, M. Hamilton, K. McInnerney, R. Summers, T. Taylor, F. Rosenzweig: Uncoupling reproduction from metabolism extends chronological lifespan in yeast. In: PNAS. Band 111, Nummer 15, April 2014, ISSN 1091-6490, S. E1538–E1547, doi:10.1073/pnas.1323918111, PMID 24706810, PMC 3992631 (freier Volltext).
- D. H. Huberts, J. González, S. S. Lee, A. Litsios, G. Hubmann, E. C. Wit, M. Heinemann: Calorie restriction does not elicit a robust extension of replicative lifespan in Saccharomyces cerevisiae. In: PNAS. Band 111, Nummer 32, August 2014, ISSN 1091-6490, S. 11727–11731, doi:10.1073/pnas.1410024111, PMID 25071164, PMC 4136557 (freier Volltext).
- P. C. Tapia: Sublethal mitochondrial stress with an attendant stoichiometric augmentation of reactive oxygen species may precipitate many of the beneficial alterations in cellular physiology produced by caloric restriction, intermittent fasting, exercise and dietary phytonutrients: “Mitohormesis” for health and vitality. In: Medical Hypotheses. Band 66, Nummer 4, 19. Oktober 2005, S. 832–843. PMID 16242247.
- M. Ristow, K. Zarse: How increased oxidative stress promotes longevity and metabolic health: The concept of mitochondrial hormesis (mitohormesis). In: Experimental Gerontology. Band 45, Nummer 6, Juni 2010, ISSN 1873-6815, S. 410–418, doi:10.1016/j.exger.2010.03.014, PMID 20350594 (Review).
- Y. Wang: Molecular Links between Caloric Restriction and Sir2/SIRT1 Activation. In: Diabetes & Metabolism Journal. Band 38, Nummer 5, Oktober 2014, ISSN 2233-6079, S. 321–329, doi:10.4093/dmj.2014.38.5.321, PMID 25349818, PMC 4209345 (freier Volltext).
- C. Cantó und J. Auwerx: Caloric restriction, SIRT1 and longevity. In: Trends Endocrinol Metab 20, 2009, S. 325–331. PMID 19713122.
- H. S. Ghosh u. a.: SIRT1 negatively regulates the mammalian target of rapamycin. In: PLoS One 5, 2010, e9199, PMID 20169165.
- S. Austad: Recent advances in vertebrate aging research 2009. In: Aging Cell 9, 2010, S. 297–303 PMID 20331443.
- D. E. Harrison u. a.: Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. In: Nature 460, 2009, S. 392–395. PMID 19587680, PMC 2786175 (freier Volltext).
- R. M. Anderson, R. Weindruch: Metabolic reprogramming in dietary restriction. In: Interdiscip Top Gerontol 35, 2007, S. 18–38. PMID 17063031 (Review).
- Y. Higami u. a.: Adipose tissue energy metabolism: altered gene expression profile of mice subjected to long-term caloric restriction. In: FASEB J 18, 2004, S. 415–417. PMID 14688200.
- Y. Higami u. a.: Energy restriction lowers the expression of genes linked to inflammation, the cytoskeleton, the extracellular matrix, and angiogenesis in mouse adipose tissue. In: J Nutr 136, 2006, S. 343–352. PMID 16424110.
- R. M. Anderson u. a.: Caloric restriction and aging: studies in mice and monkeys. In: Toxicol Pathol 37, 2009, S. 47–51. PMID 19075044 (Review).
- G. Mazzoccoli, M. F. Tevy, M. Borghesan, M. R. Delle Vergini, M. Vinciguerra: Caloric restriction and aging stem cells: the stick and the carrot? In: Experimental Gerontology. Band 50, Februar 2014, ISSN 1873-6815, S. 137–148, doi:10.1016/j.exger.2013.10.014, PMID 24211426.
- M. Maalouf, J. M. Rho, M. P. Mattson: The neuroprotective properties of calorie restriction, the ketogenic diet, and ketone bodies. In: Brain research reviews. Band 59, Nummer 2, März 2009, ISSN 0165-0173, S. 293–315, doi:10.1016/j.brainresrev.2008.09.002, PMID 18845187, PMC 2649682 (freier Volltext) (Review).
- A. L. Lin, W. Zhang u. a.: Caloric restriction increases ketone bodies metabolism and preserves blood flow in aging brain. In: Neurobiology of aging. [elektronische Veröffentlichung vor dem Druck] März 2015, ISSN 1558-1497, doi:10.1016/j.neurobiolaging.2015.03.012, PMID 25896951.
- E. A. Minina, V. Sanchez-Vera u. a.: Autophagy mediates caloric restriction-induced lifespan extension in Arabidopsis. In: Aging cell. Band 12, Nummer 2, April 2013, ISSN 1474-9726, S. 327–329, doi:10.1111/acel.12048, PMID 23331488.
- G. Cavallini, A. Donati u. a.: Towards an understanding of the anti-aging mechanism of caloric restriction. In: Current aging science. Band 1, Nummer 1, März 2008, ISSN 1874-6128, S. 4–9, PMID 20021367.
- G. S. Roth, A. M. Handy u. a.: Effects of dietary caloric restriction and aging on thyroid hormones of rhesus monkeys. In: Hormone and metabolic research. Band 34, Nummer 7, Juli 2002, ISSN 0018-5043, S. 378–382, doi:10.1055/s-2002-33469, PMID 12189585.
- Hans-Jörg Ehni: Ethik der Biogerontologie. Springer-Verlag, 2014, ISBN 978-3-658-03378-1, S. 56 (eingeschränkte Vorschau in der Google-Buchsuche).
- D. K. Ingram, M. Zhu u. a.: Calorie restriction mimetics: an emerging research field. In: Aging cell. Band 5, Nummer 2, April 2006, ISSN 1474-9718, S. 97–108, doi:10.1111/j.1474-9726.2006.00202.x, PMID 16626389 (Review).
- G. Testa, F. Biasi, G. Poli, E. Chiarpotto: Calorie restriction and dietary restriction mimetics: a strategy for improving healthy aging and longevity. In: Current Pharmaceutical Design. Band 20, Nummer 18, 2014, S. 2950–2977, ISSN 1873-4286, PMID 24079773.
- J. Yao, S. Chen u. a.: 2-Deoxy-D-glucose treatment induces ketogenesis, sustains mitochondrial function, and reduces pathology in female mouse model of Alzheimer’s disease. In: PloS one. Band 6, Nummer 7, 2011, ISSN 1932-6203, S. e21788, doi:10.1371/journal.pone.0021788, PMID 21747957, PMC 3128612 (freier Volltext).
- M. A. Lane, D. K. Ingram u. a.: 2-Deoxy-D-Glucose Feeding in Rats Mimics Physiologic Effects of Calorie Restriction. In: Journal of Anti-Aging Medicine. 1, 1998, S. 327–337, doi:10.1089/rej.1.1998.1.327.
- D. L. Smith, C. F. Elam u. a.: Metformin supplementation and life span in Fischer-344 rats. In: The journals of gerontology. Series A, Biological sciences and medical sciences. Band 65, Nummer 5, Mai 2010, S. 468–474, ISSN 1758-535X, doi:10.1093/gerona/glq033, PMID 20304770, PMC 2854888 (freier Volltext).
- H. E. Lebovitz, M. N. Feinglos: Mechanism of action of the second-generation sulfonylurea glipizide. In: The American journal of medicine. Band 75, Nummer 5B, November 1983, ISSN 0002-9343, S. 46–54, PMID 6369967.
- J. M. Ye, N. Dzamko u. a.: Direct demonstration of lipid sequestration as a mechanism by which rosiglitazone prevents fatty-acid-induced insulin resistance in the rat: comparison with metformin. In: Diabetologia. Band 47, Nummer 7, Juli 2004, ISSN 0012-186X, S. 1306–1313, doi:10.1007/s00125-004-1436-1, PMID 15232684.
- Gerald Rimbach, Christine Boesch-Saadatmandi, Jan Frank, Dagmar Fuchs, Uwe Wenzel, Hannelore Daniel, Wendy L. Hall, Peter D. Weinberg: Dietary isoflavones in the prevention of cardiovascular disease – A molecular perspective. In: Food and Chemical Toxicology. Band 46, Nr. 4, April 2008, S. 1308, doi:10.1016/j.fct.2007.06.029, PMID 17689850.
- B. Agarwal, J. A. Baur: Resveratrol and life extension. In: Annals of the New York Academy of Sciences. Band 1215, Januar 2011, ISSN 1749-6632, S. 138–143, doi:10.1111/j.1749-6632.2010.05850.x, PMID 21261652 (Review).
- M. Kyriazis: Calorie restriction mimetics: Examples and mode of action. In: Open Longevity Sci., Band 3, 2009, S. 17–21. doi:10.2174/1876326X00903010017
- T. Yamauchi, J. Kamon u. a.: The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity. In: Nature medicine, Band 7, Nummer 8, August 2001, S. 941–946, ISSN 1078-8956, doi:10.1038/90984, PMID 11479627.
- T. Chiba, T. Tsuchiya u. a.: Development of calorie restriction mimetics as therapeutics for obesity, diabetes, inflammatory and neurodegenerative diseases. In: Current genomics. Band 11, Nummer 8, Dezember 2010, S. 562–567, ISSN 1875-5488, doi:10.2174/138920210793360934, PMID 21629433, PMC 3078680 (freier Volltext).
- J. Rice: First Drug Shown to Extend Life Span in Mammals. In: Massachusetts Institute of Technology (Hrsg.): Technology Review. 8. Juli 2009, S. 1–2. Abgerufen im 9. Juli 2009.
- Madiraju et al. Metformin suppresses gluconeogenesis by inhibiting mitochondrial glycerophosphate dehydrogenase. Nature 2014;510:542–546. doi:10.1038/nature13270
- Abmagerungsmittel Rimonabant kann Suizidgedanken auslösen. (Memento des Originals vom 26. Februar 2009 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Dt. Ärzteblatt online, 12. Juni 2007.
- Avandia: Produktinformationstexte (PDF; 3,1 MB) Stand Juli 2010.
- Juris J. Meier, Michael A. Nauck, Wolfgang E. Schmidt, Baptist Gallwitz: Diagnose einer eingeschränkten Glukosetoleranz und Diabetesprävention: Kann die Diabetes-Epidemie aufgehalten werden? In: Dtsch Arztebl, 2002; 99(47), S. A-3182 / B-2685 / C-2500.
- Actos, Competact - Traitement du diabète de type 2. Fiche Médicament sous surveillance renforcée, 9. Juni 2011.
- Thomas M. van Himbergen, Alexa S. Beiser, Masumi Ai, Sudha Seshadri, Seiko Otokozawa, Rhoda Au, Nuntakorn Thongtang, Philip A. Wolf, Ernst J. Schaefer: Biomarkers for Insulin Resistance and Inflammation and the Risk for All-Cause Dementia and Alzheimer Disease. In: Arch Neurol., 69, 2012, S. 594, doi:10.1001/archneurol.2011.670.