Thymol
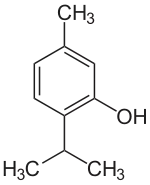
Das Thymol ist ein terpenoider Naturstoff. Der systematische Name (IUPAC) von Thymol ist 2-(1-Methylethyl)-5-methyl-phenol. Die Verbindung stellt ein Strukturisomer (Konstitutionsisomer) zum Carvacrol dar.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Thymol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C10H14O | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, würzig nach Thymian riechende, brennend schmeckende Platten[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 150,22 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
0,97 g·cm−3 (20 °C)[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
233 °C[3] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Vorkommen

Thymol kommt in sehr hoher Konzentration in Echtem Thymian (Thymus vulgaris, Thymus zygis), Elsholtzia (Elsholtzia polystachya) und Oregano (Origanum vulgare), daneben unter anderem auch in Majoran (Origanum majorana), Zitronen (Citrus limon), Echtem Koriander (Coriandrum sativum), Pferdeminze (Monarda punctata), Steinminze (Cunila origanoides), Bohnenkraut ( Satureja obovata, Satureja thymbra), Wilde Bergamotte (Monarda fistulosa), Ajowan (Trachyspermum ammi), Schwarznuss (Juglans nigra), Rosmarin (Rosmarinus officinalis), Zitronen-Monarde (Monarda citriodora) und Tagetes (Tagetes minuta) vor.[5]
Geschichte
Im alten Ägypten wurden Thymol und Carvacrol in Form von Thymianzubereitungen wegen der bakteriziden und fungiziden Eigenschaften zur Konservierung von Mumien benutzt.
Die kristalline Substanz Thymol wurde 1719 von Kaspar Neumann entdeckt und von M. Lallemand im Jahre 1842 rein dargestellt und durch eine Elementaranalyse charakterisiert. Damit konnte er das richtige Verhältnis der Elemente Kohlenstoff, Wasserstoff und Sauerstoff bestimmen, die diese Substanz aufbauen. Auch Friedlieb Ferdinand Runge beschäftigte sich mit der Chemie dieser Substanz. Die Kristallstrukturanalyse mit der genauen Bestimmung der Atompositionen wurde erst 1980 von Alain Thozet und M. Perrin publiziert.
Gewinnung und Darstellung
Thymol kann über die Reaktion von m-Kresol und Propen in Gegenwart von sauren Katalysatoren wie z. B. Zeolithen hergestellt werden.[6]
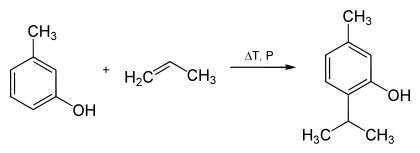 Synthese des Thymols aus m-Kresol und Propen
Synthese des Thymols aus m-Kresol und Propen
Eigenschaften

Der Feststoff schmilzt bei 49–51 °C und siedet bei 233 °C. Die Dichte beträgt 0,97 g·cm−3.[3] Der Dampfdruck beträgt 2,5 hPa bei 50 °C.[3] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,29395, B = 2522,332 und C = −28,5756 im Temperaturbereich von 337,5 bis 505,0 K.[7] Thymol bildet oberhalb der Flammpunktstemperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 104 °C.[3] Die Zündtemperatur beträgt ca. 285 °C.[3] Der Stoff fällt somit in die Temperaturklasse T3.
Da Thymol ein Phenolderivat ist, zeigt es das typische Verhalten von Phenol. Das heißt, es löst sich in Natronlauge oder Kalilauge und wird daraus durch Ansäuern wieder freigesetzt. Auch in Ethanol, Ether und Chloroform ist es gut löslich, in einem Liter Ethanol lösen sich bei 25 °C 1000 g Thymol, in einem Liter Chloroform etwa 1428 g Thymol. In Wasser ist es nur schwer löslich, in einem Liter Wasser löst sich etwa ein Gramm Thymol.
Thymol ergibt zwar in Wasser mit Eisen(III)-chlorid durch Ausbildung eines Komplexes eine Farbreaktion, diese ist jedoch aufgrund der geringen Löslichkeit des Thymols mit dem Auge nicht erkennbar. Nach Zugabe von Ethanol ist der Komplex jedoch durch eine grüne Farbe sichtbar.
Thymol kann zu Menthol hydriert werden.
Die Bromierung von Thymol mit elementarem Brom in Essigsäure führt ausschließlich zum 4-Bromthymol.[8]
Verwendung
Thymol zeichnet sich durch eine starke desinfizierende, fungizide und bakterizide Wirkung aus und wird wegen seines angenehmen Geschmacks in Mundwässern, Zahnpasta und in alkoholischer Lösung zur Hautdesinfektion[9] beziehungsweise lokal gegen Hautpilze eingesetzt, wie zum Beispiel als Bestandteil von Vaginalkapseln oder zur Behandlung von Mundhöhlenpilz bei AIDS-Patienten. In der Veterinärmedizin wird Thymol ebenfalls seit vielen Jahren zur Behandlung von Hautpilzinfektionen, aber auch als Verdauungsförderer verwendet. In der Bienenpflege findet Thymol eine Anwendung als Wirkstoff gegen Milbenbefall (Varroose).
Zur Aufbewahrung und Konservierung extrahierter Zähne vor der Weiterbearbeitung zu wissenschaftlichen Studienzwecken kann ebenfalls Thymol verwendet werden.[10]
Aus Thymol leiten sich die Triphenylmethanfarbstoffe Thymolphthalein, Thymolblau und Bromthymolblau ab, die als pH-Indikatoren Verwendung finden.
Einzelnachweise
- Eintrag zu THYMOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. Mai 2020.
- Eintrag zu Thymol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. September 2014.
- Eintrag zu Thymol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Eintrag zu Thymol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- THYMOL (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 3. Januar 2022.
- Patent EP0352505B1: Verfahren zur Herstellung von Thymol. Angemeldet am 1. Juli 1989, veröffentlicht am 9. September 1992, Anmelder: Bayer AG, Erfinder: Peter Wimmer et al.
- Stull, D.R.: Vapor Pressure of Pure Substances. Organic and Inorganic Compounds, in: Ind. Eng. Chem., 1947, 39, S. 517–540 (doi:10.1021/ie50448a022).
- Abstracts of Chemical Papers, Preparation of Parabromothymol, J. Chem. Soc., 1894, 66 (1), S. 19 (Volltext).
- Heinz Lüllmann, Klaus Mohr, Lutz Hein: Pharmakologie und Toxikologie, Georg Thieme, Stuttgart, 2010, S. 451 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jochen Peter Baumeister: Mikroradiografische Untersuchungen zum Einfluss unterschiedlicher Lagerungsmedien und der Politur auf die In-vitro-De- und -Remineralisation von bovinem und humanem Schmelz. (PDF; 3,5 MB) Zahnmed. Dissertation, Berlin 2011.


