Nickel(II)-perchlorat
Nickel(II)-perchlorat ist eine anorganische chemische Verbindung des Nickels aus der Gruppe der Perchlorate.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
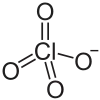 | ||||||||||
| Allgemeines | ||||||||||
| Name | Nickel(II)-perchlorat | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | Ni(ClO4)2 | |||||||||
| Kurzbeschreibung |
grüner geruchloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 257,59 g·mol−1 | |||||||||
| Aggregatzustand |
fest[2] | |||||||||
| Dichte |
3,4 g·cm−3[3] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
sehr gut löslich in Wasser und löslich in vielen organischen Lösungsmitteln[1] | |||||||||
| Brechungsindex |
1,55 (20 °C)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Gewinnung und Darstellung
Nickel(II)-perchlorat kann durch Reaktion von Nickel(II)-trifluoracetat und Perchlorsäure mit Trifluoressigsäure bei 25 °C gewonnen werden.[6] Das Hexahydrat kann durch Reaktion von Nickel(II)-hydroxid, Nickel(II)-chlorid oder Nickel(II)-carbonat mit Perchlorsäure gewonnen werden.[7]
Eigenschaften
Nickel(II)-perchlorat-Hexahydrat ist ein grüner geruchloser kristalliner Feststoff, der sehr gut löslich in Wasser und löslich in vielen organischen Lösungsmitteln ist.[1] Er beginnt sich ab einer Temperatur von 103 °C zu zersetzen. Es existiert neben dem Hexahydrat ebenfalls ein Nonahydrat und ein Tetrahydrat.[8] Mit Pyridinen und anderen Verbindungen bildet es Komplexverbindungen.[9] Das Hexahydrat besitzt eine hexagonale Kristallstruktur mit der Raumgruppe P6/mmm (Raumgruppen-Nr. 191).[10]
Verwendung
Nickel(II)-perchlorat-Hexahydrat wird zur Herstellung anderer chemischer Verbindungen verwendet.[4] Es wird zum Beispiel als Ausgangsmaterial für homometallische, dreikernige Scorpionatkomplexe in Studien von elektronischen und magnetischen Eigenschaften verwendet.[1] Es dient auch als Detonator in Sprengstoffen.[11]
Einzelnachweise
- Datenblatt Nickel(II) perchlorate hexahydrate, Reagent Grade bei AlfaAesar, abgerufen am 7. Juli 2016 (PDF) (JavaScript erforderlich).
- Eintrag zu Nickel(II)-perchlorat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Juli 2016. (JavaScript erforderlich)
- Kurt H. Stern: High Temperature Properties and Thermal Decomposition of Inorganic Salts with Oxyanions. CRC Press, 2000, ISBN 978-1-4200-4234-4, S. 200 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Nickel(II) perchlorate hexahydrate, purum p. a., crystallized, ≥98.0% (KT) bei Sigma-Aldrich, abgerufen am 7. Juli 2019 (PDF).
- Eintrag zu Nickel diperchlorate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- D. Nicholls: The Chemistry of Iron, Cobalt and Nickel Comprehensive Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-4643-0, S. 1131 (eingeschränkte Vorschau in der Google-Buchsuche).
- Daniela Sustac Roman: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, 2001, ISBN 978-0-470-84289-8, Nickel (II) perchlorate hexahydrate.
- John Newton: Cobalt, Nickel, and the Elements of the Platinum Group, Volume IX. 1922, ISBN 978-1-110-34627-1 (Online [PDF]).
- F. Madaule-Aubry, W. R. Busing, G. M. Brown: Crystal structures of complexes of nickel perchlorate with substituted pyridines. II. Tetrakis-(3,4-dimethylpyridine)nickel(II) perchlorate. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 24, S. 754, doi:10.1107/S056774086800316X.
- Ni(ClO4)2·6H2O (Ni[ClO4]2[H2O]6 ht) Crystal Structure. In: Springer Materials. Abgerufen am 7. Juli 2016.
- Robert D. Morrison, Brian L. Murphy: Environmental Forensics Contaminant Specific Guide. Academic Press, 2010, ISBN 978-0-08-049478-4, S. 169 (eingeschränkte Vorschau in der Google-Buchsuche).



