Tetrafluoroborsäure
Tetrafluoroborsäure ist eine anorganische Säure. Ihr Anion ist das Tetrafluoroboration (BF4−). Sie ist kommerziell als 45–50%ige Lösung erhältlich.
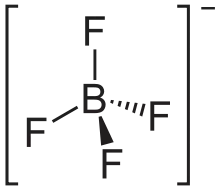
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Tetrafluoroborsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | HBF4 | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 87,81 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,38 g·cm−3 [1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
130 °C (Zersetzung)[1] | |||||||||||||||
| Löslichkeit |
mischbar mit Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Als großtechnische Synthese von Tetrafluoroborsäure wird die Reaktion von Borsäure mit 50%iger Flusssäure genutzt.
Eine weitere Möglichkeit besteht in der Umsetzung von Bortrifluorid mit Fluorwasserstoffsäure.[3]
Eigenschaften
Tetrafluoroborsäure ist nur in Lösung stabil. Die wässrige Lösung ist farblos und kann bis zu einer Konzentration von etwa 50 % konzentriert werden. Geometrisch ist das Boratom tetraedrisch von vier Fluoratomen umgeben und bildet ein kugelförmiges Anion. Das Boratom ist im BF4− also sp3-hybridisiert. Tetrafluoroborsäure besitzt einen pKs-Wert von −0,4. In wässriger Lösung liegt sie dissoziiert als H3O+(aq) und [BF4]−(aq) vor.
In der Umwelt ist das Tetrafluoroboration persistent und mobil.[4]
Verwendung
Tetrafluoroborsäure kann zur Synthese fluorierter Aromaten verwendet werden. Hierzu werden in einer Schiemann-Reaktion, einer Variante der Sandmeyer-Reaktion, Diazoaryle mit Tetrafluorborsäure umgesetzt.
Des Weiteren kann sie zur Abspaltung der Boc-Schutzgruppe und als Katalysator für Polymerisationen eingesetzt werden. Tetrafluoroborat-Ionen sind schwach koordinierende Anionen. Ihre Salze können daher ihre Anionen leicht gegen stärker komplexierende austauschen und werden aus diesem Grund oft zur Herstellung anderer Salze verwendet. Ein Beispiel ist Kupfer(II)-tetrafluoroborat, welches zur Herstellung von Kupferkomplexen dient.
Bis vor einigen Jahren fand die Tetrafluoroborsäure verbreitet Einsatz als Basis für saure Zinnelektrolyte. Durch den zwangsläufig entstehenden Anteil an Fluorid bzw. Flusssäure entsteht durch diese Elektrolyte jedoch ein Entsorgungsproblem. Daher finden sich heute meist Elektrolyte auf Basis von Methansulfonsäure oder Schwefelsäure.
Geschmolzene Alkalimetall- und Ammoniumtetrafluoroborate (wie Natrium-, Kalium- und Ammoniumtetrafluoroborat) sind gute Lösungsmittel für Metalloxide und werden in Flussmitteln für Lötung und Hartlötung verwendet.[5]
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 848.
Einzelnachweise
- Eintrag zu Tetrafluorborsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Eintrag zu Tetrafluoroboric acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 221–222.
- Isabelle Neuwald, Matthias Muschket, Daniel Zahn, Urs Berger, Bettina Seiwert: Filling the knowledge gap: A suspect screening study for 1310 potentially persistent and mobile chemicals with SFC- and HILIC-HRMS in two German river systems. In: Water Research. Band 204, 1. Oktober 2021, ISSN 0043-1354, S. 117645, doi:10.1016/j.watres.2021.117645 (sciencedirect.com [abgerufen am 4. Dezember 2021]).
- Toxikologische Bewertung von Tetrafluorborsäure und Salze (PDF) bei der Berufsgenossenschaft Rohstoffe und chemische Industrie (BG RCI), abgerufen am 22. August 2012.
