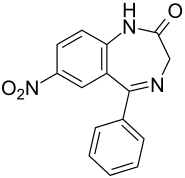
Nitrazepam
Nitrazepam (Handelsname z. B. Mogadan; Ersthersteller Hoffmann-La Roche) ist ein Arzneistoff aus der Gruppe der Benzodiazepine, mit ausgeprägten hypnotischen und antikonvulsiven Eigenschaften und wird zur symptomatischen Behandlung von Schlafstörungen und in der Behandlung der juvenilen Epilepsie eingesetzt. Es kann schon nach kurzer Anwendung zu einer psychischen und körperlichen Abhängigkeit kommen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Nitrazepam | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C15H11N3O3 | |||||||||||||||||||||
| Kurzbeschreibung |
gelbes, kristallines Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N05CD02 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 281,27 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
3,2[1] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben
Anwendungsgebiete (Indikationen)
Nitrazepam wird rasch und umfassend aus dem Verdauungstrakt in den systemischen Kreislauf aufgenommen. Durch die große hypnotische Potenz ist es deshalb zur symptomatischen Kurzzeitbehandlung von Insomnie (Schlafstörungen) von klinisch bedeutsamem Schweregrad, die zum Beispiel durch Überbeanspruchung, Angst, Sorge usw. entstehen, angezeigt. Bei organisch bedingten Schlafstörungen muss auch eine kausale Therapie der Grundkrankheit in Erwägung gezogen werden. Aufgrund der mittellangen Plasmahalbwertszeit (t1/2 = 15–30 Stunden) können Hang-over-Effekte (Müdigkeitsphänomene am Tag, vor allem nach dem Aufstehen) und eine Kumulationsneigung nach wiederholter Gabe vorkommen. Der durch Nitrazepam induzierte Schlaf unterscheidet sich vom normalen Schlaf. Während zwei Stadien des orthodoxen Schlafes verlängert sind, ist ein Stadium verkürzt. Hingegen wird der REM-Schlaf nur wenig beeinflusst. Heute werden als Schlafmittel anstatt Benzodiazepinen häufig die sogenannten Z-Drugs (Zopiclon, Zolpidem und Zaleplon) verordnet.
Nitrazepam wird in der adjuvanten Behandlung der Blitz-Nick-Salaam-Anfälle eingesetzt. Auch bei Kindern, die an einem Lennox-Gastaut-Syndrom mit myoklonisch-astatischen Anfällen leiden, wird es verwendet. Die genannten Epilepsie-Syndrome stellen insgesamt ein therapeutisches Problem dar. Ein Therapieversuch sollte wie die Behandlung dieser Epilepsien überhaupt dem Spezialisten vorbehalten sein.[3]
Gegenanzeigen (Kontraindikationen)
Nitrazepam ist kontraindiziert bei Patienten mit bekannter
- Überempfindlichkeit gegenüber dem Wirkstoff und den pharmazeutischen Hilfsstoffen
- bei schwerer respiratorischen Insuffizienz
- Schlafapnoe
- schwere chronische Hyperkapnie
- Myasthenia gravis pseudoparalytica (schwere Muskelschwäche)
- Suchtgefährdete; Alkoholismus
- schwere Leberinsuffizienz
- Zerebelläre und spinale Ataxien (Störungen der Gleichgewichtsregulation und der Bewegungskoordination)
Wechselwirkungen mit anderen Medikamenten
Von wenigen Ausnahmen abgesehen zeigt Nitrazepam bei richtiger Dosierung im Allgemeinen keine klinisch relevanten Interaktionen mit anderen Arzneistoffen. In therapeutischen Dosen verursacht Nitrazepam keine Enzyminduktion und kann daher gleichzeitig mit anderen Arzneistoffen, wie Antikoagulanzien oder oralen Antidiabetika appliziert werden.
Anwendung während Schwangerschaft und Stillzeit
Nitrazepam passiert die Plazentaschranke und erreicht in der Spätschwangerschaft im fetalen Plasma gleiche Konzentrationen wie im maternalen. Es darf deshalb nur in Ausnahmefällen bei zwingenden Gründen angewendet werden. Bei längerer Einnahme des Arzneimittels durch Schwangere können bei Neugeborenen Entzugserscheinungen auftreten. Eine Anwendung gegen Ende der Schwangerschaft oder während der Geburt kann beim Neugeborenen zu einer Hypothermie (gesenkte Körpertemperatur), Hypotonie (Blutdruckabfall), Atemdämpfung, Muskelhypotonie (herabgesetzte Muskelspannung) und Trinkschwäche führen. Deshalb ist die Anwendung von Nitrazepam im letzten Trimenon der Schwangerschaft kontraindiziert. Nitrazepam passiert die Plazentaschranke und tritt in die Muttermilch über. Es kann sich nach mehrmaliger Gabe dort anreichern, daher muss bei wiederholter Einnahme oder Einnahme hoher Dosen abgestillt werden.
Besondere Patientengruppen (Diabetiker, Nierenkranke)
Da der Qo-Wert von Nitrazepam hoch ist (Qo= 1), ist keine Dosisanpassung bei eingeschränkter Nierenfunktion notwendig. Bei vielen Arzneimitteln mit hohem Qo-Wert entstehen renal eliminierte Metaboliten, deren Aktivität nicht immer bekannt ist. Entsprechend ist bei schweren Einschränkungen der Nierenfunktion grundsätzlich Vorsicht geboten.[4]
Unerwünschte Wirkungen (Nebenwirkungen)
Akute Nebenwirkungen:
- Unter den akuten Nebenwirkungen bei der oralen Therapie mit Nitrazepam stehen Müdigkeit, Schläfrigkeit, Konzentrationsschwäche sowie die Beeinträchtigung der Konzentration und des Reaktionsvermögens im Vordergrund. Dadurch wird die Fähigkeit zur Teilnahme am Straßenverkehr und zur Bedienung von Maschinen beeinträchtigt.
Nebenwirkungen bei chronischer Anwendung:
- Beim chronischen Gebrauch von Nitrazepam besteht vor allem die Gefahr der Toleranz und Abhängigkeit von psychotropen Substanzen.
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Der psychotrope Arzneistoff Nitrazepam aus der Wirkstoffgruppe der 1,4-Benzodiazepine bindet mit hoher Affinität an GABA-Rezeptoren im ZNS. Nitrazepam verstärkt die hemmende Wirkung der GABA-ergen Übertragung auf unterschiedliche Neuronenverbände. Hieraus resultieren die spannungslösenden, erregungsdämpfenden und anxiolytischen (angstdämpfenden) Eigenschaften sowie sedierenden und hypnotischen Effekte. Darüber hinaus zeigt Nitrazepam muskelrelaxierende (Muskeltonus dämpfende) und antikonvulsive Eigenschaften.
Aufnahme und Verteilung im Körper (Pharmakokinetik)
Nitrazepam wird mit individuellen Unterschieden (60–90 %) aus dem Gastrointestinaltrakt resorbiert. Etwa 40–80 Minuten nach Einnahme von 5 mg Nitrazepam werden im Blutplasma Höchstwerte von durchschnittlich 40 ng pro ml erreicht. Das Verteilungsvolumen beträgt bei jungen Patienten 2 Liter/kg. Die Plasmaproteinbindung liegt bei 90 %. Nach oraler Verabreichung beträgt die Bioverfügbarkeit 80 %. Die metabolische Umwandlung in der Leber besteht in Reduktion zur 7-Amino-Verbindung, die ihrerseits in 7-Acetamidonitrazepam umgewandelt wird. Die optimale Wirkkonzentration dürfte bei 40 ng Nitrazepam pro ml Blutplasma liegen. Die Elimination von Nitrazepam aus dem Blut erfolgt biphasisch. Die durchschnittliche Eliminationshalbwertzeit liegt bei 30 Stunden. Unter chronischer Verabreichung ändert sich diese Eliminationshalbwertzeit nicht. Bei kontinuierlicher Einnahme von 5 mg Nitrazepam täglich wird das Fließgleichgewicht (Steady-State) mit Konzentrationen von etwa 40–60 ng Nitrazepam pro ml Plasma um den vierten Tag erreicht. Im Urin erscheinen nur wenige Prozente der oral verabreichten Dosen als unverändertes Nitrazepam.
Toxikologie
Benzodiazepine haben eine große therapeutische Breite, somit ist eine Überdosierung oder akzidentelle Vergiftung von Nitrazepam im Allgemeinen nicht lebensbedrohlich, es sei denn, dass es zusammen mit anderen ZNS-wirksamen Substanzen – einschließlich Alkohol – eingenommen wurde. Intoxikationen mit Benzodiazepinen sind gewöhnlich – in Abhängigkeit von der aufgenommenen Dosis – durch verschiedene Stadien der zentralen Dämpfung gekennzeichnet, die von Somnolenz, geistiger Verwirrung, Lethargie, Sehstörungen und Dystonie bis hin zu Ataxie, Bewusstlosigkeit, zentraler Atem- und Kreislaufdepression und Koma reichen können.
Bei leichteren Vergiftungserscheinungen sollten Patienten unter Beobachtung der Vitalfunktionen (Atem- und Kreislaufkontrolle) ausschlafen. In schwereren Fällen können weitere Maßnahmen (Magenspülung, Kreislaufstabilisierung, Intensivüberwachung) erforderlich werden. Bei erhaltenem Bewusstsein ist es sinnvoll, vorher frühzeitig Erbrechen auszulösen. Auf Grund der hohen Plasmaproteinbindung und des großen Verteilungsvolumens dürften forcierte Diurese oder Hämodialyse bei reinen Nitrazepamvergiftungen nur von geringem Nutzen sein.
Zur Aufhebung der zentraldämpfenden Wirkungen von Nitrazepam ist der selektive Benzodiazepin-Antagonist Flumazenil (Handelsname Anexate®) angezeigt. Flumazenil ist ein Imidazobenzodiazepin, das mit einer hohen Spezifität kompetitiv und reversibel an die GABA-Rezeptoren bindet und dabei die Wirkungen von Benzodiazepinen aufhebt. Aufgrund seiner strukturchemischen Analogie zu den Benzodiazepinen hat Flumazenil eine hohe Affinität für die Benzodiazepin-Bindungsstelle am GABAA-Rezeptor. Flumazenil führt zu keinen schwerwiegenden Nebenwirkungen und beeinflusst weder die Herzfrequenz noch den Blutdruck.
Sonstige Informationen
Chemische und pharmazeutische Informationen
Der chemische Name von Nitrazepam nach IUPAC-Nomenklatur lautet: 7-Nitro-5-phenyl-2,3-dihydro-1H-1,4-benzodiazepin-2-on. Es gehört somit zur Gruppe der Benzodiazepine. Nitrazepam ist ein gelbes, kristallines Pulver, dessen Schmelzpunkt im Bereich von 224 bis 226 °C liegt. Die Verbindung ist in Ethanol, Aceton, Chloroform und Essigsäureethylester löslich. Hingegen ist sie in Wasser, Diethylether und Hexan praktisch unlöslich.[1] Die Prüfung auf Identität nach Ph.Eur.5. Ausgabe erfolgt mit Hilfe der Infrarotspektroskopie durch Vergleich des Spektrums der Substanz mit dem von Nitrazepam CRS.
Gesetzliche Angaben
Deutschland: Als Vertreter aus der Wirkstoffgruppe der Benzodiazepine unterliegt Nitrazepam in der Bundesrepublik Deutschland der Gesetzgebung des Betäubungsmittelgesetzes (BtMG). Hier ist es in der Anlage III (verkehrsfähige und verschreibungsfähige Betäubungsmittel) aufgenommen worden. EINSCHRÄNKUNG BTM: ausgenommen in Zubereitungen, die ohne einen weiteren Stoff der Anlagen I bis III BtMG bis zu 0,5 vom Hundert als Tropflösung, jedoch nicht mehr als 250 mg je Packungseinheit, oder je abgeteilte Form bis zu 10 mg Nitrazepam enthalten.
Schweiz: Nitrazepam untersteht dem Betäubungsmittelgesetz und ist in der Betäubungsmittelverordnung im Anhang b – Verzeichnis der von der Kontrolle teilweise ausgenommenen betäubungsmittelhaltigen Stoffe und Präparate – aufgeführt und ist ohne Limitatio in der Spezialitätenliste. Das bedeutet, dass Nitrazepam in der Abgabekategorie B eingeordnet ist und auf einem normalen Rezeptformular verschrieben werden kann. Das Rezept darf ohne Zustimmung des Arztes nicht repetiert werden. Nitrazepam wird von der obligatorischen Grundversicherung normal vergütet.[5]
Handelsnamen
- Dormo-Puren (D)
- Imeson (D)
- Mogadan (D)
- Mogadon (A, CH)
- Novanox (D)
- Radedorm (D)
- Somnibel N (D)
Siehe auch
Literatur
- Hermann J. Roth: Medizinische Chemie : Targets und Arzneistoffe ; 157 Tabellen. Dt. Apotheker-Verlag, Stuttgart 2005, ISBN 3-7692-3483-9
- Europäische Arzneibuch-Kommission (Hrsg.): EUROPÄISCHE PHARMAKOPÖE 5. AUSGABE. Band 5.0–5.8, 2006.
- W. Forth, D. Henschler, W. Rummel: Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. URBAN & FISCHER, München 2005, ISBN 3-437-42521-8.
- Patent US3121076.
Einzelnachweise
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; ISBN 978-0-911910-00-1
- Datenblatt Nitrazepam bei Sigma-Aldrich, abgerufen am 16. April 2011 (PDF).
- Fachinformation Mogadon®
- Dosisanpassung bei Niereninsuffizienz bei Dosing (Memento vom 27. September 2007 im Internet Archive)
- Swissmedic: Verzeichnis aller betäubungsmittelhaltigen Stoffe und Präparate (Memento vom 21. Dezember 2015 im Internet Archive), Stand August 2011.