Zaleplon
Zaleplon (Hersteller: Wyeth) ist ein Arzneistoff zur Behandlung von Einschlafstörungen.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
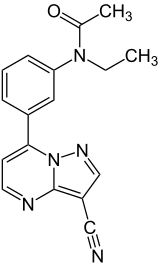 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Zaleplon | |||||||||||||||||||||
| Andere Namen |
N-[3-(3-Cyanopyrazolo[1,5-a]pyrimidin-7-yl)phenyl]-N-ethylacetamid (IUPAC) | |||||||||||||||||||||
| Summenformel | C17H15N5O | |||||||||||||||||||||
| Kurzbeschreibung |
weißes bis fast weißes Pulver[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N05CF03 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 305,33 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser, wenig löslich in Ethanol und Propylenglycol[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Die Substanz aus der Gruppe der Pyrazolopyrimidine (nicht-benzodiazepinen Hypnotika/Sedativa, Z-Drugs) ist aufgrund ihrer kurzen Eliminationshalbwertszeit von circa einer Stunde und des Fehlens aktiver Metaboliten zur Behandlung primärer Einschlafstörungen geeignet.
Geschichte
In der EU[3] und der Schweiz wurde der Wirkstoff als das Präparat Sonata 1999 zugelassen. 2004 erteilte die Europäische Arzneimittel-Agentur (EMA) eine unbefristete Zulassung.[3] In der Schweiz ging das Produkt jedoch 2013 wieder außer Handel; in der EU folgte dieser Schritt am 3. Juli 2015, an dem die EMA die Zulassung auf Wunsch des Zulassungsinhabers zurückzog.[3][4] Zaleplon ist noch in den USA als Sonata und Zaleplon erhältlich, in Kanada unter dem Namen Starnoc.[5]
Klinische Angaben
Anwendungsgebiete (Indikationen)
Der Wirkstoff Zaleplon ist angezeigt zur Behandlung von Patienten, die Schwierigkeit haben, einzuschlafen und für die die Störungen schwerwiegend und beeinträchtigend sind und eine unzumutbare Belastung darstellen. Die maximale Behandlungsdauer soll zwei Wochen nicht überschreiten. Das Medikament kann unmittelbar vor dem Zubettgehen eingenommen werden oder nachdem der Patient zu Bett gegangen ist und Schwierigkeiten hat einzuschlafen. Die Anwendung nach einer Nahrungseinnahme verzögert die Zeit zum Erreichen der maximalen Plasmakonzentration um circa zwei Stunden, das Ausmaß der Resorption bleibt jedoch unverändert.
Gegenanzeigen (Kontraindikationen)
Bei Leberinsuffizienz, Schlaf-Apnoe-Syndrom, Myasthenia gravis, schwerer respiratorischer Insuffizienz, Kindern und Jugendlichen unter 18 Jahren, Alkoholismus, Drogenabhängigkeit, Schwangerschaft oder Stillzeit darf Zaleplon nicht verabreicht werden.
Wechselwirkungen mit anderen Medikamenten
Mittelschwere Interaktionen von Zaleplon sind mit Ethanol zu erwarten. Es muss mit verstärkten Wirkungen wie Sedierung, Benommenheit und verminderter Aufmerksamkeit gerechnet werden. In Abhängigkeit von der individuellen Prädisposition kann die Konzentrationsfähigkeit (z. B. im Straßenverkehr) stark beeinträchtigt sein. In Einzelfällen können lebensbedrohliche Zustände durch Atemdepression und kardiovaskuläre Effekte auftreten.
Besondere Patientengruppen (Diabetiker, Nierenkranke)
Da der Qo-Wert von Zaleplon hoch ist (Qo=1), ist keine Dosisanpassung bei eingeschränkter Nierenfunktion notwendig. Bei vielen Arzneimitteln mit hohem Qo-Wert entstehen renal eliminierte Metaboliten, deren Aktivität nicht immer bekannt ist. Entsprechend ist bei schweren Einschränkungen der Nierenfunktion grundsätzlich Vorsicht geboten.[6][7]
Literatur
- Hermann J. Roth: Medizinische Chemie : Targets und Arzneistoffe ; 157 Tabellen. Dt. Apotheker-Verlag, Stuttgart 2005, ISBN 3-7692-3483-9.
- W. Forth, D. Henschler, W. Rummel: Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. Urban & Fischer, München 2005, ISBN 3-437-42521-8.
Einzelnachweise
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station 2006, ISBN 0-911910-00-X.
- Datenblatt Zaleplon bei Sigma-Aldrich, abgerufen am 25. April 2011 (PDF).
- Sonata. (PDF; 60 kB) Withdrawal of the marketing authorisation in the European Union. Europäische Arzneimittel-Agentur, 1. Oktober 2015, abgerufen am 24. November 2018 (englisch).
- Zaleplon|Sonata®|49|1999. In: Pharmazeutische Zeitung. 20. November 2017, abgerufen am 19. Oktober 2018: „HERSTELLER Meda […] DARREICHUNGSFORM Nicht mehr im Handel.“
- Eintrag zu Zaleplon in der DrugBank der University of Alberta
- Dosisanpassung bei Niereninsuffizienz. Zaleplon. (Nicht mehr online verfügbar.) Universitätsklinikum Heidelberg, 7. Januar 2013, archiviert vom Original am 23. Mai 2013; abgerufen am 20. Oktober 2018 (Webarchivfassungen ab 2016 warnen, die Seite sei möglicherweise veraltet, und leiten auf die aktuelle Startseite von dosing.de um).
- D. J. Greenblatt, J. S. Harmatz, L. L. von Moltke, B. L. Ehrenberg, L. Harrel, K. Corbett, M. Counihan, J. A. Graf, M. Darwish, P. Mertzanis, P. T. Martin, W. H. Cevallos, R. I. Shader: Comparative kinetics and dynamics of zaleplon, zolpidem, and placebo. In: Clin Pharmacol Ther. 64, 1998, S. 553–561.