Indocyaningrün
Indocyaningrün (ICG von englisch indocyanine green) ist ein fluoreszierender Farbstoff, der in der Medizin als Indikatorsubstanz (z. B. für die photometrische Leberfunktionsdiagnostik und Fluoreszenzangiographie) bei Herz-, Kreislauf-, Leber- und Augenerkrankungen eingesetzt wird. Dabei wird es intravenös verabreicht und in Abhängigkeit von der Leberleistung mit einer Halbwertszeit von ca. 3–4 Minuten[3] aus dem Körper eliminiert. ICG-Natriumsalz liegt normalerweise in Pulverform vor und kann in unterschiedlichen Lösungsmitteln gelöst werden; meist wird zur besseren Löslichkeit 5 % (< 5 % je nach Charge) Natriumiodid beigegeben.[8] Das sterile Lyophilisat einer Wasser-ICG-Lösung ist in Deutschland und den Niederlanden unter dem Namen Verdye (Hersteller: Diagnostic Green) als Diagnostikum für die intravenöse Anwendung zugelassen.[9]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
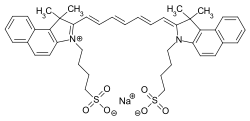 | ||||||||||||||||||||||
| ICG-Natriumsalz | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Indocyaningrün | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C43H47N2NaO6S2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
V04CX | |||||||||||||||||||||
| Wirkstoffklasse |
Diagnosticum | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 774,99 g·mol−1 | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
ICG wurde im Zweiten Weltkrieg als Farbstoff für die Photographie entwickelt und im Jahr 1957 an der Mayo Clinic für den Einsatz in der Humanmedizin getestet. Nach FDA-Zulassung 1959 wurde ICG zunächst vor allem in der Leberfunktionsdiagnostik und später in der Kardiologie eingesetzt. 1964 konnte mithilfe von Indocyaningrün von S. Schilling der renale Blutfluss bestimmt werden. Ab 1969 diente ICG auch zur Forschung und Diagnostik an subretinalen Prozessen am Auge (in der Aderhaut). In den Jahren seit 1980 konnten durch die Entwicklung neuartiger Kameras und besseren Filmmaterials beziehungsweise neuer photometrischer Messgeräte viele technische Schwierigkeiten ausgeräumt werden. Mittlerweile hat sich der Einsatz von ICG in der Medizin (und im Besonderen bei der Fluoreszenzangiographie in der Augenheilkunde) als Standard etabliert. Daher wird bei Bezeichnung einer Fluoreszenzangiographie auch zwischen der NA-Fluoreszenzangiographie oder der ICGA/ICG-Fluoreszenzangiographie unterschieden. Es wurden mittlerweile weltweit etwa 3000 wissenschaftliche Publikationen zu ICG veröffentlicht.
Optische Eigenschaften
Indocyaningrün absorbiert und fluoresziert im sichtbaren und nahinfraroten Bereich. Sowohl die Absorption als auch die Fluoreszenz sind in starkem Maße von dem verwendeten Lösungsmittel und der Konzentration abhängig.[10] ICG absorbiert hauptsächlich zwischen 600 nm und 900 nm und emittiert Fluoreszenz zwischen 750 nm und 950 nm. Die große Überlappung der Absorptions- und Fluoreszenzspektren führt zu einer starken Reabsorption der Fluoreszenz durch ICG selbst.
Das Fluoreszenzspektrum ist recht breit. Seine Maxima liegen in Wasser bei ca. 810 nm und in Blut bei ca. 830 nm. Für medizinische Anwendungen, die auf Absorption basieren, ist das Absorptionsmaximum bei ca. 800 nm (in Blutplasma bei kleinen Konzentrationen) wichtig. In Kombination mit Fluoreszenzdetektion wird häufig auch mit Lasern der Wellenlänge um 780 nm gearbeitet. Bei dieser Wellenlänge absorbiert ICG noch sehr gut, und es ist trotzdem noch technisch möglich, das Anregungslicht zu unterdrücken, um die Fluoreszenz zu detektieren.
Toxizität und Nebenwirkungen
Indocyaningrün wird in der Leber mikrosomal metabolisiert und nur über Leber und Gallenwege ausgeschieden;[12] da es nicht von der Darm-Schleimhaut resorbiert wird, ist die Toxizität als gering einzustufen.[8] In der Schwangerschaft ist eine Gabe nicht risikofrei.[12] Seit September 2007 ist bekannt, dass ICG durch Einwirkung von UV-Licht in toxische Abfallstoffe zerfällt. Dabei entstehen mehrere, noch unbekannte Stoffe. Eine im Februar 2008 veröffentlichte Studie zeigt aber, dass ICG (die Substanz ohne UV-Einwirkung) grundsätzlich als solches nur gering toxisch ist.[13][3] Die bei Tieren gemessenen intravenösen LD50-Werte liegen bei 60 mg/kg bei der Maus[5][6] und 87 mg/kg[5][7] bei Ratten.
Selten – bei einem von 42.000 Fällen – treten beim Menschen leichte Nebenwirkungen wie Halsschmerzen und Hitzewallungen auf. Effekte wie anaphylaktischer Schock, Hypotension, Tachykardie, Dyspnoe und Urtikaria sind nur in einzelnen Fällen gefunden worden; das Risiko schwerer Nebenwirkungen steigt bei Patienten mit chronischem Nierenversagen.[3][14] Die Häufigkeiten von milden, mittelgradigen und schweren Nebenwirkungen betragen lediglich 0,15 %, 0,2 % und 0,05 %; die Todesfallrate liegt bei 1:333.333.[8] Bei der Konkurrenz-Substanz Fluorescein liegt der Anteil der Personen mit Nebenwirkungen bei 4,8 % und die Todesfallrate bei 1:222.222.
Weil die Zubereitung Natriumiodid enthält, muss auf Iodunverträglichkeit getestet werden. Da etwa 5 % Iodid zugesetzt sind, beträgt der Iod-Gehalt einer 25 mg-Ampulle 0,93 mg. Im Vergleich dazu sind in Zubereitungen für eine KM-CT (140 ml) 300 mg/ml oder für eine Corona-Angiographie (200 ml) 350 mg/ml Iod enthalten.
Verwendung
ICG-Angiographie in der Augenheilkunde / Ophthalmologie
Indocyaningrün besitzt die Fähigkeit, sich zu 98 % an Plasmaproteine – zu 80 % an Globuline und zu 20 % an Alphalipoprotein und Albumin[3] – zu binden und zeigt dadurch, im Vergleich zu Fluorescein als Marker, eine geringere Leckage (langsameren Farbaustritt aus den Gefäßen, extravasal). Durch die Plasmaproteinbindung verbleibt ICG bis zu 20–30 Minuten in den Gefäßen (intravasal); bei der Untersuchung des Auges verbleibt es damit lange in stärker durchbluteten Geweben wie der Aderhaut sowie den Blutgefäßen der Retina.[3]
Die ICG-Angiographie wird in der Ophthalmologie bei der Angiographie des Augenhintergrundes in folgenden Fällen eingesetzt:
- Bei Vermutung von Netzhaut-Schädigungen mit schlecht abgegrenzten Rändern und bei Blutungen
- In der Basisdiagnostik bei Verdacht einer bestimmten Form einer AMD
- Bei Vermutung einer Chorodialen Neovaskularisation (CNV)
- Bei Vermutung einer Polypoidalen chorodialen Vaskulopathie (PCV)
- Bei Vermutung einer Retinalen angiomatösen Proliferation (RAP)
- Bei Vermutung eines Aderhautmelanoms
- Bei Vermutung eines Aderhauthämangioms
- Bei Vermutung von Aderhautmetastasen
- Im Einzelfall zur erweiterten Diagnostik oder Dokumentation (Differentialdiagnostik)
Aktuell wird die ICG-Angiographie zur Therapiekontrolle sowie Verlaufsbeurteilung bei den neuen VEGF-Hemmern eingesetzt (Macugen, Lucentis, Avastin).[15]
ICG-Diagnostik zur nicht-invasiven Überwachung der Leber- bzw. Splanchnikusperfusion
Aufgrund der hohen Bindungsrate von Indocyaningrün an die Plasmaproteine erlaubt es die Substanz, durch Kontrolle der Veränderungen der ICG-PDR (ICG-Plasmaverschwinderate) die Leber- bzw. Splanchnikusperfusion zu messen. Diese Methode eignet sich daher als Prognoseparameter für die Überlebenswahrscheinlichkeit bei chirurgischen Intensivpatienten.[16] Da bei etwa zwei Dritteln der chirurgischen Intensivpatienten, bei denen ein erweitertes hämodynamisches Monitoring indiziert ist, reduzierte PDR-Werte gemessen werden können, kann von einer signifikant erhöhten Mortalität gesprochen werden. Die regelmäßige Überwachung der ICG-PDR (meistens zwei Mal täglich) trägt dazu bei, Einschränkungen der Leber- bzw. Splanchnikusperfusion frühzeitig zu erkennen. Nach intravenöser ICG-Gabe wird über ein externes Monitoring-Gerät die Plasmaverschwinderate gemessen.
Perfusionsdiagnostik von Geweben und Organen mit ICG
ICG wird als Marker bei der Beurteilung der Perfusion von Geweben und Organen in vielen medizinischen Bereichen eingesetzt. Das für die Anregung der Fluoreszenz benötigte Licht wird durch eine Nahinfrarotlichtquelle erzeugt, die direkt auf einer Kamera befestigt wird. Eine digitale Videokamera erlaubt die Aufnahme der ICG-Fluoreszenz in Echtzeit, wodurch eine Perfusion beurteilt und dokumentiert werden kann.
Die Anwendung erfolgt bei:
- Plastischer Chirurgie: Haut- und Muskeltransplantate; Bestimmung der Amputationshöhe
- Abdominalchirurgie: Gastrointestinale Anastomosen
- Allgemeinen Chirurgie: Wundheilung und Ulzera
- Inneren Medizin: Diabetische Extremitäten
- Herzchirurgie: Aortokoronare Bypässe
Außerdem kann ICG als Tracer bei der Perfusionsdiagnostik des Gehirns eingesetzt werden. Im Falle von Schlaganfallpatienten erscheint ein Monitoring in der Genesungsphase sowohl durch Messung der ICG Absorption[17] als auch der Fluoreszenz[18] im klinischen Alltag realisierbar.
ICG-gestützte Navigation zur Wächterlymphknotenbiopsie bei Tumoren
Die Wächterlymphknoten-Biopsie, auch „Sentinel-Lymphknoten-Biopsie“ (SLB oder SLN-Biopsie) genannt, ermöglicht einen selektiven, minimal-invasiven Zugang zur Beurteilung des regionalen Lymphknotenstatus bei bösartigen Tumoren. Der erste drainierende Lymphknoten, der „Wächter“, repräsentiert dabei einen vorhandenen oder nicht vorhandenen Tumorbefall einer gesamten Lymphknotenregion. Die Methode wurde unter Verwendung von Radionukliden und/oder Blaufarbstoff für das Mammakarzinom, das maligne Melanom, aber auch gastrointestinale Tumoren validiert und ermöglicht eine gute Detektionsrate und Sensitivität. Für die SLB wurde im Vergleich zur vollständigen Lymphknotendissektion eine reduzierte Mortalität nachgewiesen, jedoch verbleiben für die Methoden Nachteile in Hinblick auf die Verfügbarkeit, Anwendung und Entsorgung des Radionuklids sowie das Risiko für eine Anaphylaxie (bis zu 1 %) für den Blaufarbstoff. Indocyaningrün (ICG) wurde durch seine Nahinfrarot-Fluoreszenz und vorausgegangene Toxizitätsuntersuchungen in dieser Untersuchung als neue, alternative Methode für SLB evaluiert in Hinblick auf die klinische Anwendung der transkutanen Navigation und Lymphgefäßvisualisierung sowie SLN-Detektion. Durch ICG-Fluoreszenznavigation lassen sich im Vergleich zu den konventionellen Methoden eine hohe Detetktionsrate und Sensitivitätsrate erzielen. Unter Berücksichtigung einer Lernkurve bietet die neue, alternative Methode die Kombination aus Lymphographie und SLB sowie die Möglichkeit zur SLB unter Verzicht auf radioaktive Substanzen bei solitären Tumoren.[19][20][21]
Rheumadiagnostik
Die Physikalisch-Technische Bundesanstalt und die mivenion GmbH entwickelten ein bildgebendes, „Rheumascan“ genanntes Verfahren zur Diagnostik der Mikrozirkulationsstörungen an den Händen. Dieses bildgebende Verfahren kann bei arthritischen und rheumatoiden Erkrankungen eingesetzt werden. Als Marker für die Mikrozirkulationsstörung wird ICG verwendet.[22][23][24] Rheumascan wurde auf dem European Congress of Radiology 2009 erstmals vorgestellt.
Neurochirurgie
Indocyaningrün wird auch in der vaskulären Neurochirurgie zur Visualisierung von vaskulären Strukturen verwendet.[25]
Aktuelle Forschung
Die Forschung im Bereich ICG ist aus heutiger Sicht noch lange nicht abgeschlossen. Insbesondere scheint es so, als hätte ICG unter bestimmten Umständen – wie passender Laserstärke und bestimmter Wellenlängen – die Eigenschaft, eine photodynamische Reaktion auszulösen. Somit könnte ICG mittelfristig auch als PDT-Therapeutikum eingesetzt werden.[26][27] In einer weiteren Untersuchung wurde gezeigt, dass Indocyaningrün durch Laserlicht zerstört wird. Die entstehenden Produkte wirkten sich in vitro negativ auf Zellen aus der Schweine-Retina aus.[28]
Auf der anderen Seite ist ICG im Bereich der (Perfusions-)Diagnostik sehr universell einsetzbar, weswegen auch hier weitere Forschung stattfindet.
Literatur
- P. E. Stanga, J. I. Lim, P. Hamilton: Indocyanine green angiography in chorioretinal diseases: indications and interpretation: an evidence-based update. In: Ophthalmology, Band 110, 2003, S. 15–21. PMID 12511340 – Evidenzgrad I Studie über 350 Publikationen
Weblinks
- Optical Absorption of Indocyanine Green (ICG). (englisch)
- Hersteller Diagnostic Green (englisch)
Einzelnachweise
- Eintrag zu INDOCYANINE GREEN in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Februar 2020.
- Externe Identifikatoren von bzw. Datenbank-Links zu Indocyaningrün, Säure: CAS-Nummer: 28782-33-4, PubChem: 71587099, ChemSpider: 19800615, DrugBank: DB09374, Wikidata: Q27275190.
- S. H. Wipper: Validierung der Fluoreszenzangiographie zur intraoperativen Beurteilung und Quantifizierung der Myokardperfusion. (PDF; 1,6 MB) Dissertation, 2006, S. 18–23.
- Datenblatt Cardiogreen bei Sigma-Aldrich, abgerufen am 24. Februar 2020 (PDF).
- Eintrag zu Indocyanine green in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Toxicology and Applied Pharmacology. Band 44, 1978, S. 225.
- Drugs in Japan, 1995, S. 189.
- A. J. Augustin, G. K. Krieglstein in: Augenheilkunde. Springer-Verlag, 2001, ISBN 3-540-65947-1.
- ABDA-Datenbank (Stand: 5. Dezember 2009).
- Scott Prahl: Optical Absorption of Indocyanine Green (ICG). In: OMLC. Scott Prahl & Steve Jacques, 2018, abgerufen am 15. Oktober 2020 (englisch).
- M. L. Landsman, G. Kwant, G. A. Mook, W. G. Zijlstra: Light-absorbing properties, stability, and spectral stabilization of indocyanine green. In: Journal of Applied Physiology. Band 40, Nr. 4, 1. April 1976, S. 575, doi:10.1152/jappl.1976.40.4.575 (englisch).
- Manfred J. Müller: Ernährungsmedizinische Praxis: Methoden – Prävention – Behandlung. 2. Auflage, Springer, Kiel 2007, ISBN 978-3-540-38230-0, S. 76.
- J. Hillenkamp: Investigation of Indocyanine Green Toxicity in vitro. DOG, Band 09, 2007, Universität Regensburg.
- R. Benya, J. Quintana, B. Brundage: Adverse reactions to indocyanine green: A case report and a review of the literature. In: Cathet and Cardiov Diagnosis Band 17, 1989, S. 231–233.
- Schmidt-Erfurt, DOG Kongress Berlin 2007.
- S. Sakka, Konrad Reinhart, Andreas Meier-Hellmann in: Chest Band 122, Nr. 5, 2002, S. 1715–1720.
- A. Liebert, H. Wabnitz, J. Steinbrink, M. Möller, R. Macdonald, H. Rinneberg, A. Villringer, H. Obrig: Bed-side assessment of cerebral perfusion in stroke patients based on optical monitoring of a dye bolus by time-resolved diffuse reflectance. In: Neuroimage, Band 24, 2005, S. 426–435.
- A. Liebert, H. Wabnitz, H. Obrig, R. Erdmann, M. Möller, R. Macdonald, H. Rinneberg, A. Villringer, J. Steinbrink: Non-invasive detection of fluorescence from exogenous chromophores in the adult human brain. In: Neuroimage, Band 31, 2006, S. 600–608.
- Forschungsgruppe „Fluoreszenzfarbstoff-gestützte Navigation zur Sentinel-Lymphknoten-Biopsie und real-time Lymphographie bei solitären Tumoren“. (Memento vom 5. Dezember 2013 im Internet Archive) Berufsgenossenschaftliche Unfallklinik Ludwigshafen (BG Klinik)
- C. Hirche, D. Murawa, Z. Mohr, S. Kneif, M. Hünerbein: ICG fluorescence-guided sentinel node biopsy for axillary nodal staging in breast cancer. In: Breast Cancer Res Treat. Band 121, Nr. 2, Juni 2010, S. 373–378.
- C. Hirche, S. Dresel, R. Krempien, M. Hünerbein: Sentinel node biopsy by indocyanine green retention fluorescence detection for inguinal lymph node staging of anal cancer: preliminary experience. In: Ann Surg Oncol. Band 17, Nr. 9, September 2010, S. 2357–2362.
- "Rheuma-Video" offenbart Entzündungsherde frühzeitig. TSBmedici, 20. August 2009.
- C. Bremer, S. Werner, H.-E. Langer: Assessing activity of rheumatoid arthritis with fluorescence optical imaging. In: European Musculoskeletal Review. Band 4, Nr. 2, 2009.
- Rheuma-Video offenbart Entzündungsherde frühzeitig. (Memento vom 3. Dezember 2013 im Internet Archive) In: Ärzte Zeitung, 21. August 2009.
- Indocyaningrün. Ars Neurochirurgica
- Christoph Abels, Sonja Fickweiler, Petra Weiderer, Wolfgang Bäumler, Ferdinand Hofstädter, Michael Landthaler, R.-M. Szeimies: Indocyanine green (ICG) and laser irradiation induce photooxidation. In: Archives of Dermatological Research, Band 292, Nr. 8, August 2000. doi:10.1007/s004030000147.
- R.-M. Szeimies, T. Lorenzen, S. Karrer, C. Abels, A. Plettenberg: Photochemotherapie kutaner Aids-assoziierter Kaposi-Sarkome mit Indocyaningrün und Laserlicht. In: Der Hautarzt, Springer, Berlin / Heidelberg, Band 52, Nr. 4, März 2001, S. 322–326. doi:10.1007/s001050051315.
- Eva Engel, Rüdiger Schraml, Tim Maisch, Karin Kobuch, Burkhard König, Rolf-Markus Szeimies, Jost Hillenkamp, Wolfgang Bäumler, Rudolf Vasold: Light-induced decomposition of indocyanine green In: Invest. Ophthalmol. Vis. Sci. Band 49, Nr. 5, Mai 2008. doi:10.1167/iovs.07-0911.