Retinopathia centralis serosa
Als Retinopathia centralis serosa (RCS), auch zentrale seröse Netzhautschädigung oder Chorioretinopathia centralis serosa (CRCS), veraltet Morbus Kitahara, wird eine Erkrankung der Netzhaut (Retina) des Auges bezeichnet, bei der sich Flüssigkeit aus den Blutgefäßen der Aderhaut (Choroidea) unter Schichten der Netzhaut ansammelt und sie dadurch örtlich begrenzt vom Pigmentepithel abhebt.
| Klassifikation nach ICD-10 | |
|---|---|
| H35.7 | Abhebung von Netzhautschichten |
| ICD-10 online (WHO-Version 2019) | |
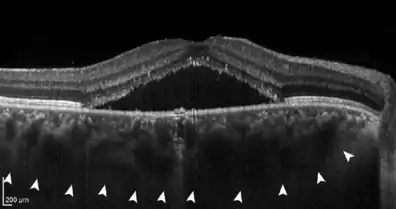
Die im Bereich der zentralen Sehgrube (Fovea centralis) angesammelte seröse Flüssigkeit trennt die Netzhautschicht der lichtempfindlichen Sinneszellen (Sehzellen) von dem sie ernährenden Pigmentepithel und der Aderhaut. Da hierunter die Versorgung der Netzhaut mit Nährstoffen und Sauerstoff, aber auch der Abbau der biochemischen Produkte des Sehzyklus leiden, können die Zapfen ihre Funktion als Photorezeptoren nicht mehr vollständig erfüllen. Dies zeigt sich dem Betroffenen als ein zentraler grau-schwarzer Fleck (Zentralskotom) im Gesichtsfeld. Daneben können Lageverhältnisse der Netzhaut durch die lokale Anhebung so verändert werden, dass Bilder – wie das eines Amsler-Gitters – verzerrt wahrgenommen werden (Metamorphopsie).
Unterschieden wird grundsätzlich zwischen akuter und chronischer Form der Erkrankung. Eine Spontanheilung wird innerhalb von 4 Monaten bei 68 %, innerhalb von 6 Monaten bei 84 % der Patienten beobachtet. Im Falle einer Chronifizierung ist eine Behandlung mit Medikamenten, verschiedenen Lasertechniken und intravitrealen Injektionen möglich.[1]
Im Unterschied zum früheren Begriff der Retinopathia centralis serosa berücksichtigt der heutige Begriff der Chorioretinopathia centralis serosa die maßgebliche Mitbeteiligung der Aderhaut (Choroidea).[1] Wegen der charakteristischen Aderhautverdickung wird die Chorioretinopathia centralis serosa zum Spektrum der Pachychoroidalen Erkrankungen gezählt, innerhalb dessen sie als Stadium II von vieren eingestuft werden kann.[2]
Epidemiologie
Die Chorioretinopathia centralis serosa tritt mit einer Häufigkeit von 1:10.000 auf. Sie betrifft besonders häufig Männer im jungen und mittleren Alter (30–50 Jahre). Männer erkranken sechsmal häufiger als Frauen. Das Auftreten der Retinopathia centralis serosa steht oft in Zusammenhang mit geistigem oder körperlichem Stress. Die RCS ist die vierthäufigste nichtoperative Netzhauterkrankung.[3] Sie wird gelegentlich als Managerkrankheit des Auges bezeichnet.[4][5]
Symptome
Typische Symptome bei Retinopathia centralis serosa sind[1]:
- Geringe Sehverschlechterung
- Verschwommensehen
- „grau-schwarzer Fleck“ (Skotom) im Gesichtsfeld (reduzierte Kontrastempfindlichkeit)
- Bildverzerrungen (Metamorphopsie)
- Weitsichtigkeit (Hyperopie)
- Farbwahrnehmungsstörungen
Die Symptome sind je nach Ausdehnung und Lage der Netzhautanhebung unterschiedlich. Bei einem Leck im Bereich der zentralen Netzhaut (Makula) ergeben sich starke Verzerrungen. Bei Lecks, die außerhalb der Makula auftreten, werden manchmal nur kleine exzentrisch gelegene, schillernd farbige Flecken bzw. Ringe wahrgenommen. Besonders auffällig können diese beim Blinzeln und im Halbdunkel sein, vor Tabellen am Bildschirm und bei der Betrachtung weißer Flächen. Bei der Arbeit mit Tabellen erkennt man auch leicht die Verzerrung von geraden Linien zu Wellen und Verwerfungen. Man hat anfangs meist nur das Gefühl einer leichten Blendung – diese aber ist nur einseitig und vergeht nicht innerhalb von Minuten, wie man das sonst gewöhnt ist.
Risikofaktoren
Da die Chorioretinopathia centralis serosa zu den Pachychoroidalen Erkrankungen gezählt wird[2][6], gelten Faktoren, die die Aderhautdicke erhöhen und die Funktionstüchtigkeit des retinalen Pigmentepithels beeinträchtigen, zu den Ursachen der Erkrankung. Als Risikofaktoren wurden beschrieben[1]:
- Junges Alter (30–50)
- Männliches Geschlecht (6:1)
- Weitsichtigkeit (Hyperopie)
- Stress
- Typ A-Persönlichkeit
- Einnahme von Cortison-Präparaten
- Schlafapnoe-Syndrom
- Helicobacter-pylori-Infektion
Diagnostik
Bei der Augenhintergrundspiegelung kann die flache, zentrale Netzhautabhebung gesehen werden. Zusätzlich werden verschiedene bildgebende Untersuchungen durchgeführt, um die Diagnose zu sichern und den Verlauf einschätzen zu können[1]. Hierzu gehören:
- Optische Kohärenztomographie (OCT): Die Darstellung unter der Netzhaut befindlicher Flüssigkeit ist das typische Zeichen der CRCS. Ebenso kann eine Verdickung der Aderhaut (Choroidea) beobachtet werden. Oft liegt eine Abhebung des retinalen Pigmentepithels vor. In chronischen Fällen lassen sich Schäden am retinalen Pigmentepithel und in bis zu 25 % eine Choroidale Neovaskularisation (CNV) nachweisen. Die OCT stellt eine Standard-Untersuchung bei Erstdiagnose und zur Verlaufsbeurteilung dar.
- Fluoreszenzangiographie: Einer der beiden Farbstoffe Fluorescein und Indocyaningrün, oder oft auch beide zusammen, werden intravenös verabreicht. Das An- und Abfluten beider Farbstoffe wird dann im Auge mittels der Erstellung von Netzhautbildern über einen Zeitraum von 5 bis 30 Minuten beobachtet.
- Mit dem Farbstoff Fluorescein, der intravenös gegeben wird, lässt sich ein Flüssigkeitsaustritt aus der Aderhaut durch die Bruch-Membran und das retinale Pigmentepithel in die Netzhautschichten beobachten. Charakteristischer findet sich in 10 % der Fälle an der Stelle des Lecks ein „Quellpunkt“ von Kontrastmittel, von dem ausgehend sich die unterhalb der Netzhaut gelegene Blase füllt. Viel öfter ist das Leck aber diskret und zeigt nur eine langsame Farbstoffansammlung. In chronischen Fällen wird mittels Fluoreszenzangiographie das Vorliegen einer Choroidale Neovaskularisation (CNV) begutachtet.
- Mit dem Farbstoff Indocyaningrün kann eine Begutachtung der Aderhaut stattfinden. Typischerweise zeigen sich hier gestaute, dicke Aderhautgefäße, eine lokale Unterdurchblutung, und ein später diffuser Farbstoffaustritt aus dem Gefäßsystem, über dem in der Optische Kohärenztomographie Schäden der darüberliegenden Schichten (fast immer retinales Pigmentepithel, auch Netzhaut) nachgewiesen werden können.
- Optische Kohärenztomographie (OCT)-Angiographie: Mittels neuer Gefäßdarstellungs-Module in der OCT kann heutzutage auch ohne intravenöse Verabreichung von Farbstoff das Gefäßsystem der Netz- und Aderhaut beurteilt werden. Die OCT-Angiographie wird häufig als Zusatzuntersuchung zu den oben genannten Bildgebungsmodalitäten durchgeführt, um eine bessere Treffergenauigkeit bezüglich Choroidaler Neovaskularisationen (CNV) zu erreichen und gegebenenfalls eine intravitreale Therapie mittels Spritzen in das Auge einzuleiten.
Therapie
Die Therapie der Chorioretinopathia centralis serosa unterteilt sich aufgrund der spontanen Heilungstendenz in akute und chronische Formen[1].
Akut
Ab Erstdiagnose gerechnet werden Spontanheilungsraten von 68 % innerhalb von vier Monaten, 84 % innerhalb von 6 Monaten berichtet.[1] Fachgesellschaften empfehlen deshalb, eine Therapie in den meisten Fällen erst nach 4 Monaten einzuleiten[1]. Eine frühere Therapieeinleitung ist allerdings nach Rücksprache mit einem Augenarzt aufgrund persönlicher Umstände, z. B. ausgeprägtem Leidensdruck oder dem Wunsch nach zügiger Abheilung möglich. Eine Ausnahme stellt weiterhin das Vorliegen einer choroidalen Neovaskularisation bei Erstdiagnose dar; in diesem Fall kann eine zügige anti-VEGF Therapie sinnvoll sein.
Bei circa 50 % der Patienten kann ein Wiederauftreten der Erkrankung im Verlauf beobachtet werden. In diesen Fällen, sogenannten Rezidiven, kann eine zügige Therapie sinnvoll sein.
Chronisch
Bei chronischer Retinopathia centralis serosa besteht bisher keine Standardtherapie (Übersicht: Cochrane Review[7]). Allerdings konnte für viele therapeutische Ansätze mittels Medikamenten, Laser und intravitrealen anti-VEGF Injektionen (Ranibizumab, Aflibercept, Bevacizumab) eine Wirksamkeit nachgewiesen werden.
- Mineralokortikoidrezeptor-Hemmer: Da eine Überaktivierung des Mineralokortikoidrezeptor in der Aderhaut partiell für die CSCR verantwortlich zu sein scheint, wird in einer Vielzahl von Studien der Mineralokortikoidrezeptor-Antagonist Spironolacton zur Therapie empfohlen[8][9]. Das verwandte, nebenwirkungsärmere Medikament Eplerenon wird ebenso von einigen Augenärzten eingesetzt. Laut einer groß angelegten Studie aus dem Jahr 2020 ist Eplerenon jedoch nicht wirksamer als Placebo[10], weshalb laut Datenlage Patienten mit Spironolacton behandelt werden sollen, wenn eine Mineralokortikoid-Rezeptorhemmung versucht wird. Es ist zu beachten, dass sowohl Spironolacton als auch Eplerenon off-label, d. h. ohne Zulassung verabreicht werden[1].
- Argon-Lasertherapie: Ist in der Fluoreszenzangiographie ein klarer Quellpunkt zu sehen, der sich außerhalb der Sehgrube (Makula) befindet, ist eine Laser-Verödung möglich. Diese seit 1990er Jahren angewandte Methode zeigt eine Beschleunigung der Resorption krankhafter Flüssigkeit, hat jedoch keinen Einfluss auf die Sehschärfe und die Wahrscheinlichkeit zukünftiger Rezidive[1].
- Mikropuls-Laser (Selektive Retinatherapie, Endpoint-Management): Bei diesen Laserverfahren wird versucht, ohne Schädigung der Netzhaut selektiv das retinale Pigmentepithel zu stimulieren, um dort Reparaturvorgänge auszulösen, die zu einer Resorption der krankhaften Flüssigkeit führen. Die Verfahren scheinen hinsichtlich des Sehanstiegs und der Komplikationen vergleichbar zu sein[11]. Weiterhin lassen sie sich bei erneutem Auftreten der Erkrankung wiederholen. Einer groß angelegten Studie aus dem Jahr 2018 scheinen unterschwellige Laserverfahren jedoch der Photodynamischen Therapie unterlegen zu sein[12].
- Half-dose/half-fluence Photodynamische Therapie (PDT): Für die PDT wird dem Betroffenen ein photosensibles Medikament (Verteporfin) intravenös verabreicht. Nach 15 Minuten wird der betroffene Bereich in der Sehgrube (Makula) mittels einem nicht-thermischen Laser der Wellenlänge von 693 nm bestrahlt. Hierdurch kommt es zur Freisetzung freier Radikale innerhalb des Gefäßsystems, die Schäden in der Gefäßwand induzieren. Durch die folgenden körpereigenen Reparaturprozesse kommt es somit zu einer Abdichtung leckender Gefäße. Für die Chorioretinopathia centralis serosa hat sich bewährt, die Dosis des zu verabreichenden Medikaments (Verteporfin) zu halbieren (half-dose PDT), oder bei voller Medikamentendosis die halbe Bestrahlungszeit zu verabreichen (half-fluence PDT), da somit die Komplikationsraten deutlich gesenkt werden können. Nach den Ergebnissen einer groß angelegten Studie aus dem Jahr 2018 gilt die half-dose Photodynamische Therapie für viele Augenärzte als Mittel der Wahl in chronischen Verläufen[12].
- Anti-VEGF Therapie: In etwa 25 % der Fälle bildet sich eine Choroidale Neovaskularisation (CNV) sekundär im Langzeitverlauf. In diesen Fällen kann über die intravitreale Verabreichung der anti-VEGF Hemmer Ranibizumab, Aflibercept und Bevacizumab eine Eindämmung und Abdichtung der CNV erreicht werden, wodurch eine Sehverbesserung bewirkt werden kann[13]. Für diese Indikation ist Ranibizumab zugelassen, während Aflibercept und Bevacizumab ohne Zulassung ("off-label") verabreicht werden können.
Weblinks
- RCS/CCS bei Pro Retina Deutschland e. V. Pro Retina Deutschland ist eine Selbsthilfevereinigung von Menschen mit Netzhautdegenerationen.
- Information der Universitätsaugenklinik Kiel über den SRT-Laser: Selektive Retinatherapie (SRT). (Memento vom 16. Dezember 2013 im Internet Archive) uni-kiel.de
- Sehstörung RCS: Augen im Stress. In: Spiegel online. 10. November 2014.
Einzelnachweise
- Professional Association of German Ophthalmologists (Berufsverband der Augenärzte Deutschlands e. V., BVA), German Society of Ophthalmology (Deutsche Ophthalmologische Gesellschaft e. V., DOG), German Retina Society e. V. (Retinologische Gesellschaft e. V., RG): Statement of the Professional Association of German Ophthalmologists (BVA), the German Society of Ophthalmology (DOG) and the German Retina Society (RG) on central serous chorioretinopathy: Situation January 2018. In: Der Ophthalmologe. Band 116, S1, Februar 2019, ISSN 0941-293X, S. 10–20, doi:10.1007/s00347-018-0809-7 (springer.com [abgerufen am 17. März 2020]).
- Jakob Siedlecki, Benedikt Schworm, Siegfried G. Priglinger: The Pachychoroid Disease Spectrum—and the Need for a Uniform Classification System. In: Ophthalmology Retina. Band 3, Nr. 12, Dezember 2019, S. 1013–1015, doi:10.1016/j.oret.2019.08.002 (elsevier.com [abgerufen am 17. März 2020]).
- Peter Wiedemann: RCS-Therapie mit Kaltlicht-Laser. In: Der Augenspiegel. 2. Februar 2015.
- https://www.pharmazeutische-zeitung.de/2014-08/managerkrankheit-des-auges-sehstoerungen-durch-stress/
- https://www.deutsche-apotheker-zeitung.de/daz-az/2014/daz-44-2014/managerkrankheit-des-auges
- Chui Ming Gemmy Cheung, Won Ki Lee, Hideki Koizumi, Kunal Dansingani, Timothy Y. Y. Lai: Pachychoroid disease. In: Eye. Band 33, Nr. 1, Januar 2019, ISSN 0950-222X, S. 14–33, doi:10.1038/s41433-018-0158-4, PMID 29995841, PMC 6328576 (freier Volltext) – (nature.com [abgerufen am 17. März 2020]).
- M. Salehi, A. S. Wenick, H. A. Law, J. R. Evans, P. Gehlbach: Interventions for central serous chorioretinopathy: a network meta-analysis. In: Cochrane Database Syst Rev. Band 22, Nr. 12, 2015, S. CD011841, doi:10.1002/14651858.CD011841.pub2.
- Elodie Bousquet, Talal Beydoun, Pierre-Raphaël Rothschild, Ciara Bergin, Min Zhao: SPIRONOLACTONE FOR NONRESOLVING CENTRAL SEROUS CHORIORETINOPATHY: A Randomized Controlled Crossover Study. In: Retina. Band 35, Nr. 12, Dezember 2015, ISSN 0275-004X, S. 2505–2515, doi:10.1097/IAE.0000000000000614, PMID 26017871, PMC 4697359 (freier Volltext) – (lww.com [abgerufen am 17. März 2020]).
- T. R. Herold, K. Prause, A. Wolf, W. J. Mayer, M. W. Ulbig: Spironolactone in the treatment of central serous chorioretinopathy – a case series. In: Graefe's Archive for Clinical and Experimental Ophthalmology. Band 252, Nr. 12, Dezember 2014, ISSN 0721-832X, S. 1985–1991, doi:10.1007/s00417-014-2780-6 (springer.com [abgerufen am 17. März 2020]).
- Andrew Lotery, Sobha Sivaprasad, Abby O'Connell, Rosie A Harris, Lucy Culliford: Eplerenone for chronic central serous chorioretinopathy in patients with active, previously untreated disease for more than 4 months (VICI): a randomised, double-blind, placebo-controlled trial. In: The Lancet. Band 395, Nr. 10220, Januar 2020, S. 294–303, doi:10.1016/S0140-6736(19)32981-2 (elsevier.com [abgerufen am 17. März 2020]).
- Edward H. Wood, Peter A. Karth, Steven R. Sanislo, Darius M. Moshfeghi, Daniel V. Palanker: NONDAMAGING RETINAL LASER THERAPY FOR TREATMENT OF CENTRAL SEROUS CHORIORETINOPATHY: What is the Evidence? In: Retina. Band 37, Nr. 6, Juni 2017, ISSN 0275-004X, S. 1021–1033, doi:10.1097/IAE.0000000000001386 (lww.com [abgerufen am 17. März 2020]).
- Elon H.C. van Dijk, Sascha Fauser, Myrte B. Breukink, Rocio Blanco-Garavito, Joannes M.M. Groenewoud: Half-Dose Photodynamic Therapy versus High-Density Subthreshold Micropulse Laser Treatment in Patients with Chronic Central Serous Chorioretinopathy. In: Ophthalmology. Band 125, Nr. 10, Oktober 2018, S. 1547–1555, doi:10.1016/j.ophtha.2018.04.021 (elsevier.com [abgerufen am 17. März 2020]).
- Benedikt Schworm, Nikolaus Luft, Leonie F. Keidel, Felix Hagenau, Christoph Kern: Response of neovascular central serous chorioretinopathy to an extended upload of anti-VEGF agents. In: Graefe's Archive for Clinical and Experimental Ophthalmology. 28. Februar 2020, ISSN 0721-832X, doi:10.1007/s00417-020-04623-w (springer.com [abgerufen am 17. März 2020]).