Rubidiumhydroxid
Rubidiumhydroxid ist eine chemische Verbindung des Rubidiums. Sie gehört zur Stoffgruppe der Hydroxide und ist eine starke Base. Sie liegt in Form eines farblosen Feststoffs vor.
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
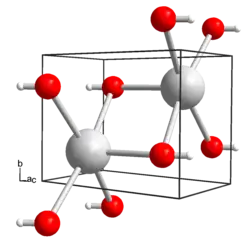 | ||||||||||
| _ Rb+ _ O2− _ D+[1] | ||||||||||
| Allgemeines | ||||||||||
| Name | Rubidiumhydroxid | |||||||||
| Verhältnisformel | RbOH | |||||||||
| Kurzbeschreibung |
farbloser Feststoff[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 102,48 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
3,20 g·cm−3[3] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
gut löslich in Wasser (1730 g·l−1 bei 30 °C[4]) und Ethanol[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Thermodynamische Eigenschaften | ||||||||||
| ΔHf0 | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Gewinnung und Darstellung
Rubidiumhydroxid kann durch langsame Reaktion von elementarem Rubidium mit gasförmigem Wasser im leichten Vakuum gewonnen werden. Eine direkte Reaktion mit Wasser würde dagegen explosionsartig verlaufen.
Reines Rubidiumhydroxid bzw. deren wässrige Lösung kann durch Fällung mit Bariumhydroxid aus einer Rubidiumsulfatlösung gewonnen werden.[3]
Eigenschaften
Rubidiumhydroxid bildet temperaturabhängig vier verschiedene Phasen aus.[6] Bis 265 K ist eine orthorhombische Phase mit der Raumgruppe Cmc21 (Raumgruppen-Nr. 36) und den Gitterparametern a = 4,124 Å, b = 11,18 Å und c = 4,211 Å (bei 193 K) stabil. Zwischen 265 K und 367 K liegt eine monokline Struktur mit der Raumgruppe P21/m (Nr. 11) und den Gitterparametern a = 4,151 Å, b = 4,245 Å, c = 6,030 Å und β = 104,3° (bei 338 K) vor. Zwischen 367 K und 511 K ist die Struktur ebenfalls monoklin mit der Raumgruppe P21/m (Nr. 11), a = 4,158 Å, b = 4,276 Å, c = 6,054 Å und β = 103,7° (bei 423 K). Oberhalb von 511 K ist die Struktur kubisch, Raumgruppe Fm3m (Nr. 225), a = 6,080 Å (bei 550 K). Außerdem sind ein Monohydrat und ein Dihydrat bekannt. Das Monohydrat kristallisiert orthorhombisch, Raumgruppe Cmc21 (Nr. 36), mit den Gitterparametern a = 4,120 Å, b = 11,24 Å und c = 6,080 Å.[7] Das Dihydrat kristallisiert tetragonal, Raumgruppe I41/amd (Nr. 141), a = 7,349 Å, c = 13,87 Å.[8]
Rubidiumhydroxid besitzt ähnliche chemische Eigenschaften wie Natrium- oder Kaliumhydroxid, ist jedoch eine stärkere Base. Es reagiert mit Kohlenstoffdioxid unter Bildung von Rubidiumcarbonat.[3]
Verwendung
Rubidiumhydroxid wird als Katalysator in oxidativen Chlorierungen verwendet. Daneben kann es auch als starke Base genutzt werden. Eine möglich Anwendungen ist die als Elektrolyt für Akkumulatoren, die bei niedrigen Temperaturen eingesetzt werden.[3]
Einzelnachweise
- Die Strukturbestimmung wurde an der deuterierten Verbindung durchgeführt, um genauere Wasserstoffpositionen ermitteln zu können.
- Datenblatt Rubidium hydroxide, 50% w/w aq. soln., 99.6+% (metals basis) bei AlfaAesar, abgerufen am 6. Dezember 2019 (PDF) (JavaScript erforderlich).
- Pradyot Patnaik: Handbook of Inorganic Chemicals. McGraw-Hill, 2003, ISBN 0-07-049439-8, S. 800.
- Lide: 1998 Freshman Achievement Award. CRC Press, 1998, ISBN 978-0-8493-0594-8, S. 85 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1174.
- H. Jacobs, B. Mach, H.-D. Lutz, J. Henning: Bindungsverhältnisse in den kristallinen Phasen von Rubidiumhydroxid und -deuterohydroxid, RbOH und RbOD. In: Zeitschrift für anorganische und allgemeine Chemie, 544, 1987, S. 28–54, doi:10.1002/zaac.19875440104.
- H. Jacobs, T. Tacke, J. Kockelkorn: Hydroxidmonohydrate des Kaliums und Rubidiums; Verbindungen, deren Atomanordnungen die Schreibweise K(H2O)OH bzw. Rb(H2O)OH nahelegen. In: Zeitschrift für anorganische und allgemeine Chemie, 516, 1984, S. 67–78, doi:10.1002/zaac.19845160910.
- H. Jacobs, A. Schardey: Ein ungewöhnliches H-Brückenbindungssystem in Rubidium-hydroxiddihydrat, RbOH·2 H2O. In: Zeitschrift für anorganische und allgemeine Chemie, 565, 1988, S. 34–40, doi:10.1002/zaac.19885650104.
