Antiretrovirale Therapie
Die antiretrovirale Therapie (ART) (auch hochaktive antiretrovirale Therapie, kurz HAART (englisch highly active antiretroviral therapy) oder auch antiretrovirale Kombinationstherapie, kurz cART (englisch combined antiretroviral therapy)) ist die medikamentöse Behandlung bei Menschen mit einer HIV-Infektion. Sie verringert die Viruslast, erhält die Funktion des Immunsystems aufrecht und verhindert opportunistische Infektionen, die häufig zum Tod führen. Außerdem verhindert sie auch die Übertragung von HIV zwischen serodiskordanten Personen, solange die HIV-positive Person eine nicht nachweisbare Viruslast aufrechterhält. Im Regelfall verhindert eine antiretrovirale Therapie auch die Übertragung einer HIV-Infektion von einer schwangeren Frau auf das ungeborene Kind.
Ziel
Ziel der antiretroviralen Therapie ist es, durch die Hemmung der HIV-Replikation infektionsbedingte Symptome zu unterdrücken, die Krankheitsprogression zu vermindern, eine Rekonstitution der zellulären Immunität zu erreichen und die chronische Immunaktivierung mit ihren resultierenden Entzündungsprozessen zu reduzieren.[1][2][3][4][5][6] Nach aktuellem Forschungsstand muss eine antiretrovirale Therapie lebenslang und möglichst unterbrechungsfrei eingenommen werden.[7]
Indikation
Die unter Federführung der DAIG gemeinsam mit der ÖAG und weiterer medizinischer Fachgesellschaften erarbeitete Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion sieht den schnellstmöglichen – binnen weniger Tage und Wochen nach einem positiven HIV-Test – Therapiebeginn, unabhängig von Immunstatus und Plasmaviruslast, vor. Der Therapiebeginn soll nur in Ausnahmefällen verzögert werden. Die Ausnahmen bilden einerseits die akut behandlungsbedürftige opportunistische Infektionen Zerebrale Kryptokokkose und bestimmte Tuberkulose-Konstellationen. Andererseits können asymptomatische HIV-Infizierte Patienten ohne beeinträchtigten Immunstatus und sogenannte Elite Controller, also Personen deren HIV-Infektion asymptomatisch, chronisch, niedrig-virämisch ohne Entwicklung eines Immundefekts abläuft, eine antiretroviralen Therapie verzögert beginnen.[8]
Bis September 2020 empfahl die Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-Infektion der AWMF[9] ein abgestuftes Verfahren unter Abwägung des Einzelnutzens und der Risiken und Nebenwirkungen einer antiretroviralen Therapie vor. Die entsprechenden Risiken und Nebenwirkungen müssen aus heutiger perspektive jedoch als so gering betrachtet werden, dass ein späterer Therapiebeginn regelhaft einen fortschreitenden Immundefekt verursacht und damit mit erhöhten Risiken für Infektionserkrankungen, Tumorerkrankungen, vorzeitige degenerative Erkrankungen und Organschäden sowie mit einer erhöhten Mortalität einhergeht.
Therapie
Wirkmechanismen
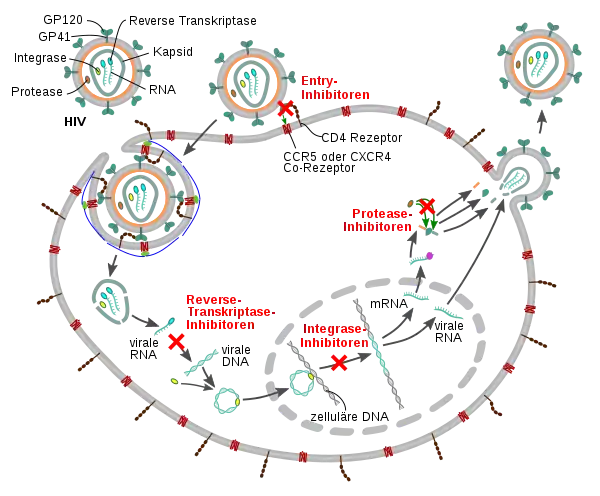
Für eine Antiretrovirale Therapie stehen verschiedene Wirkstoffklassen zur Verfügung welche an unterschiedlichen Punkten der Pathogenese eingreifen.
Nukleosidische Reverse-Transkriptase-Inhibitoren
Nukleosidische Reverse-Transkriptase-Inhibitoren sind Nukleosidanaloga, die den natürlichen Nukleosiden ähneln. Ihr Ansatzpunkt ist das Enzym Reverse Transkriptase von Retroviren, die das virale RNA-Genom in DNA umschreibt. Sie konkurrieren mit natürlichen Nukleosiden, unterscheiden sich allerdings durch geringe Modifikationen an der Ribose (Zuckermolekül), d. h., sie besitzen keine 3'-Hydroxygruppe, an der die Kettenverlängerung stattfindet.
Nichtnukleosidische Reverse-Transkriptase-Inhibitoren
Nichtnukleosidische Reverse-Transkriptase-Inhibitoren sind Arzneistoffe , die das virale Enzym Reverse Transkriptase inhibieren und damit die Vermehrung von Retroviren hemmen.
Protease-Inhibitoren
Protease-Inhibitoren besetzen die Bindungsstelle des Substrats an der HIV-Protease und verhindern, dass diese ihre Wirkung entfalten kann. Es können nicht mehr die richtigen Virusbausteine produziert werden, der Virus-Replikationszyklus ist unterbrochen.
Entry-Inhibitoren
Entry-Inhibitoren unterbinden den Eintritt bestimmter Viren in die Wirtszelle.
Attachment-Inhibitoren verhindern Andocken des HIV-Glykoproteins gp120 an den CD4-Rezeptor ist der erste Schritt beim Eintritt in die Zelle.
Korezeptor-Antagonisten verhindern die Interaktion zwischen den Oberflächenrezeptoren der Zelle und dem viralen Hüllprotein, indem sie die Rezeptorenstellen blockieren oder verändern.
Fusions-Inhibitoren hindern HIV daran, in eine CD4-Zelle einzudringen, indem sie eine Verschmelzung der äußeren Membran des Virus mit der Zellmembran blockieren.
Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-Infektion
Seit September 2020 sieht die AWMF-Leitlinie Integrase-Inhibitor-, Nichtnukleosidische Reverse-Transkriptase-Inhibitor- und Protease-Inhibitor-basierte Ein- und Mehrtablettenregime zur Behandlung vor:[8]
Eintablettenregime
| Wirkstoffe | Handelsname | |
|---|---|---|
| Integrase-Inhibitor-Basiert | Bictegravir/Tenofovir-Alafenamid/Emtricitabin | Biktarvy |
| Dolutegravir/Abacavir/Lamivudin | Triumeq | |
| Dolutegravir/Lamivudin | Dovato | |
| Elvitegravir/Cobicistat/Tenofovir-Alafenamid/Emtricitabin | Genvoya | |
| Nichtnukleosidische Reverse-Transkriptase-Inhibitoren-Basiert | Doravirin/Tenofovir-Disoproxilfumarat/Lamivudin | Delstrigo |
| Rilpivirin/Tenofovir-Alafenamid/Emtricitabin | Odefsey | |
| Rilpivirin/Tenofovir-Disoproxilfumarat/Emtricitabin | Eviplera | |
| Protease-Inhibitor-Basiert | Darunavir/Cobicistat/Tenofovir-Alafenamid/Emtricitabin | Symtuza |
Mehrtablettenregime
| Wirkstoffe | Handelsnamen | |
|---|---|---|
| Integrase-Inhibitor-Basiert | Dolutegravir + Tenofovir-Alafenamid/Emtricitabin | Tivicay + Descovy |
| Dolutegravir + Tenofovir-Disoproxilfumarat/Emtricitabin | Tivicay + Truvada | |
| Raltegravir + Abacavir/Lamivudin | Isentress + Kivexa | |
| Raltegravir + Tenofovir-Alafenamid/Emtricitabin | Isentress + Descovy | |
| Raltegravir + Tenofovir-Disoproxilfumarat/Emtricitabin | Isentress + Truvada | |
| Nichtnukleosidische Reverse-Transkriptase-Inhibitor-Basiert | Doravirin + Tenofovir-Disoproxilfumarat/Emtricitabin | Pifeltro + Truvada |
| Doravirin + Tenofovir-Alafenamid/Emtricitabin | Pifeltro + Descovy | |
| Doravirin + Abacavir/Lamivudin | Pifeltro + Kivexa | |
| Protease-Inhibitor-Basiert | Darunavir/Ritonavir + Abacavir/Lamivudin | Prezista + Kivexa |
| Darunavir/Ritonavir + Tenofovir-Alafenamid/Emtricitabin | Prezista + Descovy |
Nebenwirkungen
Die aktuelle Generation von Medikamenten für eine antiretrovirale Therapie haben ein schwaches Nebenwirkungsprofil. Die gängigsten Nebenwirkungen gehören Kopfschmerzen, Durchfall und Übelkeit (jeweils ≥ 1/100 bis < 1/10 behandelte Personen). Regelmäßig klingen diese leichten Nebenwirkungen nach einigen Wochen ab. Sofern es zu einer dauerhaften oder stärkeren Nebenwirkungsreaktion kommt, sollte eine andere Wirkstoffkombination gewählt werden.[10]
Schutz durch Behandlung
Neben dem Wohlergehen des Patienten durch Reduktion von Krankheitssymptomen hat die Antiretrovirale Therapie einen weiteren wesentlichen Vorteil. Sie wirkt präventiv bei der Verbreitung von HIV. Dieser „Schutz durch Behandlung“ (englisch treatment as prevention, kurz TasP) gilt in vielen Gesundheitssystemen als wichtiger Beitrag die Wahrscheinlichkeit der HIV-Weiterverbreitung sowie Krankheit oder Tod durch HIV zu senken.
Durch Beobachtungsstudien an serodiskordanten heterosexuellen Paaren ergaben sich in den 2000ern Hinweise auf einen starken Zusammenhang zwischen der HI-Viruslast einer HIV-positiven Person und dem Risiko der sexuellen Übertragung auf eine HIV-negative Person.[11][12][13][14][15] Dies führte zu mehreren größer angelegten Studien ob eine antiretrovirale Therapie Übertragungsereignisse zwischen Personen verringert, welche die Kernaussage bestätigte: Trotz einer bestehenden HIV-Infektion besteht bei Therapieerfolg, der vollständigen Unterdrückung der HIV-Replikation, ein vernachlässigbares Risiko einer Übertragung von einer Person an eine andere Person.[16][17][18][19]
Aus den Ergebnissen der Studien wurde unter dem Dach der Prevention Access Campaign[20] der Slogan „Undetectable = Untransmittable“ (deutsch in etwa „nicht Nachweisbar bedeutet nicht Ansteckend“) abgeleitet. Die Aussage wird von der Bundeszentrale für gesundheitliche Aufklärung[21], dem Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz[22], den Centers for Disease Control and Prevention[23] und UNAIDS[24] geteilt. Die Deutsche AIDS-Hilfe weist darauf hin, dass die Bedeutung einer antiretroviralen Therapie in der Gesamtbevölkerung noch zu unbekannt ist.[25]
Siehe auch
- HIV-Impfstoff
- APOBEC3 (Elemente des Immunsystems zur Abwehr von Retrovirus-Infektionen)
- Sexualhygiene
- Stiftung Humanitäre Hilfe für durch Blutprodukte HIV-infizierte Personen
- Kompetenznetz HIV/AIDS
- Breakthrough of the Year, 1996 und 2005
Literatur
- S2k-Leitlinie HIV-Infektion, antiretrovirale Therapie der Deutschen AIDS-Gesellschaft e.V. (DAIG). In: AWMF online (Stand 2014)
- S2k-Leitlinie HIV-Therapie in der Schwangerschaft und bei HIV-exponierten Neugeborenen der Deutschen AIDS-Gesellschaft e.V. (DAIG). In: AWMF online (Stand 2020)
- WHO (Hrsg.): Guidelines for managing advanced HIV disease and rapid initiation of antiretroviral therapy. World Health Organization, Genf 2017, ISBN 978-92-4155006-2 (englisch, who.int).
Weblinks
- EACS Guidelines. In: eacsociety.org. European AIDS Clinical Society / EACS, abgerufen am 8. Dezember 2020 (englisch).
- Persons with HIV: Prevention and Care. In: cdc.gov. Centers for Disease Control and Prevention (CDC), abgerufen am 8. Dezember 2020 (englisch, Leitlinienliste).
Einzelnachweise
- J. W. Mellors, A. Muñoz, J. V. Giorgi, J. B. Margolick, C. J. Tassoni, P. Gupta, L. A. Kingsley, J. A. Todd, A. J. Saah, R. Detels, J. P. Phair, C. R. Rinaldo Jr.: Plasma Viral Load and CD4+ Lymphocytes as Prognostic Markers of HIV-1 Infection. In: Annals of Internal Medicine. Band 126, Nr. 12, 12. Juni 1997, S. 946–954, doi:10.7326/0003-4819-126-12-199706150-00003, PMC 9182471 (freier Volltext) – (englisch, psu.edu [PDF]).
- D. William Cameron, Margo Heath-Chiozzi, Sven Danner, Calvin Cohen, Stephen Kravcik, Clement Maurath, Eugene Sun, David Henry, Richard Rode, Amy Potthoff, John Leonard for the Advanced HIV Disease Ritonavir Study Group: Randomised placebo-controlled trial of ritonavir in advanced HIV-1 disease. In: The Lancet. Band 351, Nr. 9102, 21. Februar 1998, S. 543–549, doi:10.1016/S0140-6736(97)04161-5, PMID 9492772 (englisch).
- M. Hammer, Kathleen E. Squires, Michael D. Hughes, Janet M. Grimes, Lisa M. Demeter, Judith S. Currier, Joseph J. Eron, Jr., Judith E. Feinberg, Henry H. Balfour, Jr., Lawrence R. Deyton, Jeffrey A. Chodakewitz, Margaret A. Fischl, et al. for the AIDS Clinical Trials Group 320 Study Team: A controlled trial of two nucleoside analogues plus indinavir in persons with human immunodeficiency virus infection and CD4 cell counts of 200 per cubic millimeter or less. AIDS Clinical Trials Group 320 Study Team. In: The New England Journal of Medicine. Band 337, Nr. 11, 11. September 1997, S. 725–733, doi:10.1056/NEJM199709113371101, PMID 9287227 (englisch).
- Frank J. Palella, Jr., Kathleen M. Delaney, Anne C. Moorman, Mark O. Loveless, Jack Fuhrer, Glen A. Satten, Diane J. Aschman, Scott D. Holmberg and the HIV Outpatient Study Investigators: Declining Morbidity and Mortality among Patients with Advanced Human Immunodeficiency Virus Infection. In: The New England Journal of Medicine. Band 338, Nr. 13, 26. März 1998, S. 853–860, doi:10.1056/NEJM199803263381301, PMC 9516219 (freier Volltext) – (englisch).
- Pablo Tebas, William Keith Henry, Roy Matining, Deborah Weng-Cherng, John Schmitz, Hernan Valdez, Nasreen Jahed, Laurie Myers, William G. Powderly, David Katzenstein: Metabolic and Immune Activation Effects of Treatment Interruption in Chronic HIV-1 Infection: Implications for Cardiovascular Risk. In: PLOS ONE. Band 3, Nr. 4, 2021, doi:10.1371/journal.pone.0002021, PMID 18431498, PMC 2292263 (freier Volltext).
- Francesca J. Torriani, Lauren Komarow, Robert A. Parker, Bruno R. Cotter, Judith S. Currier, Michael P. Dubé, Carl J. Fichtenbaum, Mariana Gerschenson, Carol K. C. Mitchell, Robert L. Murphy, Kathleen Squires, James H. Stein for the ACTG 5152s Study Team: Endothelial Function in Human Immunodeficiency Virus-Infected Antiretroviral-Naive Subjects Before and After Starting Potent Antiretroviral Therapy. In: Journal of the American College of Cardiology. Band 52, Nr. 7, 12. August 2008, S. 569–676, doi:10.1016/j.jacc.2008.04.049, PMID 18687253, PMC 2603599 (freier Volltext) – (englisch, sciencedirect.com [PDF]).
- Melanie Stecher, Annika Claßen, Florian Klein, Clara Lehmann, Henning Gruell, Martin Platten, Christoph Wyen, Georg Behrens, Gerd Fätkenheuer, Jörg Janne Vehreschild: Systematic Review and Meta-analysis of Treatment Interruptions in Human Immunodeficiency Virus (HIV) Type 1–infected Patients Receiving Antiretroviral Therapy: Implications for Future HIV Cure Trials. In: Clinical Infectious Diseases. Band 70, Nr. 7, 1. April 2020, S. 1406–1417, doi:10.1093/cid/ciz417, PMID 31102444 (englisch).
- Deutsche AIDS-Gesellschaft – DAIG (Hrsg.): Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion. 31. August 2020 (daignet.de [PDF; 725 kB; abgerufen am 4. Dezember 2020]).
- S2k-Leitlinie HIV-Infektion, antiretrovirale Therapie der Deutschen AIDS-Gesellschaft e.V. (DAIG). In: AWMF online (Stand 2014)
- Deutsche AIDS-Hilfe: Nebenwirkungen. In: aidshilfe.de. 17. Februar 2010, abgerufen am 8. Dezember 2020.
- Thomas C. Quinn, Maria J. Wawer, Nelson Sewankambo, David Serwadda, Chuanjun Li: Viral Load and Heterosexual Transmission of Human Immunodeficiency Virus Type 1. In: New England Journal of Medicine. Band 342, Nr. 13, 30. März 2000, ISSN 0028-4793, S. 921–929, doi:10.1056/NEJM200003303421303, PMID 10738050.
- Jesús Castilla, Jorge del Romero, Victoria Hernando, Beatriz Marincovich, Soledad García, Carmen Rodríguez: Effectiveness of Highly Active Antiretroviral Therapy in Reducing Heterosexual Transmission of HIV:. In: JAIDS Journal of Acquired Immune Deficiency Syndromes. Band 40, Nr. 1, September 2005, ISSN 1525-4135, S. 96–101, doi:10.1097/01.qai.0000157389.78374.45 (lww.com [abgerufen am 8. Dezember 2020]).
- Marineide Gonçalves Melo, Breno Riegel Santos, Rita De Cassia Lira, Ivana S. Varella, Maria Lourdes Turella: Sexual Transmission of HIV-1 Among Serodiscordant Couples in Porto Alegre, Southern Brazil. In: Sexually Transmitted Diseases. Band 35, Nr. 11, November 2008, ISSN 0148-5717, S. 912–915, doi:10.1097/OLQ.0b013e31817e2491 (lww.com [abgerufen am 8. Dezember 2020]).
- Suzanna Attia, Matthias Egger, Monika Müller, Marcel Zwahlen, Nicola Low: Sexual transmission of HIV according to viral load and antiretroviral therapy: systematic review and meta-analysis. In: AIDS. Band 23, Nr. 11, 17. Juli 2009, ISSN 0269-9370, S. 1397–1404, doi:10.1097/QAD.0b013e32832b7dca (lww.com [abgerufen am 8. Dezember 2020]).
- Deborah Donnell, Jared M Baeten, James Kiarie, Katherine K Thomas, Wendy Stevens: Heterosexual HIV-1 transmission after initiation of antiretroviral therapy: a prospective cohort analysis. In: The Lancet. Band 375, Nr. 9731, Juni 2010, S. 2092–2098, doi:10.1016/S0140-6736(10)60705-2, PMID 20537376, PMC 2922041 (freier Volltext) – (elsevier.com [abgerufen am 8. Dezember 2020]).
- Reuben Granich, Somya Gupta, Amitabh B Sutha, Caoimhe Smyth, David Hoos: Antiretroviral Therapy in Prevention of HIV and TB: Update on Current Research Efforts. In: Current HIV Research. Band 9, Nr. 6, September 2011, ISSN 1570-162X, S. 446–469, doi:10.2174/157016211798038597, PMID 21999779, PMC 3531820 (freier Volltext) – (eurekaselect.com [abgerufen am 8. Dezember 2020]).
- Myron S. Cohen, Ying Q. Chen, Marybeth McCauley, Theresa Gamble, Mina C. Hosseinipour: Prevention of HIV-1 Infection with Early Antiretroviral Therapy. In: New England Journal of Medicine. Band 365, Nr. 6, 11. August 2011, ISSN 0028-4793, S. 493–505, doi:10.1056/nejmoa1600693, PMID 21767103, PMC 3200068 (freier Volltext) – (nejm.org [abgerufen am 8. Dezember 2020]).
- Marie-Claude Boily, Benoît Mâsse, Ramzi Alsallaq, Nancy S. Padian, Jeffrey W. Eaton: HIV Treatment as Prevention: Considerations in the Design, Conduct, and Analysis of Cluster Randomized Controlled Trials of Combination HIV Prevention. In: PLOS Medicine. Band 9, Nr. 7, 7. Oktober 2012, ISSN 1549-1676, 1001250, doi:10.1371/journal.pmed.1001250, PMID 22807657, PMC 3393676 (freier Volltext) – (plos.org [abgerufen am 8. Dezember 2020]).
- Alison J Rodger, Valentina Cambiano, Tina Bruun, Pietro Vernazza, Simon Collins: Risk of HIV transmission through condomless sex in serodifferent gay couples with the HIV-positive partner taking suppressive antiretroviral therapy (PARTNER): final results of a multicentre, prospective, observational study. In: The Lancet. Band 393, Nr. 10189, Juni 2019, S. 2428–2438, doi:10.1016/S0140-6736(19)30418-0, PMID 31056293, PMC 6584382 (freier Volltext) – (elsevier.com [abgerufen am 8. Dezember 2020]).
- Prevention Access Campaign: Hauptseite. Abgerufen am 8. Dezember 2020 (englisch).
- Bundeszentrale für gesundheitliche Aufklärung: HIV-Therapie. In: liebesleben.de. Abgerufen am 8. Dezember 2020.
- Bundesministerium für Soziales, Gesundheit, Pflege und Konsumentenschutz: HIV/AIDS: Kinderwunsch - HIV-positive Partnerin/HIV-negativer Partner. In: gesundheit.gv.at. 28. Juni 2018, abgerufen am 8. Dezember 2020.
- Centers for Disease Control and Prevention: HIV Treatment as Prevention. In: cdc.gov. 6. April 2020, abgerufen am 8. Dezember 2020 (amerikanisches Englisch).
- UNAIDS: Public health and HIV viral load suppression. 19. Juli 2017, abgerufen am 8. Dezember 2020 (englisch).
- Marcel Hackbart, Barbara Thies: HIV-Stigma: Was kann die Aufklärung über Schutz durch Therapie bewirken? In: magazin.hiv. 17. August 2020, abgerufen am 8. Dezember 2020 (deutsch).