Autophagozytose
Autophagozytose oder Autophagie (von altgriechisch αὐτόφαγος autóphagos „sich selbst verzehrend“[1] und κύτος kýtos „Höhlung, Raum“[2]) bezeichnet den Prozess in Zellen, mit dem sie eigene Bestandteile abbauen und verwerten. Dies reicht von fehlgefalteten Proteinen bis zu ganzen Zellorganellen. Ein verwandter Prozess ist die Phagozytose (eine Form der Endozytose), bei der Stoffe von außerhalb der Zelle aufgenommen und verwertet werden.
| Übergeordnet |
| Zelluläre Hungerantwort Zelluläre Immunantwort Apoptose |
| Untergeordnet |
| Auf/Abbau des Autophagosoms Makroautophagozytose Mikroautophagozytose Chaperone mediated autophagy Mitophagie |
| Gene Ontology |
|---|
| QuickGO |
Dem japanischen Wissenschaftler Yoshinori Ōsumi wurde für seine Entdeckungen auf dem Gebiet 2016 der Nobelpreis für Physiologie oder Medizin verliehen.[3]
Eigenschaften
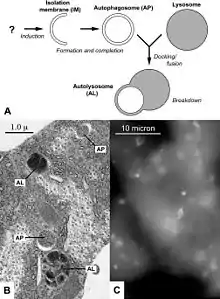
Autophagozytose tritt bei vielen Eukaryoten, wie Pflanzen, vielzelligen Tieren, Schleimpilzen und Hefen auf. Der Prozess ist für ein Gleichgewicht zwischen der Produktion neuer und dem Abbau alter Zellbestandteile notwendig. Ein Mitochondrium einer Leberzelle hat beispielsweise eine Lebenszeit von zehn Tagen, bevor es durch Autophagozytose (Mitophagie, teilweise über Omegasomen)[5] abgebaut wird, und seine Bestandteile erneut zum Aufbau anderer Strukturen weiterverwendet werden (Salvage-Pathway). Somit ist die Autophagie eine im Laufe der Evolution entwickelte Strategie der Zellen, um Energie zu sparen.
Die Autophagozytose ist am Ab- und Umbau von Proteinen und Lipiden und an der Bereitstellung von Aminosäuren bei verringerter oder bei (teilweiser) Enthaltung von Nahrungszufuhr beteiligt[6], wie es beim Fasten der Fall ist. Durch Fasten wird Autophagie hervorgerufen.[7] Sie erfolgt in geringem Umfang in allen Zellen, wird aber bei metabolischem, genotoxischem, infektiösem und hypoxischem Stress verstärkt.[8]
Mit zunehmendem Alter einer Zelle nimmt die Autophagozytose ab.[9] Eine verminderte Autophagozytose ist unter anderem an der Metastasierung von Tumoren beteiligt.[10] Weiterhin ist eine verminderte Autophagie an der Entstehung von ALS,[11] Morbus Alzheimer, Chorea Huntington, SENDA (static encephalopathy of childhood with neurodegeneration in adulthood = Statische Enzephalopathie der Kindheit mit Neurodegeneration im Erwachsenenalter),[12] multipler Sklerose, Morbus Crohn und systemischem Lupus erythematodes (SLE) beteiligt.[13] Sorafenib und das natürlich vorkommende Spermidin führen zu einer verstärkten Autophagie.[14] Hydroxychloroquin und andere Chloroquinderivate hemmen die Autophagie.[15] Die Autophagie wird unter anderem durch das Protein Autophagin 4A reguliert.
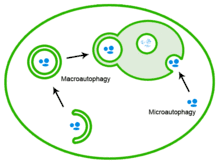
Die Prozesse der Autophagozytose werden grob in drei Gruppen unterteilt: die Makroautophagozytose oder Makroautophagie, die Mikroautophagozytose oder Mikroautophagie sowie die Chaperon-vermittelte Autophagie (Chaperone mediated autophagy, CMA).[16][17][18]
Makroautophagie
Die Makroautophagie ist der hauptsächliche Mechanismus der Autophagie und dient zum Abbau von Zellorganellen und Proteinen.[19] Dabei umschließt ein Teil der Membran des Endoplasmatischen Retikulums (ER) die für den Abbau markierten Strukturen, bis das abzubauende Organell ganz von einer doppelten Biomembran umschlossen ist.[18][20] Das entstandene Autophagosom wird anschließend entlang des Aktin-Zytoskeletts transportiert,[21] bis es sich schließlich unter Membranfusion an ein Lysosom bindet[18] und sein Inhalt durch lysosomale saure Hydrolasen abgebaut wird.[22]
Mikroautophagie
Die Mikroautophagie bezeichnet die direkte Aufnahme ins Lysosom durch die lysosomale Membran.[23] Dabei wird die lysosomale Membran eingestülpt.[20]
Chaperon-vermittelte Autophagie
Bei der Chaperon-vermittelten Autophagie (Chaperone mediated autophagy, CMA) werden Proteine mit einem KFERQ-ähnlichen Motiv vom Chaperon bzw. Hitzeschockprotein Hsc70 erkannt und als Proteinkomplex zum Lysosom geführt, wo sie durch das lysosomal membrane-associated protein 2a (LAMP-2A) ins Lysosom gelangen und abgebaut werden.[20][24] Der Komplex wird rezeptorvermittelt in das Lysosom aufgenommen, wobei das Hsc70 als Chaperon zur Entfaltung der importierten Proteine dient.[17][18] Eine veränderte Chaperon-vermittelte Autophagie ist an der Entstehung von Morbus Parkinson beteiligt.[25]
Rolle im Immunsystem
Autophagozytose ermöglicht auch den intrazellulären Abbau von Viren, Bakterien und Fremdproteinen, die in die Zelle eingedrungen sind. Sie dient mit der Zerlegung auch der Immunantwort, denn anschließend erfolgt die Antigenpräsentation über MHC I und II.[26] Verschiedene intrazelluläre bakterielle Pathogene haben Resistenzmechanismen gegen einen Abbau durch Autophagozytose entwickelt.[27]
Mitwirkung im Lebensphasenwechsel einiger Arten
Bei Insekten dient der Prozess zur Umwandlung des Larvengewebes in die Adultform. Hierbei wird während der Verpuppung das Gewebe eingeschmolzen und zum adulten Tier neu angeordnet.
Es gibt zwei Signale, die diesen Prozess auslösen: Ein Mangel an Nährstoffen führt zum Abbau von nicht essentiellen Zellbestandteilen. Damit werden überlebenswichtige Prozesse weiterhin mit Energie versorgt. Auch ein Überangebot von Nährstoffen kann Autophagozytose auslösen. Dann werden mit dem Energieüberschuss neue Organellen gebildet und alte wiederverwendet.
Autophagozytose kann auch das Absterben von Zellen verursachen. Es ist Teil des programmierten Zelltodes (Apoptose, autophagic cell death). Es reguliert somit das Wachstum von vielzelligen Organismen und Kolonien (Hefe).
Inhibierung
Autophagozytose lässt sich durch bestimmte Wirkstoffe, wie beispielsweise Chloroquin oder Hydroxychloroquin, inhibieren. Dies eröffnet verschiedene therapeutische Anwendungen, beispielsweise in der Chemotherapie von Krebserkrankungen.[28][29]
Verstärkung
Die natürliche Substanz Spermidin wirkt verstärkend auf die Autophagozytose.[30][31] Daher wird aktuell in zahlreichen Studien das präventive Potential von Spermidin bezogen auf eine Verlängerung der gesunden Lebensspanne untersucht. In einer kleinen Untersuchung an der Charité konnte bereits nach drei Monaten eine Verbesserung der Gedächtnisleistung bei älteren Menschen mit erhöhten kognitiven Verfall im Vergleich zum Placebo gezeigt werden.[32]
Geschichte
Die Autophagozytose wurde erstmals 1962 von Keith R. Porter und seinem Studenten Thomas Ashford beschrieben.[33] Der Abbau und die Wiederverwendung zellulärer Bestandteile im Lysosom wurde 1963 beschrieben.[34] Die Bezeichnung Autophagie wurde 1963 auf dem Ciba Foundation Symposium on Lysosomes (vom 12. bis 14. Februar) von Christian de Duve geprägt.[35][36] Im Jahr 1967 beschrieb de Duve die Glukagon-induzierte Autophagozytose in Lysosomen von Leberzellen der Ratte.[37][38]
In den 1990er Jahren wurden in Hefen verschiedene Gene beschrieben, deren Proteine an der Autophagozytose beteiligt sind. Die Arbeitsgruppen von Yoshinori Ōsumi und von Michael Thumm untersuchten Hunger-induzierte nichtselektive Autophagie[39][40][41] Daniel J. Klionsky entdeckte den Cytoplasm-to-Vacuole Targeting-Signalweg (CVT) pathway.[42][43] Dabei handelte es sich um den gleichen Mechanismus.[44][45] Im Jahr 1999 wurde der Zusammenhang der Autophagie mit Krebs von der Gruppe um Beth Levine beschrieben.[46] Ursprünglich wurden die an der Autophagie beteiligten Gene mit unterschiedlichen Namen benannt (APG, AUT, CVT, GSA, PAG, PAZ und PDD). Im Jahr 2003 wurde eine vereinheitlichte Nomenklatur erlassen, bei der die Autophagie-Gene mit ATG benannt werden.[47] Der Nobelpreis für Medizin oder Physiologie aus dem Jahr 2016 wurde Yoshinori Ōsumi für seine Entdeckungen um die Autophagie verliehen. Während die Bedeutung von Ōsumis Erkenntnissen weithin anerkannt ist, wurde bezüglich der Verleihung eine zu geringe Einbeziehung anderer beteiligter Wissenschaftler kritisiert.[48]
Siehe auch
- Autolyse – Selbstverdauung
Literatur
- Vojo Deretic und Daniel J. Klionsky: Reinemachen in der Zelle. In: Spektrum der Wissenschaft, Dezember 2008, S. 58.
- Christiane Richter-Landsberg: Autophagie als Überlebensstrategie in: Biologie in unserer Zeit, 6/2012, S. 374.
- Irina Caminschi, Christian Münz: Autophagy for Better or Worse During Infectious Diseases. In: Frontiers in Immunology. 4, 2013, S. , doi:10.3389/fimmu.2013.00205.
- J. H. Hurley, E. Nogales: Next-generation electron microscopy in autophagy research. In: Current opinion in structural biology. [elektronische Veröffentlichung vor dem Druck] September 2016, doi:10.1016/j.sbi.2016.08.006, PMID 27614295.
- P. Lapaquette, J. Guzzo, L. Bretillon, M. A. Bringer: Cellular and Molecular Connections between Autophagy and Inflammation. In: Mediators of inflammation. Band 2015, 2015, S. 398483, doi:10.1155/2015/398483, PMID 26221063, PMC 4499609 (freier Volltext).
Weblinks
Einzelnachweise
- Wilhelm Pape, Max Sengebusch (Bearb.): Handwörterbuch der griechischen Sprache. 3. Auflage, 6. Abdruck, Vieweg & Sohn, Braunschweig 1914. 1914, abgerufen am 4. Oktober 2016 (Verweis auf das Wort αὐτόφορβος mit derselben Bedeutung).
- Wilhelm Pape, Max Sengebusch (Bearb.): Handwörterbuch der griechischen Sprache. 3. Auflage, 6. Abdruck, Vieweg & Sohn, Braunschweig 1914. 1914, abgerufen am 4. Oktober 2016 (speziell im Körper, z. B. Bauchhöhle).
- Pressemeldung bei nobelprize.org, 3. Oktober 2016.
- G. Juhasz, T. P. Neufeld: Autophagy: a forty-year search for a missing membrane source. In: PLoS biology. Band 4, Nummer 2, Februar 2006, S. e36, doi:10.1371/journal.pbio.0040036, PMID 16464128, PMC 1363699 (freier Volltext).
- Y. C. Wong, E. L. Holzbaur: Optineurin is an autophagy receptor for damaged mitochondria in parkin-mediated mitophagy that is disrupted by an ALS-linked mutation. In: Proceedings of the National Academy of Sciences. Band 111, Nummer 42, Oktober 2014, ISSN 1091-6490, S. E4439–E4448, doi:10.1073/pnas.1405752111. PMID 25294927, PMC 4210283 (freier Volltext).
- O. Shatz, P. Holland u. a.: Complex Relations Between Phospholipids, Autophagy, and Neutral Lipids. In: Trends in biochemical sciences. Band 41, Nummer 11, 11 2016, S. 907–923, doi:10.1016/j.tibs.2016.08.001, PMID 27595473 (Review).
- Françoise Wilhelmi de Toledo, Andreas Michalsen, Stefan Drinda, Audrey Bergouignan, Franziska Grundler: Safety, health improvement and well-being during a 4 to 21-day fasting period in an observational study including 1422 subjects. In: PLOS ONE. Band 14, Nr. 1, 2. Januar 2019, ISSN 1932-6203, S. e0209353, doi:10.1371/journal.pone.0209353, PMID 30601864, PMC 6314618 (freier Volltext) – (plos.org [abgerufen am 30. Januar 2019]).
- N. Dupont, P. Codogno: Autophagy transduces physical constraints into biological responses. In: The international journal of biochemistry & cell biology. [elektronische Veröffentlichung vor dem Druck] August 2016, doi:10.1016/j.biocel.2016.08.021, PMID 27566364.
- P. Hsu, Y. Shi: Regulation of autophagy by mitochondrial phospholipids in health and diseases. In: Biochimica et Biophysica Acta. [elektronische Veröffentlichung vor dem Druck] August 2016, doi:10.1016/j.bbalip.2016.08.003, PMID 27502688.
- E. E. Mowers, M. N. Sharifi, K. F. Macleod: Autophagy in cancer metastasis. In: Oncogene. [elektronische Veröffentlichung vor dem Druck] September 2016, doi:10.1038/onc.2016.333, PMID 27593926.
- B. M. Edens, N. Miller, Y. C. Ma: Impaired Autophagy and Defective Mitochondrial Function: Converging Paths on the Road to Motor Neuron Degeneration. In: Frontiers in cellular neuroscience. Band 10, 2016, S. 44, doi:10.3389/fncel.2016.00044, PMID 26973461, PMC 4776126 (freier Volltext).
- Y. Kiriyama, H. Nochi: The Function of Autophagy in Neurodegenerative Diseases. In: International journal of molecular sciences. Band 16, Nummer 11, 2015, S. 26797–26812, doi:10.3390/ijms161125990, PMID 26569220, PMC 4661849 (freier Volltext).
- X. Liu, H. Qin, J. Xu: The role of autophagy in the pathogenesis of systemic lupus erythematosus. In: International immunopharmacology. [elektronische Veröffentlichung vor dem Druck] September 2016, doi:10.1016/j.intimp.2016.09.017, PMID 27673477.
- N. Prieto-Domínguez, R. Ordóñez, A. Fernández, A. García-Palomo, J. Muntané, J. González-Gallego, J. L. Mauriz: Modulation of Autophagy by Sorafenib: Effects on Treatment Response. In: Frontiers in pharmacology. Band 7, 2016, S. 151, doi:10.3389/fphar.2016.00151, PMID 27375485, PMC 4896953 (freier Volltext).
- A. R. Solitro, J. P. MacKeigan: Leaving the lysosome behind: novel developments in autophagy inhibition. In: Future medicinal chemistry. Band 8, Nummer 1, Januar 2016, S. 73–86, doi:10.4155/fmc.15.166, PMID 26689099, PMC 4886745 (freier Volltext).
- M. Xilouri, L. Stefanis: Chaperone mediated autophagy in aging: Starve to prosper. In: Ageing research reviews. [elektronische Veröffentlichung vor dem Druck] Juli 2016, doi:10.1016/j.arr.2016.07.001, PMID 27484893.
- Lee J, Giordano S, Zhang J: Autophagy, mitochondria and oxidative stress: cross-talk and redox signalling. In: Biochem. J.. 441, Nr. 2, Januar 2012, S. 523–40. doi:10.1042/BJ20111451. PMID 22187934. PMC 3258656 (freier Volltext).
- Mizushima N, Ohsumi Y, Yoshimori T: Autophagosome formation in mammalian cells. In: Cell Struct. Funct.. 27, Nr. 6, Dezember 2002, S. 421–9. doi:10.1247/csf.27.421. PMID 12576635.
- Levine B, Mizushima N, Virgin HW: Autophagy in immunity and inflammation. In: Nature. 469, Nr. 7330, Januar 2011, S. 323–35. doi:10.1038/nature09782. PMID 21248839. PMC 3131688 (freier Volltext).
- Česen MH, Pegan K, Spes A, Turk B: Lysosomal pathways to cell death and their therapeutic applications. In: Exp. Cell Res.. 318, Nr. 11, Juli 2012, S. 1245–51. doi:10.1016/j.yexcr.2012.03.005. PMID 22465226.
- A. J. Kruppa, J. Kendrick-Jones, F. Buss: Myosins, Actin and Autophagy. In: Traffic (Copenhagen, Denmark). Band 17, Nummer 8, August 2016, S. 878–890, doi:10.1111/tra.12410, PMID 27146966, PMC 4957615 (freier Volltext).
- Homma, K.S.: List of autophagy-related proteins and 3D structures Archiviert vom Original am 1. August 2012. In: Autophagy Database. 290, 2011. Abgerufen am 8. Oktober 2012.
- Lysosomes, Autophagy – Learn Science at Scitable. In: nature.com. 10. April 2003, abgerufen am 3. Oktober 2016 (englisch).
- Bandyopadhyay U, Kaushik S, Varticovski L, Cuervo AM: The chaperone-mediated autophagy receptor organizes in dynamic protein complexes at the lysosomal membrane. In: Mol. Cell. Biol.. 28, Nr. 18, September 2008, S. 5747–63. doi:10.1128/MCB.02070-07. PMID 18644871. PMC 2546938 (freier Volltext).
- R. Yang, G. Gao, Z. Mao, Q. Yang: Chaperone-Mediated Autophagy and Mitochondrial Homeostasis in Parkinson’s Disease. In: Parkinson's disease. Band 2016, 2016, S. 2613401, doi:10.1155/2016/2613401, PMID 27413575, PMC 4927950 (freier Volltext).
- C. Münz: Autophagy Beyond Intracellular MHC Class II Antigen Presentation. In: Trends in immunology. [elektronische Veröffentlichung vor dem Druck] September 2016, doi:10.1016/j.it.2016.08.017, PMID 27667710.
- N. S. Castrejón-Jiménez, K. Leyva-Paredes, J. C. Hernández-González, J. Luna-Herrera, B. E. García-Pérez: The role of autophagy in bacterial infections. In: Bioscience trends. Band 9, Nummer 3, Juni 2015, S. 149–159, doi:10.5582/bst.2015.01035, PMID 26166368.
- C. G. Towers, A. Thorburn: Therapeutic Targeting of Autophagy. In: EBioMedicine. Band 14, Dezember 2016, S. 15–23, doi:10.1016/j.ebiom.2016.10.034, PMID 28029600, PMC 5161418 (freier Volltext) (Review).
- J. M. Levy, C. G. Towers, A. Thorburn: Targeting autophagy in cancer. In: Nature Reviews Cancer. Band 17, Nummer 9, September 2017, S. 528–542, doi:10.1038/nrc.2017.53, PMID 28751651 (Review).
- Frank Madeo et al.: Induction of autophagy by spermidine promotes longevity. In: US National Library of Medicine National Institutes of Health (Hrsg.): Nat Cell Biol. 11. November 2009, S. 1305–1314, doi:10.1038/ncb1975, PMID 19801973.
- S. Kiechl et al.: Higher spermidine intake is linked to lower mortality: Prospective population-based study. American Journal of Clinical Nutrition (AJCN), doi:10.1093/ajcn/nqy102
- Miranka Wirth, Gloria Benson, Claudia Schwarz, Theresa Köbe, Ulrike Grittner: The effect of spermidine on memory performance in older adults at risk for dementia: A randomized controlled trial. In: Cortex; a Journal Devoted to the Study of the Nervous System and Behavior. Band 109, Dezember 2018, ISSN 1973-8102, S. 181–188, doi:10.1016/j.cortex.2018.09.014, PMID 30388439 (nih.gov [abgerufen am 11. September 2020]).
- T. P. Ashford, K. R. Porter: Cytoplasmic components in hepatic cell lysosomes. In: Journal of Cell Biology. Band 12, Januar 1962, S. 198–202, PMID 13862833, PMC 2106008 (freier Volltext).
- Z. Hruban, B. Spargo, H. Swift, R. W. Wissler, R. G. Kleinfeld: Focal cytoplasmic degradation. In: The American journal of pathology. Band 42, Juni 1963, S. 657–683, PMID 13955261, PMC 1949709 (freier Volltext).
- D. J. Klionsky: Autophagy revisited: a conversation with Christian de Duve. In: Autophagy. Band 4, Nummer 6, August 2008, S. 740–743, PMID 18567941.
- C. de Duve: Lysosomes revisited. In: European Journal of Biochemistry / FEBS. Band 137, Nummer 3, Dezember 1983, S. 391–397, PMID 6319122.
- R. L. Deter, P. Baudhuin, C. De Duve: Participation of lysosomes in cellular autophagy induced in rat liver by glucagon. In: Journal of Cell Biology. Band 35, Nummer 2, November 1967, S. C11–C16, PMID 6055998, PMC 2107130 (freier Volltext).
- R. L. Deter, C. De Duve: Influence of glucagon, an inducer of cellular autophagy, on some physical properties of rat liver lysosomes. In: Journal of Cell Biology. Band 33, Nummer 2, Mai 1967, S. 437–449, PMID 4292315, PMC 2108350 (freier Volltext).
- K. Takeshige, M. Baba, S. Tsuboi, T. Noda, Y. Ohsumi: Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. In: Journal of Cell Biology. Band 119, Nummer 2, Oktober 1992, S. 301–311, PMID 1400575, PMC 2289660 (freier Volltext).
- M. Tsukada, Y. Ohsumi: Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae. In: FEBS letters. Band 333, Nummer 1–2, Oktober 1993, S. 169–174, PMID 8224160.
- M. Thumm, R. Egner, B. Koch, M. Schlumpberger, M. Straub, M. Veenhuis, D. H. Wolf: Isolation of autophagocytosis mutants of Saccharomyces cerevisiae. In: FEBS letters. Band 349, Nummer 2, August 1994, S. 275–280, PMID 8050581.
- D. J. Klionsky, R. Cueva, D. S. Yaver: Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway. In: Journal of Cell Biology. Band 119, Nummer 2, Oktober 1992, S. 287–299, PMID 1400574, PMC 2289658 (freier Volltext).
- T. M. Harding, K. A. Morano, S. V. Scott, D. J. Klionsky: Isolation and characterization of yeast mutants in the cytoplasm to vacuole protein targeting pathway. In: Journal of Cell Biology. Band 131, Nummer 3, November 1995, S. 591–602, PMID 7593182, PMC 2120622 (freier Volltext).
- TM Harding, A Hefner-Gravink, M Thumm, DJ Klionsky: Genetic and phenotypic overlap between autophagy and the cytoplasm to vacuole protein targeting pathway.. In: The Journal of biological chemistry. 271, Nr. 30, 26. Juli 1996, S. 17621-4. PMID 8663607.
- SV Scott, A Hefner-Gravink, KA Morano, T Noda, Y Ohsumi, DJ Klionsky: Cytoplasm-to-vacuole targeting and autophagy employ the same machinery to deliver proteins to the yeast vacuole.. In: Proceedings of the National Academy of Sciences. 93, Nr. 22, 29. Oktober 1996, S. 12304-8. PMID 8901576.
- XH Liang, S Jackson, M Seaman, K Brown, B Kempkes, H Hibshoosh, B Levine: Induction of autophagy and inhibition of tumorigenesis by beclin 1.. In: Nature. 402, Nr. 6762, 9. Dezember 1999, S. 672-6. doi:10.1038/45257. PMID 10604474.
- DJ Klionsky, JM Cregg, Jr Dunn WA, SD Emr, Y Sakai, IV Sandoval, A Sibirny, S Subramani, M Thumm, M Veenhuis, Y Ohsumi: A unified nomenclature for yeast autophagy-related genes.. In: Developmental cell. 5, Nr. 4, Oktober 2003, S. 539-45. PMID 14536056.
- Nature News: Medicine Nobel for research on how cells eat themselves. Abgerufen am 4. Oktober 2016.