Kjeldahlsche Stickstoffbestimmung
Die Kjeldahlsche Stickstoffbestimmung, im klinischen Bereich gelegentlich auch als Kjeldahlometrie bezeichnet, ist eine 1883 entwickelte quantitative, häufig verwendete Bestimmungsmethode des Stickstoffgehaltes. Der dänische Chemiker Johan Kjeldahl entwickelte sie am Forschungszentrum der dänischen Brauerei Carlsberg. Sie löste rasch die zuvor weit verbreitete Stickstoffbestimmung nach Will-Varrentrapp ab. Stickstoff kann mit der Methode von Kjeldahl in vielen stickstoffhaltigen Substanzen bestimmt werden, was sich in ihrem breiten Anwendungsfeld äußert:
- Nahrungsmittelindustrie
- Umweltanalytik
- Pharmazeutische und chemische Industrie
- Landwirtschaftliche Analytik (Wirtschaftsdünger, Bodenproben)
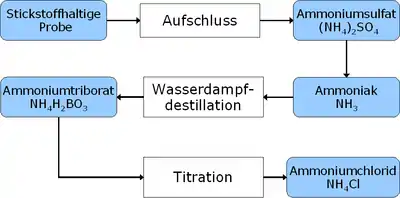
Beim klassischen Vorgehen schließt man eine genau gewogene Probenmenge (0,5 bis 3 g, je nach deren Stickstoffgehalt) mit Schwefelsäure in einem Kjeldahl-Kolben auf. Die organischen Anteile der Probe werden dabei entfernt und der Stickstoff in Ammoniumsulfat umgewandelt. Die Zugabe einer starken Base setzt Ammoniak aus der Aufschlusslösung frei, der in Säure aufgefangen und titrimetrisch bestimmt wird. Die Angabe erfolgt als Total Kjeldahl Nitrogen.
Es existieren auch Mikro-Methoden für Proben von 5 bis 15 mg.
Zudem lässt sich die gesamte Bestimmung mittels vollautomatischer Laborgeräte – auch mit mehreren Proben gleichzeitig – automatisieren, sodass die Analysen ohne anwesendes Personal über Nacht abgewickelt werden können.
Aufschluss
Beim Aufschluss wird die Probe mit einem Überschuss an Schwefelsäure in einem offenen Kolben gekocht. Dabei wird der Kohlenstoff im organischen Material zu Kohlendioxid (CO2) oxidiert und Schwefelsäure zu Schwefeldioxid (SO2) reduziert:

Zur verbesserten Umsetzung der Reaktion wird ein Katalysator, bestehend aus Hg-, Se-, Cu- oder Ti-Verbindungen, verwendet. Die Aufschlusstemperatur in einem offenen Kolben ist durch den Siedepunkt der Schwefelsäure begrenzt. Um eine höhere Temperatur zu erreichen, kann eine schwer flüchtige Verbindung zugegeben werden. Um eine solche Siedepunkterhöhung zu bewirken, werden beim Kjeldahlaufschluss Natrium- oder Kaliumsulfat (Na2SO4 bzw. K2SO4) verwendet.
Es können nicht alle Substanzen direkt aufgeschlossen werden. Liegt der Stickstoff in einer Nitro-, Nitroso- oder Azoverbindung vor, so muss zuerst eine Reduktion (beispielsweise mit Zink oder Devardscher Legierung) durchgeführt werden.
Der Schwefelsäureaufschluss kann neben der Bestimmung von Stickstoff auch zur Bestimmung von Phosphor, Arsen und von Metallen in organischem Material verwendet werden.
Wasserdampfdestillation
Nach dem Aufschluss liegt der Stickstoff als Ammoniumsulfat (NH4)2SO4 in Schwefelsäure gelöst vor. Bei Zugabe einer starken Base (beispielsweise NaOH) wird die Schwefelsäure neutralisiert und Ammoniak ausgetrieben, der mittels Wasserdampfdestillation quantitativ in eine Säurevorlage eingeleitet werden kann.
Zum Auffangen kann prinzipiell jede Säure verwendet werden. Wird eine starke Säure verwendet, so muss diese genau abgemessen werden, da die nach dem Einleiten von Ammoniak verbleibende Säure mit einer Base zurück titriert wird. Wird hingegen eine schwache Säure verwendet, wie beispielsweise Borsäure mit einem pKs-Wert von 9,25, so kann die beim Auffangen entstandene starke Base mit einer Säure titriert werden, ohne dass überschüssige Auffangsäure mit erfasst wird. Dies bringt den Vorteil, dass die schwache Säure nicht genau abgemessen werden muss. Borsäure reagiert nicht direkt als Protonendonator, sondern als OH−-Akzeptor im Sinne einer Lewis-Säure:
Titration
Für die direkte Titration von Borat wird ein Indikatorgemisch aus Methylrot und Methylenblau (Tashiro) verwendet, das im Sauren umschlägt. Das verbrauchte Maßlösungsvolumen kann in die Stickstoffmenge der Probe umgerechnet werden.
Proteingehalt
Der mit dieser Methode bestimmte Stickstoffgehalt steht im Zusammenhang mit dem Proteingehalt einer biologischen Probe. Bei den meisten Lebensmitteln kann man davon ausgehen, dass der Kjeldahl-Stickstoff hauptsächlich aus den Proteinen stammt. Bei der Umrechnung von Stickstoffgehalt zu Proteingehalt muss berücksichtigt werden, dass die einzelnen Aminosäuren einen verschiedenen Stickstoffgehalt besitzen und somit eine weit vom Durchschnitt abweichende Zusammensetzung der Proteine zu einem unterschiedlichen Umrechnungsfaktor führt. Dieser Faktor muss somit zuvor für verschiedene Proteinquellen mit einer anderen Methode bestimmt werden, wie etwa der Spaltung der Proteine, gefolgt von Bestimmung der einzelnen Aminosäuren. Die so gefundenen Stickstoffanteile im Protein betragen durchschnittlich 16 %. Der analytisch ermittelte Stickstoffgehalt einer Probe muss mit dem Faktor 6,25 multipliziert werden, um den Proteingehalt zu berechnen. Bei Weizenmehlen, Grieß und Dunst beträgt der Faktor 5,7.
Weitere Abweichungen können auftreten, wenn neben den Proteinen weitere Stickstoffquellen vorhanden sind. So zeigt zum Beispiel der Melaminskandal 2008 in China die Grenzen dieses Verfahrens: Streckung von Milchprodukten, um bei gebräuchlichen Messverfahren einen höheren Proteingehalt vorzutäuschen.
Literatur
- Johan Kjeldahl: Neue Methode zur Bestimmung des Stickstoffs in organischen Körpern. In: Zeitschrift für Analytische Chemie.1883, S. 366–382.
- R. Hoegger: Training Papers Nitrogen determination according to Kjeldahl. Büchi Labortechnik AG, Flawil 1998, S. 1–18.
- R. Bock: Aufschlussmethoden der anorganischen und organischen Chemie. Wiley-VCH, Weinheim 1972, ISBN 978-3527254033, S. 142–145.