Tinzaparin
Tinzaparin (Freiname für das arzneilich verwendete Natriumsalz: Tinzaparin-Natrium) ist ein Blutgerinnungshemmer und gehört zu der Gruppe der niedermolekularen Heparine. Es wird zur Vorbeugung und Behandlung von tiefen Venenthrombosen und Lungenembolien eingesetzt und durch eine subkutane Injektion verabreicht. Tinzaparin wird zudem zur Hämodialyse im extrakorporalen Kreislauf eingesetzt.
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
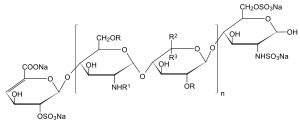 | |||||||||
| n = 1 bis 25, R = H oder SO3Na, R1 = H, SO3Na oder COCH3, R2 = H und R3 = COONa oder R2 = COONa und R3 = H[1] | |||||||||
| Allgemeines | |||||||||
| Name | Tinzaparin | ||||||||
| CAS-Nummer | |||||||||
| Monomere/Teilstrukturen | substituiertes Disaccharid | ||||||||
| Qualitative Summenformel |
unspezifisch | ||||||||
| Molmassenabschätzung | |||||||||
| ATC-Code |
B01AB10 | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Toxikologische Daten | |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Tinzaparin-Natrium ist das Natriumsalz der Wirksubstanz, die durch enzymatische Depolymerisation (= Aufspaltung) von unfraktionierten Heparinketten mittels Heparinase gewonnen wird. Heparinase wird vom Flavobacterium heparinum gewonnen. Tinzaparin-Natrium wird vom dänischen Unternehmen LEO Pharma in Europa hergestellt und als Injektionslösung weltweit unter dem Handelsnamen innohep vermarktet. Das Medikament ist verschreibungspflichtig.
Pharmakologie
Tinzaparin wirkt hemmend auf verschiedene Gerinnungsfaktoren in der Gerinnungskaskade. Dabei werden über Antithrombin der Gerinnungsfaktor X sowie der Gerinnungsfaktor II gehemmt. Zudem wird der Gewebefaktor über die Freisetzung von Tissue Factor Pathway Inhibitor (TFPI) gehemmt. Folglich wird weniger Thrombin hergestellt und dadurch wird die Produktion eines Fibrinnetzes gehemmt. Das Resultat ist eine herabgesetzte Blutgerinnung.
Die Wirkstärke von Tinzaparin wird anhand der Anti-Faktor-Xa-Bestimmung ermittelt und in Anti-Xa Internationalen Einheiten (IE) angegeben.
Die Gesamtwirkung eines niedermolekularen Heparins kann nicht direkt gemessen werden. Anti-Xa- und Anti-IIa-Messungen werden bei niedermolekularen Heparinen als primäre Surrogatbiomarker aushilfsweise verwendet. Eine Messung der Anti-Xa-Spiegel wird im klinischen Alltag zumeist nicht durchgeführt, da diese Messung nicht direkt mit der Wirkung im Körper korreliert.
Die durchschnittliche Molare Masse liegt zwischen 5.500 und 7.500 Dalton (Medianwert = 6.500 Dalton).
Die Tabelle fasst die anhand von Anti-Xa-Messungen ermittelten pharmakokinetischen Eigenschaften von Tinzaparin zusammen (abgegeben sind jeweils Mittelwert und Standardabweichung):[1]
| Parameter (Einheit) | Mehrfachdosierung (n=21) | Einfachdosierung (n=14) | |
|---|---|---|---|
| Tag 1 175 IE/kg | Tag 5 175 IE/kg | 4.500 IE * | |
| C max (IE/ml) | 0,87 (0,15) | 0,93 (0,15) | 0,25 (0,05) |
| T max (h) | 4,4 (0,7) | 4,6 (1,0) | 3,7 (0,9) |
| AUC 0-∞ (IE h/ml) | 9,0 (1,1) | 9,7 (1,4) | 2,0 (0,5) |
| T 1/2 (h) | 3,3 (0,8) | 3,5 (0,6) | 3,4 (1,7) |
- * entsprechend durchschnittlich 64,3 IE/kg
Anwendungsgebiete
Tinzaparin-Natrium ist in Deutschland dosisabhängig für mehrere Anwendungsgebiete bei Erwachsenen zugelassen:
- Alle Stärken kommen zur Gerinnungshemmung im extrakorporalen Kreislauf während der Hämodialyse und Hämofiltration bei Erwachsenen zur Anwendung.
- 3.500 Anti-Xa I.E./Tag sind zur Vorbeugung (Prophylaxe) vor venösen Thromboembolien mit mittlerem thromboembolischen Risiko (d. h. chirurgische und nicht-chirurgische Patienten, die wegen einer akuten internistischen Erkrankung immobilisiert sind) zugelassen.[5][6]
- 4.500 Anti-Xa I.E./Tag dienen der Prophylaxe venöser Thromboembolien bei Patienten mit höherem Risiko. Dazu zählen chirurgische Patienten die sich einer Operation unterziehen, insbesondere einer orthopädischen, allgemeinchirurgischen oder onkologischen Operation. Ferner gehören dazu nicht-chirurgische Patienten, die wegen einer akuten internistischen Erkrankung immobilisiert sind, also etwa durch akutes Herzversagen, akutes Atemversagen, eine schwere Infektion, aktive Tumorerkrankung oder der Verschlechterung rheumatischer Erkrankungen.[7][6]
- 8.000 Anti-Xa I.E bis 18.000 Anti-Xa I.E./Tag sind vorgesehen für die Behandlung von Venenthrombosen und thromboembolischen Erkrankungen. Eingeschlossen sind die Behandlung tiefer Venenthrombosen und Lungenembolien sowie die Langzeitbehandlung venöser Thromboembolien und Rezidivprophylaxe bei Patienten mit aktiver Tumorerkrankung. Bei bestimmten Patienten mit Lungenembolien (z. B. Patienten mit schwerer hämodynamischer Instabilität) kann eine alternative Behandlung wie z. B. eine Operation oder Thrombolyse angezeigt sein.[8][9]
Entwicklung
Die klinische Entwicklung von Tinzaparin führte 1994 zur Zulassung im Prophylaxebereich nach chirurgischen Eingriffen. 1997 wurde Tinzaparin in Deutschland, als der erste Vertreter niedermolekularer Heparine, zur Initialtherapie der tiefen Beinvenenthrombose, 1999 zur Akuttherapie der Lungenembolie bei hämodynamisch stabilen Patienten (bis Beginn Stadium III) zugelassen.
Die weitere klinische Entwicklung konzentrierte sich auf Patienten mit besonderen Risikokonstellationen wie z. B. Krebspatienten. Tinzaparin wurde im September 2016 für die Anwendung bei Krebspatienten mit aktiver Tumorerkrankung und in der verlängerten Sekundärprophylaxe akuter Beinvenenthrombose bzw. Lungenembolie (3–6 Monate und darüber hinaus) zugelassen.
Praktische Merkmale
In allen Anwendungsgebieten wird Tinzaparin nur 1 × täglich subkutan gespritzt. Dies gilt insbesondere auch für die Anwendung im therapeutischen Bereich.
Tinzaparin kumuliert nicht bei älteren Patienten mit eingeschränkter Nierenfunktion und führt bei Patienten die 70 Jahre und älter sind im Vergleich zur aPTT adjustierten unfraktionierten Heparin-Verabreichung zu keiner erhöhten Blutungsneigung. Eine Dosisanpassung ist bei diesen Patienten nicht notwendig. Dadurch wird einem möglichen Wirksamkeitsverlust von Tinzaparin vorgebeugt.
Gegenanzeigen und Anwendungsbeschränkungen
Tinzaparin darf, wie andere niedermolekulare Heparine auch, nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff, bei Gerinnungsstörungen wie etwa dem Vorliegen einer verringerten Anzahl von Blutplättchen (Thrombozytopenie) oder einem Mangel an Gerinnungsfaktoren, bei Blutungsneigung etwa durch Geschwüre oder andere Organveränderungen und durch Verletzungen, sowie bei septischer Endokarditis.[5][6][7][8][9]
Therapeutische Dosen (175 I.E./kg) sind kontraindiziert bei Patienten, die eine neuroaxiale Anästhesie erhalten. Das Medikament ist spätestens 24 Stunden vor solch einem geplanten Eingriff abzusetzen und die Verabreichung frühestens 4–6 Stunden nach der Anästhesie bzw. Entfernen des Katheters fortzusetzen.
Die Anwendung von Tinzaparin bei Patienten mit einer Kreatinin-Clearance unter 30 ml/min wird nicht empfohlen, da für diese Patientengruppe keine Dosis ermittelt wurde. Die vorhandene Datenlage zeigt, dass bei einer Kreatinin-Clearance von 20 ml/min oder höher keine Akkumulation des Wirkstoffs stattfindet. Bei Bedarf kann bei diesen Patienten die Behandlung mit Tinzaparin mit Vorsicht unter Anti-Xa-Überwachung erfolgen. Auch wenn die Anti-Xa-Überwachung, die mittels Chromogen-Assay erfolgt, zur Vorhersage eines Blutungsrisikos nur bedingt geeignet ist, ist sie dennoch am besten brauchbar zur Messung der pharmakodynamischen Wirkung. Falls erforderlich, ist die Dosis auf Basis der Anti-Faktor-Xa-Aktivität anzupassen.[5][6][7][8][9]
Weblinks
- Datenblatt TINZAPARIN SODIUM CRS (PDF) beim EDQM, abgerufen am 30. Juli 2017.
Einzelnachweise
- Tinzaparin Full Prescribing Information USA.
- European Pharmacopoeia, 6th Edition, 2008.
- Datenblatt Heparin sodium salt from porcine intestinal mucosa bei Sigma-Aldrich, abgerufen am 30. Juli 2017 (PDF).
- H. A. Spiller: Heparin and Low-Melecular-Weight Heparins. In R. C. Dart: Medical toxicology. 3. Auflage. Lippincott Williams & Wilkins, 2004, ISBN 0-7817-2845-2, S. 618ff.
- Fachinformation innohep® 3.500 u. innohep® multi Stand 12/2019
- Fachinformation innohep® multi 10.000 Anti-Xa I.E./ml Stand 12/2019
- Fachinformation innohep® 4.500 u. innohep® multi Stand 12/2019
- Fachinformation innohep® 8.000/10.000/12.000/14.000/16.000/18.000 Anti-Xa I.E./ 0,4/0,5/0,6/0,7/0,8/0,9 ml Inj.lsg. FS Stand 12/2019
- Fachinformation innohep® 20.000 Anti-Xa I.E./ml Durchstechflaschen Inj.lsg. Stand 12/2019