Polyelektrolyte
Polyelektrolyte sind wasserlösliche Verbindungen mit großer Kettenlänge (Polymere), die anionische (Polysäuren) oder kationische (Polybasen) dissoziierbare Gruppen tragen.
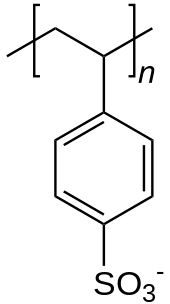
Man kann zwischen starken Polyelektrolyten, die eine permanente, vom pH-Wert der Lösung unabhängige Ladung tragen, und schwachen Polyelektrolyten, deren Dissoziationsgrad vom pH-Wert der Lösung abhängt, unterscheiden. Beispiele für starke Polyelektrolyte sind Natrium-Polystyrolsulfonat (anionisch) oder Poly-Diallyldimethyl-ammoniumchlorid (kationisch), Vertreter der schwachen Polyelektrolyte sind Polyacrylsäure (sauer) oder Polyethylenimin (basisch). Die Eigenschaften einer Polyelektrolytlösung werden größtenteils von den abstoßenden Wechselwirkungen der gleichgeladenen Gruppen an der Polymerkette bestimmt.
Die Ladungsintensität von Polyelektrolyten lässt sich durch Titration (Polyelektrolyttitration) exakt bestimmen.
Ein zu den Biopolymeren gehörender, starker Polyelektrolyt ist auch das DNA-Molekül.
Polyelektrolyt-Effekt
Ein typisches Beispiel hierfür ist das Viskositätsverhalten von salzfreien Polyelektrolytlösungen. Während die Viskosität neutraler Polymerlösungen mit zunehmender Verdünnung linear abfällt, zeigen Polyelektrolytlösungen einen Anstieg der Viskosität. Man erklärt dies mit einer zunehmenden Versteifung des Polymeren durch die Abstoßung der gleichgeladenen Gruppen, da bei fallender Konzentration die Ionenstärke der Lösung abnimmt und damit die Ladungen schlechter abgeschirmt werden und schwache Polyelektrolyte bei zunehmender Verdünnung stärker dissoziieren (Ostwaldsches Verdünnungsgesetz). Dieser versteifende Effekt ist als Polyelektrolyteffekt bekannt. Die Viskosität als makroskopisch zugängliche Eigenschaft von Polymerlösungen wird also bestimmt durch die Konformation der gelösten Polyelektrolytmoleküle. Stark geladene Polyelektrolyte strecken sich in der Lösung aus, wohingegen Polyelektrolyte mit verminderter Ladung oder abgeschirmten Ladungen zum Verknäulen neigen. Dieses Verknäulen kann bei schwachen Polyelektrolyten durch den pH-Wert und die Salzkonzentration und bei starken Polyelektrolyten ausschließlich durch die Salzkonzentration kontrolliert werden. Eine wichtige Anwendung dieser Eigenschaften ist die Polyelektrolytadsorption auf Feststoffoberflächen, wie sie z. B. beim Layer-by-layer Verfahren zum Einsatz kommt.
Polyelektrolyt-Adsorption
Gelöste Polyelektrolyte können auf entgegengesetzt geladenen Oberflächen adsorbieren. Die Adsorption wird unter anderem getrieben durch die elektrostatische Anziehung zwischen den geladenen Monomereinheiten und entgegengesetzt geladenen dissoziierten Oberflächengruppen (z. B. SiO-Gruppen auf Siliziumdioxidoberflächen). Aber auch die Freisetzung von Gegenionen oder die Ausbildung von Wasserstoffbrückenbindungen ermöglichen die Adsorption. Die Konformation des Polyelektrolyten im gelösten Zustand bestimmt die adsorbierte Stoffmenge. Gestreckte Polyelektrolytmoleküle adsorbieren als dünne Filme (0,2–1 nm) auf der Oberfläche, wohingegen geknäulte Polyelektrolytmoleküle dickere Schichten ausbilden (1–8 nm).[1][2]
Polymerisationsgrad
Polyelektrolyte unterscheiden sich, neben ihrer Ladungsaktivität, vor allem hinsichtlich ihrer Molaren Masse. Niedermolekulare Polyelektrolyte haben eine Molare Masse bis zu 100.000 g·mol−1, hochmolekulare Polyelektrolyte bis über 10 Millionen. Bei einem theoretischen C-C-Abstand in der Molekülkette von 1,53 Ångström kann die Molekülkette eine Länge von über 15 µm erreichen. Niedermolekulare Polyelektrolyte werden vor allem als Dispergiermittel verwendet, hochmolekulare Polyelektrolyte als Flockungshilfsmittel. In Abhängigkeit von der Molare Masse steigt die Viskosität der Polyelektrolyt-Lösungen. Niedermolekulare Lösungen sind wässrig bis leicht viskos, hochmolekulare Lösungen bereits in einer Konzentration von 0,1 % extrem viskos.
Hochmolekulare Polyelektrolyte lassen sich wegen der extremen Viskosität nicht als wässrige Lösungen herstellen, sondern nur durch Blockpolymerisation, wobei als Endprodukte Pulver entstehen, oder durch Emulsionspolymerisation mit flüssigen Emulsionen als Endprodukte.
Beispiele wichtiger Polyelektrolyte
Die wichtigsten Vertreter der anionischen Polyelektrolyte (Polyanionen) sind:
- Acrylamid-Copolymere
- Alginate
- Ligninsulfonate
- Pektine
- Polyacrylsäure und entsprechende Co-Polymere
- Polyvinylschwefelsäure
- Polycarbonsäuren (Sammelbegriff)
- Polyphosphorsäuren
- Polysaccharide
- Vernetztes Polystyrolsulfonsäure
- Unvernetztes Polystyrolsulfonat
Zu den kationischen Polyelektrolyten werden gezählt:
- Phenole
- Poly-Diallyldimethyl-ammoniumchlorid
- Polyethylenimin
- Polyvinylamin
- Polyvinylpyridin
- Polyvinylammoniumchlorid
Literatur
- Eintrag zu Polyelektrolyte. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Januar 2015.
- Klaus Weissermel, Hans-Jürgen Arpe: Industrielle organische Chemie. 2. Auflage. Verlag Chemie, Weinheim 1978, ISBN 3-527-25756-X.
- H. Dautzenberg: Polyelectrolytes: formation, characterization and application. Hanser/Gardner, München etc. 1994, ISBN 3-446-17127-4.
Einzelnachweise
- Stability of Aqueous Al203 Suspensions with PMAA Polyelectrolyte (PDF; 712 kB), J. Am. Ceram. Soc., 1988, 71 (4), 250–55.
- pH-Dependent Thickness Behavior of Sequentially Adsorbed Layers of Weak Polyelectrolytes, Macromolecules, 2000, 33 (11), 4213–4219; doi:10.1021/ma991645q.