Dalteparin
Dalteparin ist ein niedermolekulares Heparin (NMH). Es wird unter dem Namen Fragmin für die Injektion vermarktet. Wie andere niedermolekulare Heparine wird Dalteparin (in Form des Natriumsalzes Dalteparin-Natrium) zur Prophylaxe oder Behandlung von Venenthrombosen und Lungenembolien eingesetzt, um das Risiko eines Schlaganfalls oder Herzinfarkts zu verringern.[2] Dalteparin wirkt durch Verstärkung der Aktivität von Antithrombin III und hemmt sowohl die Bildung von Faktor Xa als auch von Thrombin.[3] Es wird normalerweise durch subkutane Selbstinjektion verabreicht.
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
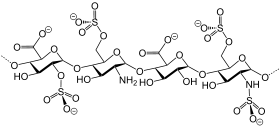 | |||||||||
| Möglicher Strukturausschnitt von Dalteparin-Natrium | |||||||||
| Allgemeines | |||||||||
| Name | Dalteparin | ||||||||
| CAS-Nummer | |||||||||
| ECHA-InfoCard | |||||||||
| Monomere/Teilstrukturen | glykosidisch verknüpfte Glucosamin- und Uronsäurebausteine | ||||||||
| Molmassenabschätzung |
ca. 6000 Dalton | ||||||||
| PubChem | 772 | ||||||||
| ATC-Code |
B01AB04 | ||||||||
| DrugBank | DB06779 | ||||||||
| Arzneistoffangaben | |||||||||
| Wirkstoffklasse | |||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Eigenschaften
Dalteparin-Natrium wird durch Depolymerisation von aus Darmschleimhaut von Schweinen gewonnenem Heparin durch Einwirkung von salpetriger Säure erhalten. Die meisten Komponenten besitzen eine 2-O-Sulfo-α-L-idopyranosuronsäure-Struktur am nichtreduzierenden Kettenende und eine 2,5-Anhydro-6-O-sulfo-D-mannitol-Struktur am reduzierenden Kettenende Die durchschnittliche molare Masse beträgt ca. 6000 Dalton (5600 – 6400 Dalton). Der Sulfatierungsgrad beträgt 2,0 bis 2,5 pro Disaccharid-Einheit.[4]
Studien
Die 2003 veröffentlichte CLOT-Studie zeigte, dass Dalteparin bei Krebs-Patienten mit einer akuten venösen Thromboembolie (VTE) wirksamer als Warfarin das Risiko wiederkehrender embolischer Ereignisse reduzierte.[5] Dalteparin ist unfraktioniertem Heparin in der Verhinderung von Blutgerinnseln nicht überlegen.[6]
NMH mit niedriger mittlerer Molmasse werden hauptsächlich über die Nieren eliminiert, bei solchen mit höherer mittlerer Molmasse kommen zudem auch andere Mechanismen zum Tragen. Basierend auf Tierversuchen werden etwa 70 % des Dalteparins über die Nieren ausgeschieden.[3] Studien haben gezeigt, dass sich Dalteparin bei eingeschränkter Nierenfunktion nicht anreichert.[7]
Im Mai 2019 hat die US-amerikanische Food and Drug Administration (FDA) die Injektion von Fragmin zur Verringerung des Wiederauftretens einer symptomatischen venösen Thromboembolie bei Kindern im Alter ab einem Monat zugelassen.[8]
Einzelnachweise
- Datenblatt Dalteparin bei Sigma-Aldrich, abgerufen am 3. Mai 2021 (PDF).
- Dalteparin – Subcutaneous Injection. Abgerufen am 2. Mai 2021 (englisch).
- FRAGMIN (dalteparin sodium) Action And Clinical Pharmacology | Pfizer Medical Information – Canada. Abgerufen am 2. Mai 2021 (englisch).
- European Pharmacopoeia Commission (Hrsg.): European Pharmacopoeia 9.0. 2016, S. 2194 f.
- Agnes Y.Y. Lee, Mark N. Levine, Ross I. Baker, Chris Bowden, Ajay K. Kakkar: Low-Molecular-Weight Heparin versus a Coumarin for the Prevention of Recurrent Venous Thromboembolism in Patients with Cancer. In: New England Journal of Medicine. Band 349, Nr. 2, 10. Juli 2003, S. 146–153, doi:10.1056/NEJMoa025313, PMID 12853587.
- PROTECT Investigators for the Canadian Critical Care Trials Group and the Australian and New Zealand Intensive Care Society Clinical Trials Group, Deborah Cook, Maureen Meade, Gordon Guyatt, Stephen Walter: Dalteparin versus unfractionated heparin in critically ill patients. In: The New England Journal of Medicine. Band 364, Nr. 14, 7. April 2011, S. 1305–1314, doi:10.1056/NEJMoa1014475, PMID 21417952.
- James Douketis: Prophylaxis Against Deep Vein Thrombosis in Critically Ill Patients With Severe Renal Insufficiency With the Low-Molecular-Weight Heparin Dalteparin – An Assessment of Safety and Pharmacodynamics: The DIRECT Study. In: Archives of Internal Medicine. Band 168, Nr. 16, 8. September 2008, S. 1805, doi:10.1001/archinte.168.16.1805.
- Office of the Commissioner: FDA approves first anticoagulant (blood thinner) for pediatric patients to treat potentially life-threatening blood clots. 24. März 2020, abgerufen am 2. Mai 2021 (englisch).