Dimethylacetylsuccinat
Dimethylacetylsuccinat ist ein Derivat der Bernsteinsäure, das als Bernsteinsäuredimethylester mit einer Acetylgruppe in 2-Stellung vorliegt. Die Verbindung ist Ausgangsstoff für Heterocyclen, z. B. Pyrazolone wie im Lebensmittelfarbstoff Tartrazin.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
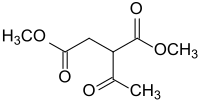 | |||||||||||||||||||
| Stereoisomerengemisch (Mischung von zwei Isomeren) Strukturformel ohne Angabe der Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dimethylacetylsuccinat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H12O5 | ||||||||||||||||||
| Kurzbeschreibung |
weißes Kristallpulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 188,18 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
löslich in Wasser (56,2 g·l−1 bei 20 °C)[3], in Methanol und Toluol[4] | ||||||||||||||||||
| Brechungsindex |
1,435–1437 (20 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Vorkommen und Darstellung
Dimethylacetylsuccinat kann analog der Organic-Syntheses-Vorschrift für Acetylbernsteinsäurediethylester[5] durch Umsetzung des Acetessigsäuremethylesters mit Chloressigsäuremethylester erhalten werden.
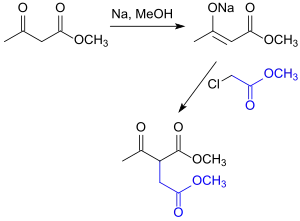
Diese Synthese wurde im Jahr 1877 von Max Conrad für den als „Acetsuccinsäureäthylester“ bezeichneten Diethylacetylbernsteinsäurediethylester (Diethylacetylsuccinat DEAS) veröffentlicht.[6]
Radikalische Addition von Acetaldehyd an die Doppelbindung von Maleinsäuredimethylester soll DMAS in hoher Ausbeute und Reinheit in einem kontinuierlichen Prozess liefern.[7]
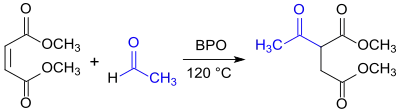
Eigenschaften
Dimethylacetylsuccinat ist ein weißes Kristallpulver, das wegen seiner niedrigen Schmelztemperatur bei Raumtemperatur auch als klare Flüssigkeit vorliegen kann.[2] Die Substanz löst sich relativ gut in Wasser, sowie in Methanol und Toluol.[4]
Anwendungen
Dimethylacetylsuccinat eignet sich als Ausgangsverbindung für Cyclobutylmethylketon[8]
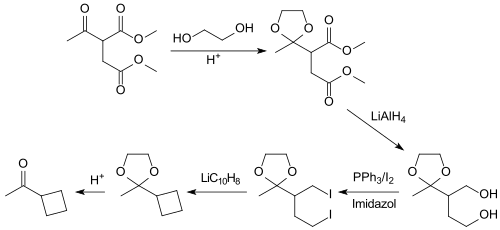
bei dem eine ketalgeschützte 1,4-Dihalogenverbindung reduktiv mit Lithiumnaphthalenid[9] zum viergliedrigen Cyclobutanring cyclisiert wird.
Dimethylacetylsuccinat reagiert mit Alkyl- und Arylhydrazinen zu Pyrazolonen und mit Thioharnstoff zu 4-Pyrimidinonen, die als heterocyclische Essigsäurederivate von Interesse sind.[4]
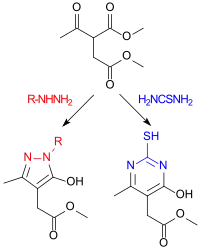
Die Hydroxygruppen am Pyrazol- bzw. Pyrimidinring lassen sich leicht mit Phosphoroxychlorid POCl3 gegen ein Chloratom austauschen, das leichter durch andere Substituenten ersetzt werden kann.
Die β-Ketoesterfunktion im Acetylbernsteinsäuredimethylester ist einer Japp-Klingemann-Reaktion mit Diazoniumsalzen zu Arylhydrazonen zugänglich, aus denen durch Cyclisierung Dihydropyrazolone bzw. die dazu tautomeren Pyrazolole entstehen.[10]
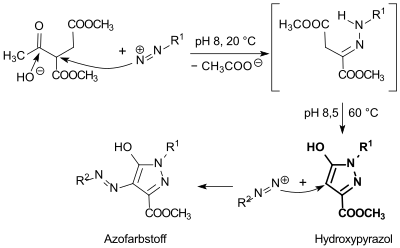
Unter kontrollierten Bedingungen (ca. 20 °C, pH 8) bildet sich zunächst aus Phenyldiazoniumchlorid (R1 = Phenyl) und Dimethylacetylsuccinat unter Abspaltung der Acetatgruppe Dimethylphenylhydrazonsuccinat, das beim Erhitzen auf 60 °C und Zugabe von Ammoniak bei pH 8,4 in 1-Phenyl-3-carbomethoxy-5-pyrazol in 94%iger Ausbeute und hoher Reinheit übergeht und durch Ansäuern isoliert werden kann. Umsetzung mit weiterem Aryldiazoniumchlorid liefert den entsprechenden Azofarbstoff aus der Klasse der Tartrazine.[11]
Auf dem vereinfachten einstufigen Syntheseweg beruht der heute gebräuchlichste industrielle Prozess zur Herstellung des auch als Acid Yellow 23 oder E 102 bezeichneten zitronengelben Lebensmittelfarbstoffs Tartrazin, der ursprünglich als gelber, lichtbeständiger Wollfarbstoff Verwendung fand.[12]
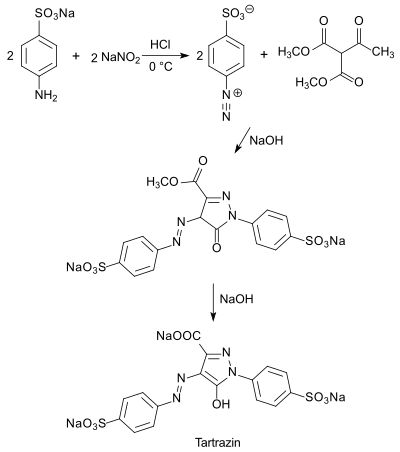
Dabei wird die doppelte Menge diazotierte Sulfanilsäure zu DMAS (bzw. Diethylacetylsuccinat DEAS) in alkalischem Medium gegeben und nach erfolgter Cyclisierung und erneuter Diazotierung die Estergruppe durch Erhitzen in Natronlauge zum sehr gut wasserlöslichen Carbonsäurensalz hydrolysiert.
Einzelnachweise
- Eintrag zu Dimethyl Acetylsuccinate bei TCI Europe, abgerufen am 25. April 2019.
- DMAS Dimethylacetyl Succinate. ESIM Chemicals GmbH, September 2015, abgerufen am 25. April 2019.
- Datenblatt Dimethylacetylsuccinat bei Sigma-Aldrich, abgerufen am 25. April 2019 (PDF).
- G.W. Craig, M. Eberle, C. Lamberth, T. Vettiger: Dimethyl acetylsuccinate as a versatile synthon in heterocyclic chemistry – A facile synthesis of heterocyclic acetic acid derivatives. In: J. prakt. Chem. Band 342, Nr. 5, 2000, S. 504–507, doi:10.1002/1521-3897(200006)342:5<504::AID-PRAC504>3.0.CO;2-R.
- H. Adkins, N. Isbell, B. Wojcik: Ethyl Acetosuccinate In: Organic Syntheses. 14, 1934, S. 38, doi:10.15227/orgsyn.014.0038; Coll. Vol. 2, 1943, S. 262 (PDF).
- M. Conrad: XLI. Ueber Acetsuccinsäureester und dessen Derivate. In: Justus Liebigs Ann. Chem. Band 188, Nr. 1–2, 1887, S. 217–226, doi:10.1002/jlac.18871880111.
- Patent CN102311345A: Continuous synthesis method of dimethyl acetylsuccinate. Angemeldet am 9. September 2009, veröffentlicht am 11. Januar 2012, Anmelder: Hebei Hua Chem Group Co. Ltd., Erfinder: Q. Ren, J. Ge, G. Zhang, F. Zhang, S. Wang, X. Fan.
- K. Ramig, Y. Dong, S.D. Van Arnum: A convenient preparation of cyclobutyl ketones: Naphthalene-catalyzed reductive cyclization of substituted 1,4-dihalobutanes. In: Tetrahedron Lett. Band 37, Nr. 4, 1996, S. 443–446, doi:10.1016/0040-4039(95)02194-9.
- J.-W. Gao: Lithium Naphthalenide. In: Synlett. Band 23, 2012, S. 317–318, doi:10.1055/s-0031-1290127.
- Patent US4837335: Process for the preparation of pure 1-phenyl-3-carbalkoxy-5-hydroxypyrazoles. Angemeldet am 4. April 1988, veröffentlicht am 6. Juni 1989, Anmelder: Chemie Linz G.m.b.H, Erfinder: H. Stückler, W. Dobramysl.
- J.H. Ziegler, M. Locher: Ueber die Tartrazine, eine neue Klasse von Farbstoffen. In: Ber. Dtsch. Chem. Ges. Band 20, Nr. 1, 1887, S. 834–840, doi:10.1002/cber.188702001188.
- Patent US2457823: Production of pyrazolone azo dyes. Angemeldet am 29. November 1945, veröffentlicht am 4. Januar 1949, Anmelder: Ilford Ltd., Erfinder: J.D. Kendall, D.J. Fry.