Dabrafenib
Dabrafenib (Handelsname: Tafinlar; Hersteller: Novartis) ist ein Arzneistoff aus der Gruppe der Proteinkinaseinhibitoren, resp. der MAP-Kinase-Inhibitoren, der die Funktion des Proteins BRAF hemmt.[5] Dabrafenib wird bei erwachsenen Patienten zur Behandlung des nichtkleinzelligen Bronchialkarzinoms (NSCLC) und des malignen Melanoms angewendet, wenn diese Tumoren eine Mutation im BRAF-Gen aufweisen und nicht mehr mittels Operation vollständig entfernt werden können.[6]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Dabrafenib | |||||||||||||||||||||
| Andere Namen |
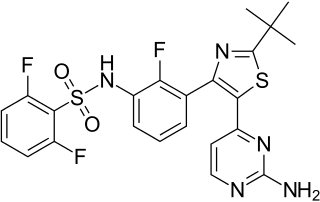
N-{3-[5-(2-Amino-4-pyrimidinyl)-2-(2-methyl-2-propanyl)-1,3-thiazol-4-yl]-2-fluorphenyl}-2,6-difluorbenzolsulfonamid | |||||||||||||||||||||
| Summenformel | C23H20F3N5O2S2 | |||||||||||||||||||||
| Kurzbeschreibung |
weiß bis leicht gefärbter Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
L01XE23 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
hemmt die BRAF-Kinase | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 519,56 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,443 g·cm−3[2] | |||||||||||||||||||||
| Löslichkeit |
Löslich in DMSO (30 mg/ml bei 25 °C), Wasser (<1 mg/ml bei 25 °C), Ethanol (<1 mg/ml bei 25 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften
BRAF ist ein Vertreter der RAF-Familie, die zu den Serin/Threonin-Proteinkinasen gehört.[7] RAF-Proteine spielen eine entscheidende Rolle im MAP-Kinase-Weg, z. B. bei der Regulation der Embryogenese, der Zelldifferenzierung, des Zellwachstums und des programmierten Zelltodes. Da BRAF über den MAP-Kinase-Weg Transkriptionsfaktoren für Zellwachstum und Proliferation reguliert, agiert es häufig auch als Onkogen.[8] Gerade im malignen Melanom finden sich in circa 50 bis 60 % der Patienten BRAF-Mutationen, meist an der Aminosäureposition 600, welche die Phosphorylierung der BRAF-Kinasedomäne simulieren und so den MAP-Kinase-Weg konstitutiv aktiveren.[9] Jedoch auch bei anderen Krebserkrankungen – wie z. B. bei ca. 3 % der nichtkleinzelligen Bronchialkarzinome – treten aktivierende BRAF-Mutationen auf.[10] Dabrafenib wirkt als Kinaseinhibitor, der die Signalleitung des mutierten BRAF-Proteins hemmt und somit das Wachstum der mutierten Zellen einschränken kann.[8][9]
Entwicklung und Vermarktung
Der Arzneistoff Dabrafenib wurde vom Pharmaunternehmen GlaxoSmithKline im Jahr 2009 geschützt und wird seit dem Verkauf der Onkologiesparte 2015 an Novartis durch letztere vertrieben.[11] Unter dem Namen Tafinlar wurde Dabrafenib zur oralen Behandlung (Kapseln) von erwachsenen Patienten mit nicht resezierbarem oder metastasiertem Melanom mit BRAF-V600E-Mutationen von der Food and Drug Administration im Mai 2013 für den US-Markt und von der Europäischen Kommission im August 2013 EU-weit zugelassen.[12] Die Kombination von Dabrafenib mit dem MEK-Inhibitor Trametinib[13][14] wurde erstmals in den USA im Januar 2014[15] und in der EU im September 2015[16] zugelassen. Im April 2017 wurde die EU-Zulassung der Kombination von Dabrafenib mit Trametinib um die Behandlung von erwachsenen Patienten mit fortgeschrittenen nichtkleinzelligen Bronchialkarzinomen mit BRAF-V600E-Mutationen erweitert.
Synthese
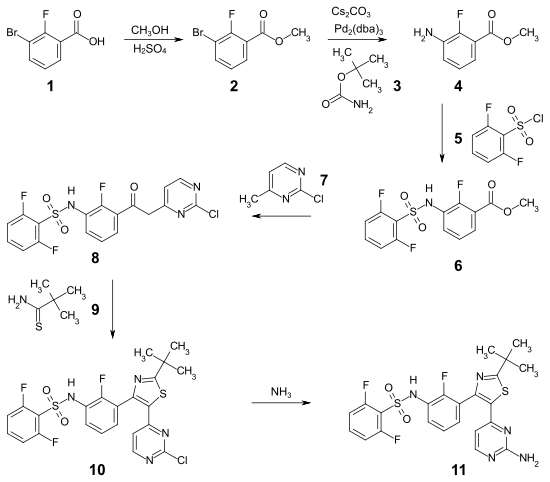
Bei der Synthese von Dabrafenib handelt es sich um eine sechsstufige Reaktion.[17] Im ersten Schritt wird 3-Brom-2-fluorbenzoesäure 1 mit Methanol säurekatalysiert verestert. Der 3-Brom-2-methylbenzoesäuremethylester 2 reagiert mit tert-Butylcarbamat 3 in Gegenwart der Komplexverbindung von Palladium mit Dibenzylidenaceton (Pd2(dba)3) und Cs2CO3 im Sinne einer Buchwald-Hartwig-Kupplung zu dem 3-Amino-2-methylbenzoesäuremethylester 4. Die Umsetzung von 4 mit 2,6-Difluorbenzolsulfonylchlorid 5 ergibt das Sulfonamid 6, das mit 2-Chlor-4-methylpyrimidin 7 in Gegenwart von LHMDS zur Zwischenstufe 8 reagiert. Das N-[3-[2-(2-Chlor-4-pyrimidinyl)acetyl],2-fluorphenyl]-2,6-difluor-benzolsulfonamid 8 cyclisiert mit 2,2-Dimethylpropanthioamid 9 in Gegenwart von NBS zu dem Thiazol 10. Abschließend wird mit Ammoniak in Methanol die Aminogruppe zum Endprodukt 11 eingeführt.
Pharmakologie
Wirkmechanismus
Dabrafenib führt als Inhibitor der BRaf-Kinase zu einer verminderten Aktivierung der MEK1/2, die unter physiologischen Bedingungen durch die Raf-Kinase phosphoryliert und somit aktiviert wird. Da die MEK1/2 inaktiviert bleibt, ist sie wiederum nicht in der Lage die ERK1/2 (Isoformen von MAP-K) zu phosphorylieren und somit die Kaskade weiter in Gang zu setzen. Dadurch können die Transkriptionsfaktoren nicht mehr durch die MAP-Kinasen phosphoryliert werden und es kommt zum Abbruch der Transkription einer Vielzahl von Zielgenen, was eine hemmende Wirkung auf Zellproliferation, Zellwachstum und Differenzierung ausübt.[18][19]
Dabrafenib inhibiert einige Subgruppen der BRAF-Kinasen mit in vitro gemessenen IC50-Werten von BRAF V600E (0,65),BRAF V600K (0,5) und BRAF V600D (1,84).
Metabolismus
Dabrafenib wird in der Leber über Cytochrom P450 3A4 (CYP3A4) und Cytochrom P450 2C8 metabolisiert. Es entsteht Hydroxy-dabrafenib als Metabolit, welches dann über CYP3A4 oxidiert wird zu Carboxy-dabrafenib. Carboxy-dabrafenib wird entweder biliär oder renal eliminiert oder zu Desmethyl-dabrafenib decarboxyliert, welches dann wieder über den Darm rückresorbiert wird. Desmethyl-dabrafenib wird anschließend über CYP3A4 metabolisiert.[19][20]
Interaktion
Die Wirkung von Dabrafenib kann durch CYP3A4-induzierende Arzneistoffe vermindert werden, da Dabrafenib genau über dieses Enzym metabolisiert wird und seine effektive Konzentration dadurch abnimmt. Zu diesen Arzneistoffen gehören z. B. Carbamazepin, Phenobarbital oder Phenytoin. Ein erhöhter Spiegel von Dabrafenib könnte durch Arzneistoffe zu Stande kommen, die eine inhibierende Wirkung auf die CYP3A4/CYP2C8-Verstoffwechslung haben. Beispiele dafür wären: Clarithromycin, Gemfibrozil (CYP2C8-Inhibitor), Ketoconazol.[19]
Nebenwirkungen
Zu den Nebenwirkung gehören die Hyperkeratose, Pyrexie, Kopfschmerzen, Schwindel, Arthralgie, Haarausfall, Papillom und Hand-Fuß-Syndrom.[21]
Klinische Studie
In einer Phase-3-Studie wurden Patienten mit fortgeschrittenem metastasierten Melanom und nachgewiesener BRAF-V600-Mutation mit Dabrafenib bzw. Dacarbazin, welches bei dieser Erkrankung als Standardtherapie eingesetzt wurde, behandelt.[21] Dabei hat sich herausgestellt, dass bei der Behandlung mit Dabrafenib die Krankheitsprogression um 70 % im Vergleich zu der Standardtherapie mit Dacarbazin verringert wurde.[22] Die progressionsfreie Überlebensrate (PFS) betrug bei Dabrafenib 5,1 Monate und bei Dacarbazin 2,7 Monate. Die Gesamtansprechrate betrug 50 % unter Dabrafenib und bei Dacarbazin 6 %.[23]
Frühe Nutzenbewertung nach § 35a SGB V
Für Erwachsene mit BRAF-V600-Mutation-positivem, nicht resezierbarem oder metastasiertem Melanom sah das IQWiG Ende 2013 bzw. Anfang 2014 wegen nur geringer positiver Effekte und mangelnder Aussagekraft der Studiendaten zu möglichen negativen Effekten einen Zusatznutzen von Dabrafenib als Monotherapie im Vergleich zur zweckmäßigen Vergleichstherapie Dacarbazin als nicht belegt an.[24][25] Der Gemeinsame Bundesausschuss (G-BA) schloss sich der Bewertung an. Eine zunächst festgelegte Befristung seines Beschlusses hob er 2016 auf.[26]
Für die Kombination mit Trametinib sah das IQWiG in derselben Indikation bei Frauen ein Hinweis auf einen erheblichen Zusatznutzen und für Männer ein Hinweis auf einen beträchtlichen Zusatznutzen.[27][28] Der G-BA verzichtete auf die Differenzierung nach dem Geschlecht und sprach der Kombination insgesamt einen Hinweis auf einen beträchtlichen Zusatznutzen zu.[29]
In seiner Bewertung der Wirkstoffkombination zur adjuvanten Behandlung von Erwachsenen mit einem Melanom im Stadium III mit nachgewiesener BRAF-V600-Mutation nach vollständiger Resektion mit Metastasektomie erkannte das IQWiG einen Hinweis auf einen beträchtlichen Zusatznutzen.[30] Der G-BA schloss sich dem in seinem Beschluss an.[31][32]
Bei seiner Bewertung von Dabrafenib in Kombination mit Trametinib zur Behandlung Erwachsener mit fortgeschrittenem nichtkleinzelligem Bronchialkarzinom mit einer BRAF-V600-Mutation kam das IQWiG 2017 zu dem Schluss, dass mangels geeigneter Studiendaten ein Zusatznutzen gegenüber der jeweiligen zweckmäßigen Vergleichstherapie weder in der Erstlinie noch für vorbehandelte Patienten belegt ist.[33] Der G-BA schloss sich dem Bewertungsergebnis an.[34]
Toxikologie
Dabrafenib hat sich in vitro an Bakterien und Säugerzellkulturen sowie in vivo im Mikronukleus-Test bei Nagetieren als nicht mutagen oder klastogen erwiesen. Karzinogenitätsstudien mit Dabrafenib wurden nicht durchgeführt.
In kombinierten Studien zur weiblichen Fertilität sowie zur frühen embryonalen und embryofetalen Entwicklung an Ratten war die Zahl der Corpora lutea in den Ovarien trächtiger Weibchen bei 300 mg/kg/Tag (entspricht, bezogen auf die AUC, ungefähr der dreifachen klinischen Exposition beim Menschen) verringert, Auswirkungen auf den Zyklus, das Paarungsverhalten oder die Fertilität konnten jedoch nicht festgestellt werden. Entwicklungstoxische Erscheinungen, z. B. Embryonensterblichkeit und Ventrikelseptumdefekte, wurden bei Dosen von 300 mg/kg/Tag, verzögerte Skelettentwicklung und reduziertes Fetalgewicht ab Dosen von 20 mg/kg/Tag (entspricht, bezogen auf die AUC, dem mehr als 0,5-fachen der klinischen Exposition beim Menschen) beobachtet. Studien zur männlichen Fertilität unter Dabrafenib wurden nicht durchgeführt. In Studien mit wiederholter Verabreichung wurde bei der Ratte und beim Hund allerdings eine Hodendegeneration/-atrophie beobachtet (bei Dosen, die, bezogen auf die AUC, dem mehr als 0,2-fachen der klinischen Exposition beim Menschen entsprechen). Die testikulären Veränderungen bei der Ratte und beim Hund waren auch nach einer vierwöchigen Erholungsphase noch vorhanden.
Literatur
- Ernst Mutschler et al.: Mutschler – Arzneimittelwirkungen Lehrbuch der Pharmakologie und Toxikologie. 10. Auflage. Wissenschaftl. Verlagsgesellschaft, Stuttgart 2012, ISBN 3-8047-2898-7.
Einzelnachweise
- European Medicines Agency: Dabrafenib Public Assessment Report (PDF).
- Eintrag zu Dabrafenib bei ChemBlink, abgerufen am 10. Februar 2014.
- Datenblatt scbio.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von N-[3-[5-(2-aminopyrimidin-4-yl)-2-tert-butyl-1,3-thiazol-4-yl]-2-fluorophenyl]-2,6-difluorobenzenesulfonamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 19. Oktober 2021.
- T. Huang, M. Karsy, J. Zhuge, M. Zhong, D. Liu: B-Raf and the inhibitors: from bench to bedside. In: Journal of Hematology & Oncology. Band 6, 2013, S. 30, doi:10.1186/1756-8722-6-30. PMID 23617957, PMC 3646677 (freier Volltext).
- Dabrafenib (Tafinlar) bei schwarzem Hautkrebs, auf www.gesundheitsinformation.de, abgerufen am 6. August 2018.
- M. M. Machnicki, T. Stoklosa: BRAF – A new player in hematological neoplasms. In: Blood cells, molecules & diseases. [elektronische Veröffentlichung vor dem Druck] Februar 2014, doi:10.1016/j.bcmd.2014.01.001. PMID 24495477.
- S. McGettigan: Dabrafenib: A New Therapy for Use in BRAF-Mutated Metastatic Melanoma. In: Journal of the advanced practitioner in oncology. Band 5, Nummer 3, Mai 2014, S. 211–215. PMID 25089220, PMC 4114496 (freier Volltext) (Review).
- J. J. Luke, P. A. Ott: New developments in the treatment of metastatic melanoma – role of dabrafenib-trametinib combination therapy. In: Drug, healthcare and patient safety. Band 6, 2014, S. 77–88, doi:10.2147/DHPS.S39568. PMID 25018652, PMC 4075957 (freier Volltext) (Review).
- Dong Chen, Li-Qun Zhang, Jun-Fu Huang, Kai Liu, Zheng-Ran Chuai: BRAF mutations in patients with non-small cell lung cancer: a systematic review and meta-analysis. In: PloS One. Band 9, Nr. 6, 30. Juni 2014, doi:10.1371/journal.pone.0101354, PMID 24979348, PMC 4076330 (freier Volltext).
- Novartis gibt Abschluss von Transaktionen mit GSK bekannt. Novartis, 2. März 2015, archiviert vom Original am 1. Mai 2016; abgerufen am 2. Mai 2016.
- Tafinlar-dabrafenib, European public assessment report (EPAR), abgerufen am 28. April 2014.
- A. J. King, M. R. Arnone, M. R. Bleam, K. G. Moss, J. Yang, K. E. Fedorowicz, K. N. Smitheman, J. A. Erhardt, A. Hughes-Earle, L. S. Kane-Carson, R. H. Sinnamon, H. Qi, T. R. Rheault, D. E. Uehling, S. G. Laquerre: Dabrafenib; preclinical characterization, increased efficacy when combined with trametinib, while BRAF/MEK tool combination reduced skin lesions. In: PLoS ONE. Band 8, Nummer 7, 2013, S. e67583, doi:10.1371/journal.pone.0067583. PMID 23844038, PMC 3701070 (freier Volltext).
- A. K. Salama, K. B. Kim: Trametinib (GSK1120212) in the treatment of melanoma. In: Expert Opinion on Pharmacotherapy. Band 14, Nummer 5, April 2013, S. 619–627, doi:10.1517/14656566.2013.770475. PMID 23432625.
- Silas Inman: Dabrafenib/Trametinib Combination Approved for Advanced Melanoma, OncLive, 9. Januar 2014.
- Novartis receives EU approval for Tafinlar® and Mekinist®, first combination approved for patients with aggressive form of melanoma (Memento vom 22. Dezember 2015 im Internet Archive), Pressemitteilung Novartis vom 1. September 2015.
- Tara R. Rheault, John C. Stellwagen, George M. Adjabeng: Discovery of Dabrafenib: A Selective Inhibitor of Raf Kinases with Antitumor Activity against B-Raf-Driven Tumors. In: American Chemical Society Med. Chem. Lett. 4, Nr. 3, 2013, S. 358–362, doi:10.1021/ml4000063.
- Summary Basis of Decision (SBD): Tafinlar – 2013 – Health Canada (Memento vom 8. Februar 2014 im Internet Archive)
- Eintrag zu Dabrafenib in der DrugBank der University of Alberta, abgerufen am 18. November 2019.
- Patent
- Tafinlar-Zusammenfassung
- Tafinlar (Dabrafenib). (PDF) In: Neue Arzneimittel. Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ), 22. Januar 2014, S. 4, abgerufen am 5. Januar 2022.
- A. Hauschild, J. J. Grob, L. V. Demidov, T. Jouary, R. Gutzmer, M. Millward, P. Rutkowski, C. U. Blank, W. H. Miller, E. Kaempgen, S. Martín-Algarra, B. Karaszewska, C. Mauch, V. Chiarion-Sileni, A. M. Martin, S. Swann, P. Haney, B. Mirakhur, M. E. Guckert, V. Goodman, P. B. Chapman: Dabrafenib in BRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. In: Lancet. Band 380, Nummer 9839, Juli 2012, S. 358–365, doi:10.1016/S0140-6736(12)60868-X. PMID 22735384.
- A13-35 Dabrafenib – Nutzenbewertung gemäß § 35a SGB V, abgerufen am 8. Juli 2019.
- A14-10 Addendum zum Auftrag A13-35 (Dabrafenib) – Nutzenbewertung gemäß § 35a SGB V, abgerufen am 8. Juli 2019.
- – Beschlüsse des Gemeinsamen Bundesausschusses vom 3. April 2014 und vom 16. Juni 2016 zum Nutzenbewertungsverfahren zum Wirkstoff Dabrafenib, abgerufen am 7. Juli 2019.
- A15-39 Dabrafenib (Melanom) – Nutzenbewertung gemäß § 35a SGB V, abgerufen am 8. Juli 2019.
- A16-05 Dabrafenib/Trametinib – Addendum zum Auftrag A15-39 und A15-40, abgerufen am 8. Juli 2019.
- Beschluss des Gemeinsamen Bundesausschusses vom 17.03.2016 zum Nutzenbewertungsverfahren zum Wirkstoff Dabrafenib (neues Anwendungsgebiet: Melanom in Kombination mit Trametinib), abgerufen am 8. Juli 2019.
- A18-59 Dabrafenib (Melanom) – Nutzenbewertung gemäß § 35a SGB V, abgerufen am 8. Juli 2019.
- Beschluss des Gemeinsamen Bundesausschusses vom 22.03.2019 zum Nutzenbewertungsverfahren zum Wirkstoff Dabrafenib (neues Anwendungsgebiet: Melanom, in Kombination mit Trametinib, BRAF-V600-Mutation, adjuvante Therapie), abgerufen am 8. Juli 2019.
- Vgl. auch Patrick Terheyden, Angela Krackhardt, Thomas Eigentler: Systemtherapie des Melanoms. Einsatz von Immuncheckpoint-Inhibitoren und Hemmung von intrazellulärer Signaltransduktion. In: Deutsches Ärzteblatt. Band 116, Heft 29 f., (22. Juli) 2019, S. 497–504, insbesondere S. 504.
- A17-17 Dabrafenib (nicht kleinzelliges Lungenkarzinom) – Nutzenbewertung gemäß § 35a SGB V, abgerufen am 6. September 2018.
- Beschluss des Gemeinsamen Bundesausschusses vom 19. Oktober 2017 über eine Änderung der Arzneimittel-Richtlinie (AM-RL): Anlage XII – Dabrafenib (neues Anwendungsgebiet: nicht-kleinzelliges Lungenkarzinom), abgerufen am 6. September 2018.