Cycloocten
Cycloocten ist eine chemische Verbindung aus der Gruppe der ungesättigten, cyclischen Kohlenwasserstoffe (genauer der Cycloalkene).
| Strukturformel | |||||||||
|---|---|---|---|---|---|---|---|---|---|
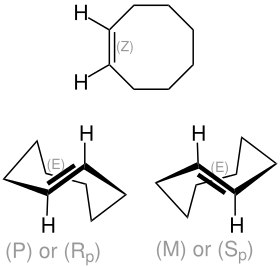 | |||||||||
| (Z)-Cycloocten (oben) und die beiden enantiomeren (E)-Cyclooctene (unten): (P)-Cycloocten und (M)-Cycloocten | |||||||||
| Allgemeines | |||||||||
| Name | Cycloocten | ||||||||
| Andere Namen |
COE | ||||||||
| Summenformel | C8H14 | ||||||||
| Kurzbeschreibung |
entzündliche, farblose, charakteristisch riechende Flüssigkeiten[1][2] | ||||||||
| Externe Identifikatoren/Datenbanken | |||||||||
| |||||||||
| Eigenschaften | |||||||||
| Molare Masse | 110,20 g·mol−1 | ||||||||
| Aggregatzustand |
flüssig | ||||||||
| Dichte |
0,85 g·cm−3[2] | ||||||||
| Schmelzpunkt | |||||||||
| Siedepunkt |
148 °C[2] | ||||||||
| Dampfdruck | |||||||||
| Brechungsindex |
1,469 (20 °C)[3] | ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||
Gewinnung und Darstellung
(Z)-Cycloocten wird in guter Ausbeute durch Hydrierung von Cyclooctatetraen oder durch Cope-Eliminierung von N,N-Dimethylcyclooctylaminoxid erhalten. Das Racemat aus (E)-(+)-Cycloocten und (E)-(–)-Cycloocten entsteht (neben (Z)-Cycloocten) durch Pyrolyse von N,N,N-Trimethylcyclooctylammoniumhydroxid.[4]
Ein sehr eleganter Weg zur Synthese von (E)-Cycloocten ist eine Corey-Winter-Eliminierung ausgehend von (E)-1,2-Cyclooctandiol:[5]
-Cyclooctene_Synthesis.png.webp)
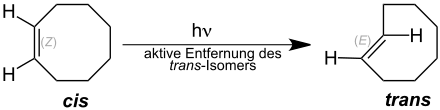
(E)-Cycloocten kann auch durch eine photochemischen Isomerisierung aus (Z)-Cycloocten erhalten werden. Obwohl das Gleichgewicht hier auf der Seite des (Z)-Cycloocten liegt, kann die Reaktion durch Entfernen des (E)-Isomers durch Komplexierung mit Silber zur Vollständigkeit getrieben werden.[6]
Technisch wird es durch selektive Hydrierung des 1,5-Cyclooctadiens herstellt, das nach einem Verfahren von Wilke durch Dimerisierung von 1,3-Butadien zugänglich ist.
Eigenschaften
Von Cycloocten gibt es drei Isomere: (Z)-Cycloocten, (pR)-(E)-Cycloocten, (pS)-(E)-Cycloocten. Die Ringgröße in Cycloocten erlaubt es gerade noch, dass die Doppelbindung sowohl (E)- als auch (Z)-konfiguriert sein kann. (E)-Cycloocten ist aufgrund der fehlenden Drehspiegelachse optisch aktiv, also chiral. Das p vor den R/S-Deskriptoren deutet dabei an, dass es sich um eine planare Chiralität handelt. Die Isomerisierungsreaktion kann unter Verwendung eines Photosensibilisators enantiodifferenzierend durchgeführt werden, das heißt, man erhält ein Enantiomer des E-Isomers von Cycloocten im Überschuss.
Verwendung
Durch ringöffnende Polymerisation von (Z)-Cycloocten wird Polyoctenamer erhalten, das als Komponente in Elastomeren verwendet wird. Die Ozonolyse des Alkens ergibt Octandisäure (Korksäure, Suberinsäure), die zur Herstellung von Weichmachern oder Polyamiden dient. Die Thermolyse von (Z)-Cycloocten liefert Octa-1,7-dien, das als Monomer in der Kautschuk- und Kunststoffindustrie Verwendung findet. Über mehrere weitere Zwischenschritte dient es auch der Herstellung von verschiedenen Duftstoffen.
(Z)-Cycloocten ist ein beliebtes Substrat für Epoxidierungen. Diese laufen in der Regel sehr selektiv ab, weil die energetisch günstigste Konformation von (Z)-Cycloocten die Bildung von allylischen Nebenprodukten deutlich erschwert.[7]
(E)-Cyclooctenderivate finden Verwendung als Dienophile in der bioorthogonalen Tetrazin-Ligation.
Sicherheitshinweise
Die Dämpfe von Cycloocten können mit Luft beim Erhitzen über seinen Flammpunkt (24 °C) ein explosionsfähiges Gemisch bilden. Dies ist bereits bei erhöhter Umgebungstemperatur möglich.[2]
Literatur
- Arthur C. Cope, Robert D. Bach: Cyclooctene In: Organic Syntheses. 49, 1969, S. 39, doi:10.15227/orgsyn.049.0039; Coll. Vol. 5, 1973, S. 315 (PDF).
Einzelnachweise
- Datenblatt cis-Cyclooctene bei Acros, abgerufen am 12. Februar 2010.
- Eintrag zu Cycloocten in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Datenblatt Cyclooctene bei Sigma-Aldrich, abgerufen am 15. Mai 2017 (PDF).
- Louis Fieser, Mary Fieser: Organische Chemie, Verlag Chemie Weinheim, 1982.
- Siegfried Hauptmann, Jürgen Graefe, Horst Remane: Organische Chemie, 1. Auflage 1976, Deutscher Verlag für Grundstoffindustrie, Leipzig, (2. neu überarbeitete Auflage 1980, 3. Auflage 1991, Wiley-VCH) ISBN 3-527-30925-X.
- Maksim Royzen, Glenn P. A. Yap, and Joseph M. Fox: A Photochemical Synthesis of Functionalized trans-Cyclooctenes Driven by Metal Complexation. In: J. AM. CHEM. SOC. 2008, 130, 3760–3761, doi:10.1021/ja8001919.
- Ulrich Neuenschwander, Ive Hermans: The Conformations of Cyclooctene: Consequences for Epoxidation Chemistry. In: The Journal of Organic Chemistry. 76, 2011, S. 10236–10240, doi:10.1021/jo202176j.


