Bis(trimethylsilyl)peroxid
Bis(trimethylsilyl)peroxid ist ein Derivat des Wasserstoffperoxids H2O2, bei dem beide Wasserstoffatome durch Trimethylsilylgruppen (TMS-Gruppen) ersetzt sind. Die Verbindung stellt somit eine 100%ige, wasserfreie und TMS-geschützte Form von H2O2 dar. BTMSPO findet Verwendung zur Oxidation von Alkoholen, Ketonen, Phosphinen, Phosphiten und Sulfiden und für elektrophile Hydroxylierungen.[2]
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
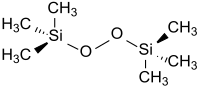 | ||||||||||
| Allgemeines | ||||||||||
| Name | Bis(trimethylsilyl)peroxid | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C6H18O2Si2 | |||||||||
| Kurzbeschreibung | ||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 178,38 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte | ||||||||||
| Siedepunkt | ||||||||||
| Löslichkeit |
löslich in allen gängigen organischen Lösungsmitteln[1] | |||||||||
| Brechungsindex | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Herstellung
Die Herstellung von Bis(trimethylsilyl)peroxid (hier Hexamethyl-disilylperoxyd genannt) wurde 1956 beschrieben[4], wobei eine Lösung von 85%igem[7] oder wasserfreiem[4][6] Wasserstoffperoxid in Diethylether mit Pyridin und Chlortrimethylsilan in 43%iger Ausbeute zu BTSP umgesetzt wurde.
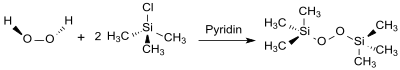
Von der Verwendung von nicht stabilisiertem, hochkonzentriertem Wasserstoffperoxid, das besonders bei Anwesenheit von Schwermetallionen zu spontanen Explosionen neigt, sollte abgesehen werden.
Modernere Synthesen von Bis(trimethylsilyl)peroxid gehen aus von möglichst wasserfreien und festen Wasserstoffperoxid-Addukten, die mit einem Silylierungsmittel, wie z. B. Trimethylchlorsilan TMS-Cl, Hexamethyldisilazan HMDS oder Bis(trimethylsilyl)harnstoff BSU zur Reaktion gebracht werden. Eine Organic Syntheses-Vorschrift[1] beruht auf einer älteren Prozessbeschreibung[8] (mit einer Ausbeute von 35 %) und liefert nach einem umständlichen Verfahren mit dem teuren Ausgangsstoff DABCO 1,4-Diazabicyclo[2.2.2]octan und dem instabilen (und in Gegenwart von Übergangsmetallen zu heftigen Explosionen neigenden) DABCO-H2O2-Addukt[5] ein mit Hexamethyldisiloxan verunreinigtes Produkt in maximaler Gesamtausbeute von 45 %.
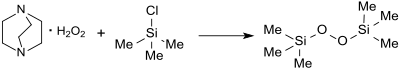
Zur Herstellung größerer Mengen eignet sich ein Verfahren,[5] bei dem Bis(trimethylsilyl)harnstoff BSU mit gepulvertem Carbamidperoxid (Harnstoff-Wasserstoffperoxid-Addukt) nach zweimaliger Destillation BTSP in 86%iger Reinausbeute ergibt.
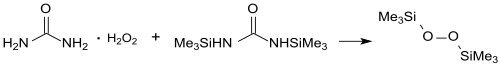
Allerdings benötigt diese Synthese das im Vergleich zu Trimethylchlorsilan deutlich teurere Hexamethyldisilazan (zur Herstellung von BSU) und soll bezüglich Reaktionsdauer und Rohstoffkosten einem neueren Prozess unterlegen sein, bei dem der Wasserstoffperoxid-Urotropin-Komplex (in quantitativer Ausbeute aus Hexamethylentetramin und 30%igem H2O2) mit TMS-Cl zu BSTP in einer Rohausbeute von 80 % reagiert.[9]
Eigenschaften
Bis(trimethylsilyl)peroxid ist eine farblose ölige Flüssigkeit mit stechendem Geruch, die sich mit vielen organischen Lösungsmitteln mischt.[2] Die Verbindung ist wesentlich stabiler als hochkonzentriertes Wasserstoffperoxid und kann in reiner Form gehandhabt und destilliert werden.[9] Da mehrfach explosionsartiger Zerfall bei Kontakt mit Metallen bei der Herstellung nach der Pyridin-[7] und DABCO-Methode[5] berichtet wurde, sollte BTSP mit entsprechender Vorsicht behandelt werden.[1]
Anwendungen
Bis(trimethylsilyl)peroxid ist nach Arbeiten von Dietmar Brandes ein schonendes und vielseitiges Oxidationsmittel,[10] das z. B. Thioether zu Sulfonen, Phosphine zu Phosphinoxiden und Phosphite zu Phosphaten oxidiert.[11]
Die oxidative Abspaltung der Sulfongruppe R1-SO2-R2 (Desulfonierung) erfolgt mit BTSP unter schonenden Bedingungen mit hohen Ausbeuten.[12]
Mit Schwefeldioxid SO2 bildet Bis(trimethylsilyl)peroxid in quantitativer Ausbeute Bis(trimethylsilyl)sulfat, während es mit Schwefeltrioxid SO3 im Molverhältnis 1:1 zum bei 20 °C instabilen Bis(trimethylsilyl)peroxomonosulfat, dem Trimethylsilylether der Caroschen Säure und im Molverhältnis 1:2 zum ebenfalls instabilen Bis(trimethylsilyl)peroxodisulfat reagiert.[6][11]
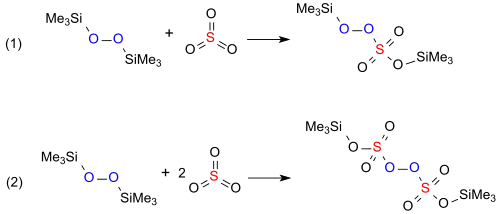
Das im Gegensatz zur Caroschen Säure in organischen Lösungsmitteln lösliche Bis(trimethylsilyl)peroxomonosulfat liefert bei der Baeyer-Villiger-Oxidation von Ketonen bessere Ausbeuten als Peroxomonoschwefelsäure.[13]
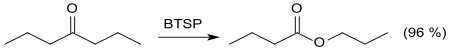
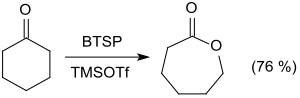
In Gegenwart katalytischer Mengen von Trimethylsilyltrifluormethansulfonat TMSOTf gelingen auch schwierigere Oxidationen wie z. B. von Cyclohexanon zu ε-Caprolacton in guter Ausbeute (76 %).[14]
Eine weitere Verbesserung bietet die Verwendung ionischer Flüssigkeiten als Lösungsmittel und Katalysatoren, wie z. B. 1-Butyl-3-methyl-imidazolium-trifluormethylsulfonat BMIM-OTf,[15] wobei bei Zusatz von Natriumtrifluormethansulfonat ε-Caprolacton aus Cyclohexanon in 94%iger Ausbeute anfällt.
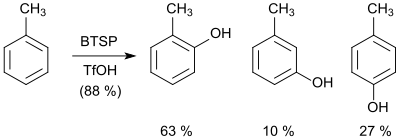
Im Arbeitskreis von George A. Olah wurde die elektrophile Hydroxylierung von Aromaten mit Bis(trimethylsilyl)peroxid bearbeitet. In Gegenwart von Trifluormethansulfonsäure wird Mesitylen mit 94%iger Ausbeute in das entsprechende Phenol umgesetzt und Toluol in 88%iger Ausbeute in die Methylphenole mit der Isomerenverteilung ortho: 63 %, meta: 10 % und para: 27 %.[16]
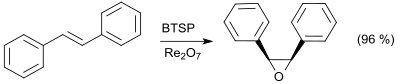
Barry Sharpless und Mitarbeiter entwickelten eine Methode zur Epoxidierung von Olefinen mit Bis(trimethylsilyl)peroxid und Rhenium-Katalysatoren in Dichlormethan,[17] die der Reaktion mit Methylrheniumtrioxid CH3ReO3 (MTO) und wässrigem Wasserstoffperoxid deutlich überlegen ist. Mit wesentlich preisgünstigeren Rheniumverbindungen, wie z. B. Rhenium(VII)-oxid Re2O7 und in Gegenwart von Spuren von Wasser oder Methanol lassen sich Epoxidausbeuten von über 90 % erzielen.[18]
Einzelnachweise
- P. Dembech, A. Ricci, G. Seconi, M. Taddei: Bis(trimethylsilyl) peroxide (BTMSPO) In: Organic Syntheses. 74, 1997, S. 84, doi:10.15227/orgsyn.074.0084; Coll. Vol. 9, 1998, S. 91 (PDF).
- J.R. Hwu, B.-L. Chen: Bis(trimethylsilyl)peroxide. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rb219.
- Oakwood: , abgerufen am 27. Dezember 2019
- W. Hahn, L. Metzinger: Organosiliciumperoxyde als Initiatoren. In: Makromol. Chem. Band 21, 1956, S. 113–120, doi:10.1002/macp.1956.020210109.
- W.P. Jackson: A simple preparation of Bis(trimethylsilyl) peroxide. In: Synlett. Band 9, 1990, S. 536, doi:10.1055/s-1990-21157.
- B. Bressel, A. Blaschette: Über Peroxyverbindungen. VIII. Darstellung und Eigenschaften von Bis-(trimethylsilyl)-peroxomonosulfat und Bis-(trimethylsilyl)-peroxodisulfat. In: Z. anorg. allg. Chem. Band 377, Nr. 2, 1970, S. 182–195, doi:10.1002/zaac.19703770211.
- H. Neumann, D. Seebach: Brom/Lithium‐Austausch an Vinylbromiden mit 2 Moläquiv. tert‐Butyllithium. Umsetzungen von Vinyllithiumverbindungen mit Hetero‐ und Kohlenstoff‐Elektrophilen. In: Chem. Ber. Band 111, Nr. 8, 1978, S. 2785–2812, doi:10.1002/cber.19781110807.
- P.G. Cookson, A.G. Davies, N. Fazal: The 1,4-diaza[2.2.2]bicyclooctane-hydrogen peroxide complex as a source of anhydrous hydrogen peroxide: The preparation of bis(trimethylsilyl)peroxides. In: J. Organomet. Chem. Band 99, Nr. 2, 1975, S. C31–C32, doi:10.1016/S0022-328X(00)88466-1.
- P. Babin, B. Bennetau, J. Dunoguès: A new practical preparation of bis(trimethylsilyl)peroxide. In: Synth. Commun. Band 22, Nr. 19, 1992, S. 2849–2852, doi:10.1080/00397919208021551.
- D. Brandes, A. Blaschette: Über Peroxoverbindungen. XI. Nichtradikalische Substitutions- und Redoxreaktionen des Bis(trimethylsilyl)peroxyds. In: J. Organomet. Chem. Band 49, Nr. 1, 1973, S. C6–C8, doi:10.1016/S0022-328X(00)84917-7.
- D. Brandes, A. Blaschette: Über Peroxoverbindungen. XII. Nichtradikalische Reaktionen des Bis(trimethylsilyl)-peroxids. In: J. Organomet. Chem. Band 73, Nr. 2, 1974, S. 217–227, doi:10.1016/S0022-328X(00)85638-7.
- J.R. Hwu: A novel oxidative desulfonylation. Facile conversion of sulfones to aldehydes and ketones. In: J. Org. Chem. Band 48, Nr. 23, 1983, S. 4432–4433, doi:10.1021/jo00171a067.
- W. Adam, A. Rodriguez: Bis(trimethylsilyl)monoperoxysulfate: Convenient Baeyer-Villiger oxidant. In: J. Org. Chem. Band 44, Nr. 26, 1979, S. 4969–4970, doi:10.1021/jo00394a048.
- M. Suzuki, H. Takada, R. Noyori: Bis(trimethylsilyl)peroxide for the Baeyer-Villiger type oxidation. In: J. Org. Chem. Band 47, Nr. 5, 1982, S. 902–904, doi:10.1021/jo00344a035.
- S. Baj, A. Chrobok, R. Slupska: The Baeyer-Villiger oxidation of ketones with bis(trimethylsilyl) peroxide in the presence of ionic liquids as the solvent and catalyst. In: Green Chem. Band 11, 2009, S. 279–282, doi:10.1039/B814534B.
- G.A. Olah, T.D. Ernst: Oxyfunctionalization of hydrocarbons. 14. Electrophilic hydroxylation of aromatics with bis(trimethylsilyl) peroxide/triflic acid. In: J. Org. Chem. Band 54, Nr. 5, 1989, S. 1204–1206, doi:10.1021/jo00266a041.
- A.K. Yudin, K.B. Sharpless: Bis(trimethylsilyl) peroxide extends the range of oxorhenium catalysts for olefin epoxidation. In: J. Am. Chem. Soc. Band 119, Nr. 47, 1997, S. 11536–11537, doi:10.1021/ja973043x.
- A.K. Yudin, J.P. Chiang, H. Adolfsson, C. Copéret: Olefin epoxidation with bis(trimethylsilyl) peroxide catalyzed by inorganic oxorhenium derivatives. Controlled release of hydrogen peroxide. In: J. Org. Chem. Band 66, Nr. 13, 2001, S. 4713–4718, doi:10.1021/jo010369m.



