Trimethylsilyltrifluormethansulfonat
Trimethylsilyltrifluormethansulfonat ist ein Ester der Trifluormethansulfonsäure (Triflat), der eine Trimethylsilylgruppe aufweist. Seine Reaktivität ähnelt der von Trimethylsilylchlorid und er wird als Reagenz in der organischen Synthese verwendet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
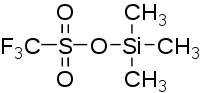 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Trimethylsilyltrifluormethansulfonat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H9F3O3SSi | |||||||||||||||
| Kurzbeschreibung |
farblose bis hellgelbe Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 222,25 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,228 g·cm−3[1] | |||||||||||||||
| Siedepunkt |
77 °C (80 mmHg)[2] | |||||||||||||||
| Brechungsindex |
1,36[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Verwendungsbeispiele
Mittels einer durch Trimethylsilyltriflat katalysierten Kondensation können sieben benzylierte Procyanidintrimere stereoselektiv in sehr hohen Ausbeuten gewonnen werden (Epicatechin-(4β-8)-epicatechin-(4β-8)-epicatechin- (Procyanidin C1), Catechin-(4α-8)-catechin-(4α-8)-catechin- (Procyanidin C2), Epicatechin-(4β-8)-epicatechin-(4β-8)-catechin- und Epicatechin-(4β-8)-catechin-(4α-8)-epicatechin-Trimerderivative. Das Entschützen von (+)-Catechin- und (–)-Epicatechin-Trimerderivaten führt zu vier natürlichen Procyanidintrimeren in guten Ausbeuten.[3]
In der Totalsynthese von Taxol nach Takashi Takahashi wird TMSOTf zur Glycosylierung verwendet.[4]
Literatur
- Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Trimethylsilyl Trifluoromethanesulfonate, abgerufen am 13. September 2017.
Einzelnachweise
- Eintrag Trimethylsilyltrifluormethansulfonat bei Carbolution Chemicals, abgerufen am 2. September 2017.
- Datenblatt Trimethylsilyl trifluoromethanesulfonate bei Sigma-Aldrich, abgerufen am 2. September 2017 (PDF).
- Akiko Saito, Akira Tanaka u. a.: Efficient Stereoselective Synthesis of Proanthocyanidin Trimers with TMSOTf-Catalyzed Intermolecular Condensation. In: Synlett. 2004, S. 1069, doi:10.1055/s-2004-822905.
- Takayuki Doi, Shinichiro Fuse u. a.: A Formal Total Synthesis of Taxol Aided by an Automated Synthesizer. In: Chemistry – An Asian Journal. 1, 2006, S. 370, doi:10.1002/asia.200600156.

