2-Methyl-1-pentanol
2-Methyl-1-pentanol ist ein vollsynthetischer, verzweigter primärer Alkohol mit schwach alkoholartigem Geruch. Er ist als Lösungsmittel von Bedeutung, ein gewisser Teil wird chemisch weiterverarbeitet.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
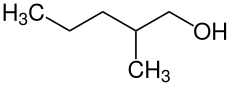 | ||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Methyl-1-pentanol | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H14O | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit schwach alkoholartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 102,18 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,82 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
148 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,4190 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Isomerie
2-Methyl-1-pentanol kommt in zwei enantiomeren Formen vor, da es am C2-Kohlenstoff ein Chiralitätszentrum aufweist. Folglich existieren (R)-2-Methyl-1-pentanol und (S)-2-Methyl-1-pentanol. Ein 1:1 Gemisch der beiden Enantiomere bezeichnet man als Racemat.
-2-Methyl-1-pentanol.svg.png.webp) (R)-2-Methyl-1-pentanol
(R)-2-Methyl-1-pentanol-2-Methyl-1-pentanol.svg.png.webp) (S)-2-Methyl-1-pentanol
(S)-2-Methyl-1-pentanol
Gewinnung und Darstellung
Die technische Herstellung von 2-Methyl-1-pentanol erfolgt durch Aldolkondensation von Propionaldehyd, der zunächst zu 2-Methyl-2-pentenal umgesetzt wird. Nach einer katalytischen Hydrierung erhält man 2-Methyl-1-pentanol.[3]

In den meisten Fällen wird die Aldolkondensation basenkatalysiert durchgeführt.
Eigenschaften
Physikalische Eigenschaften
2-Methyl-1-pentanol hat eine relative Gasdichte von 3,52 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine relative Dichte des Dampf-Luft-Gemisches von 1,00 (Dichteverhältnis zu trockener Luft bei 20 °C und Normaldruck).[1]
Chemische Eigenschaften
2-Methyl-1-pentanol ist eine entzündbare Flüssigkeit aus der Gruppe der primären Alkohole. Er ist schwer löslich in Wasser (8,2 g/l bei 25 °C) und leichter als Wasser. 2-Methyl-1-pentanol ist schwer bzw. sehr schwer flüchtig und weist bei einer Konzentration von 10 g·l−1 und einer Temperatur von 20 °C einen pH-Wert von 7 auf.[1]
Verwendung
2-Methyl-1-pentanol wird als Lösungsmittel und Zwischenprodukt in der chemischen Industrie verwendet. Beispielsweise kann man aus ihm 2-Methylpentylacetat oder Ester, die als Weichmacher Anwendung finden, herstellen.
Sicherheitshinweise
2-Methyl-1-pentanol ist eine entzündbare Flüssigkeit. Die Dämpfe können mit Luft beim Erhitzen des Stoffes über seinen Flammpunkt explosive Gemische bilden. Er wird hauptsächlich durch die Atemwege und die Haut aufgenommen. Bei Aufnahme oder Verschlucken kann es zu starken Reizwirkungen auf Atemwege, Haut und Augen kommen. Zu Reproduktionstoxizität, Mutagenität und Kanzerogenität sind keine Angaben bekannt. 2-Methyl-1-pentanol weist eine untere Explosionsgrenze (UEG) von ca. 1,06 Vol.-% (ca. 45 g/cm3) und eine obere Explosionsgrenze (OEG) von ca. 7,0 Vol.-% (ca. 298 g/cm3) auf. Der Stoff fällt in die Explosionsgruppe IIA. Mit einem Flammpunkt von ca. 46–50 °C gilt 2-Methyl-1-pentanol als entflammbar.[1]
Siehe auch
Weblinks
Einzelnachweise
- Eintrag zu 2-Methyl-1-pentanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5, S. 398 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jürgen Falbe, Helmut Bahrmann, Wolfgang Lipps, Dieter Mayer, Guido D. Frey: Alcohols, Aliphatic. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 15. Januar 2013, doi:10.1002/14356007.a01_279.pub2.

