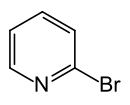
2-Brompyridin
2-Brompyridin ist eine organische Verbindung, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Sie besteht aus einem Pyridinring, der in 2-Position mit Brom substituiert ist.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Brompyridin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H4BrN | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit pyridinartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 158,00 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,62 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
193 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
mäßig in Wasser (20 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Brechungsindex |
1,5734 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung
Im Allgemeinen sind gängige elektrophile aromatische Substitutionen an Pyridin nicht oder nur mit schlechter Ausbeute möglich. Des Weiteren würde Pyridin bevorzugt in 3-Position substituiert und 2-Brompyridin entstünde nur als Nebenprodukt. Die Herstellung von 2-Brompyridin gelingt jedoch durch die Reaktion mit molekularem Brom in Gegenwart katalytischer Mengen Palladium(II)-chlorid.[3]
Verwendung
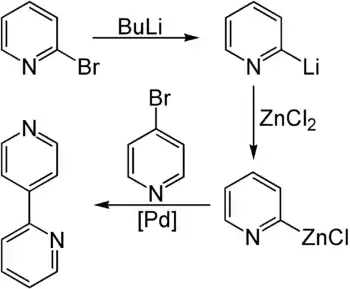
2-Brompyridin und 2-Chlorpyridin können in einer Ullmann-Kupplung, zu der Kupferstaub verwendet wird, zu 2,2′-Bipyridin umgesetzt werden.[4] Auch zur Synthese von 2,4′-Bipyridin kann es benutzt werden. Zusammen mit 4-Brompyridin kann es hierzu in einer Negishi-Kupplung umgesetzt werden. Hierzu wird 2-Brompyridin zunächst mit n-Butyllithium lithiiert und unter Zugabe von Zinkchlorid zum Zinkorganyl transmetalliert. Als Katalysator zur Kupplung dient ein Palladiumkomplex mit Triphenylphosphanliganden.[5]
Durch Lithiierung kann 2-Brompyridin zu einer Organolithium-Verbindung umgesetzt werden, die als Ausgangsverbindung für weitere Pyridinderivate dient, die nicht auf direktem Wege zugängig sind.[3]
Einzelnachweise
- Datenblatt 2-Brompyridin (PDF) bei Merck, abgerufen am 20. März 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-70.
- J. A. Joules, K. Mills: Heterocyclic Chemistry, 2000, 4. Auflage, Blackwell Science, Oxford, ISBN 0-632-05453-0, S. 77–81.
- F. H. Burstall: Researches on the polypyridyls, in: J. Chem. Soc., 1938, S. 1662–1671; doi:10.1039/JR9380001662.
- D. R. Sidler, N. Barta, W. Li, E. Hu, L. Matty, N. Ikemoto, J. S. Campbell, M. Chartrain, K. Gbewonyo, R. Boyd, E. G. Corley, R. G. Ball, R. D. Larsen, P. J. Reider, Paul J: Efficient synthesis of the optically active dihydropyrimidinone of a potent α1A-selective adrenoceptor antagonist. In: Canadian Journal of Chemistry. 80 (6), 2002, S. 646–652, doi:10.1139/v02-079.