Negishi-Kupplung
Die Negishi-Kupplung ist eine Namensreaktion aus der Organischen Chemie. Die Kreuzkupplung dient der Alkenylierung oder Arylierung von Arylen. Hierzu werden Arylhalogenide oder -triflate in einer nickel- oder palladiumkatalysierten Reaktion mit Organozinkverbindungen umgesetzt. Die Reaktion ist verwandt mit der Stille-, Suzuki- und Kumada-Kupplung.[1] Die Reaktion ist benannt nach ihrem Entdecker, dem japanischen Chemiker Ei-ichi Negishi, der sie 1977 publizierte[2] und im Jahre 2010 dafür mit dem Nobelpreis für Chemie ausgezeichnet wurde.
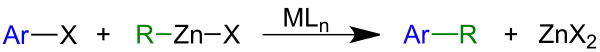

Als Liganden eignen sich Phosphane wie Triphenylphosphan oder dppe sowie die chiralen Chelatliganden wie BINAP oder Chiraphos.
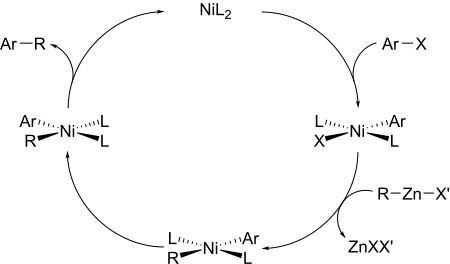
Reaktionsmechanismus
Im ersten Schritt addiert sich das eingesetzte Arylhalogenid oxidativ an den Nickel- oder Palladiumkatalysator. Hierbei ändert sich die Oxidationsstufe des Metalls von 0 auf +2. Der zweite Schritt des Zyklus besteht aus einer Transmetallierung, bei welcher der zu kuppelnde Rest von Zink auf das Katalysatormetall ummetalliert wird. Nach eventueller Isomerisierung des trans- zum cis-Komplex wird das gewünschte Produkt reduktiv eliminiert. Hierbei wird die Katalysatorspezies zurückgebildet.[1]
Anwendungsbereich
Die Negishi-Kupplung wird häufig verwendet, da sie viele funktionelle Gruppen toleriert. Dies liegt an der relativen Reaktionsträgheit der Organozinkverbindungen im Vergleich zu anderen Metallorganylen, die in Kupplungsreaktionen benutzt werden können.
Die benötigten Zinkorganyle können meist aus der entsprechenden Organolithium-Verbindung erhalten werden.
- Transmetallierung von Lithium auf Zink mittels Zinkbromid. Als Nebenprodukt entsteht Lithiumbromid.
Einzelnachweise
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage, S. 706–708, Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9.
- A. O. King, N. Okukado, E.-i. Negishi: Highly general stereo-, regio-, and chemo-selective synthesis of terminal and internal conjugated enynes by the Pd-catalysed reaction of alkynylzinc reagents with alkenyl halides, in: Chem. Comm. 1977, 683; doi:10.1039/C39770000683.