3-Chlorpyridin
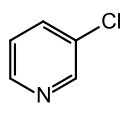
3-Chlorpyridin ist eine organische Verbindung, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Sie besteht aus einem Pyridinring, der in 3-Position mit Chlor substituiert ist. Die Verbindung ist isomer zu 2-Chlorpyridin und 4-Chlorpyridin.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 3-Chlorpyridin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H4ClN | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 113,55 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,21 g·cm−3 (20 °C)[1] | |||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit |
schlecht in Wasser (10 g·l−1 bei 20 °C)[2] | |||||||||||||||
| Brechungsindex |
1,5304 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung
Im Allgemeinen sind gängige elektrophile aromatische Substitutionen an Pyridin nicht oder nur mit schlechter Ausbeute möglich. Die Herstellung von 3-Chlorpyridin gelingt durch Chlorierung mit molekularem Chlor in Gegenwart von Aluminiumchlorid als Katalysator bei 100 °C mit einer mäßigen Ausbeute von 33 %.[4]
Eigenschaften
3-Chlorpyridin bildet oberhalb des Flammpunktes von 66 °C entzündliche Dampf-Luft-Gemische.[1] Die Zündtemperatur beträgt 610 °C.[1] Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
3,3′-Bipyridin kann durch metallvermittelte katalytische Kupplung von zwei Molekülen 3-Chlorpyridin unter Verwendung einer Base hergestellt werden. Als Katalysator dient ein Nickelkomplex.[5][6] Durch Lithiierung kann 3-Chlorpyridin zu einer Organolithium-Verbindung umgesetzt werden, welche als Ausgangsverbindung für weitere Pyridinderivate dient, die nicht auf direktem Wege zugängig sind.[7]
Einzelnachweise
- Eintrag zu 3-Chlorpyridin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- Datenblatt 3-Chlorpyridin (PDF) bei Merck, abgerufen am 5. März 2010.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-112.
- J. A. Joules, K. Mills: Heterocyclic Chemistry 2000, 4. Auflage, Blackwell Science, Oxford, S. 79; ISBN 0-632-05453-0.
- Y. Fort, S. Becker, P. Caubere: A convenient synthetic route to bis-heteroaromatic and bis-heterocyclic compounds promoted by liganded nickel complex reducing agents. In: Tetrahedron 1994, 50, S. 11893–11902, doi:10.1016/S0040-4020(01)89303-0.
- E. Rajalakshmanan, V. Alexander: Synthesis of Dimethylbipyridines by the Reductive Coupling of 2-Halomethylpyridines with Nickel Catalyst, in: Synth. Comm. 2005, 35, S. 891–895; doi:10.1081/SCC-200051056.
- J. A. Joules, K. Mills: Heterocyclic Chemistry, 5. Auflage, S. 125–141, Blackwell Publishing, Chichester, 2010, ISBN 978-1-4051-9365-8.
