2-Chlorpyridin
2-Chlorpyridin ist eine organische Verbindung, die zu den Heterocyclen (genauer: Heteroaromaten) zählt. Sie besteht aus einem Pyridinring, der in 2-Position mit Chlor substituiert ist. Die Verbindung ist isomer zu 3-Chlorpyridin und 4-Chlorpyridin.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
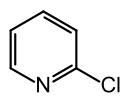 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2-Chlorpyridin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H4ClN | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit pyridinartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 113,55 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,21 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
170 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schlecht in Wasser (27 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Brechungsindex |
1,5320 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Darstellung
Im Allgemeinen sind gängige elektrophile aromatische Substitutionen an Pyridin nicht oder nur mit schlechter Ausbeute möglich. Des Weiteren würde Pyridin bevorzugt in 3-Position substituiert und 2-Chlorpyridin entstünde nur als Nebenprodukt. Die Herstellung von 2-Chlorpyridin gelingt jedoch durch die Reaktion mit molekularem Chlor in Gegenwart katalytischer Mengen Palladium(II)-chlorid.[4]
Eigenschaften
2-Chlorpyridin bildet oberhalb des Flammpunktes von 64 °C entzündliche Dampf-Luft-Gemische.[1] Die Zündtemperatur beträgt 585 °C.[1] Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
Ausgehend von 2-Chlorpyridin und 2-Aminothiophenol wird das Zwischenprodukt 4-Azaphenothiazin hergestellt.[5]
Durch Lithiierung kann 2-Chlorpyridin zu einer Organolithium-Verbindung umgesetzt werden, welche als Ausgangsverbindung für weitere Pyridinderivate dient, die nicht auf direktem Wege zugängig sind.[6]
Einzelnachweise
- Eintrag zu 2-Chlorpyridin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-112.
- Datenblatt 2-Chlorpyridin (PDF) bei Merck, abgerufen am 20. März 2011.
- J. A. Joules, K. Mills: Heterocyclic Chemistry. 4. Auflage, Blackwell Science, Oxford 2000, ISBN 0-632-05453-0, S. 77–81.
- Bernhard Kutscher, Hans Reinhold Dieter, Hans-Günther Trömer, Beate Bartz, Jürgen Engel, Axel Kleemann: Neue Synthese von 4-Azaphenothiazin. In: Liebigs Annalen. Nr. 3, 1995, S. 591–592, doi:10.1002/jlac.199519950381.
- J. A. Joules, K. Mills: Heterocyclic Chemistry. 5. Auflage, Blackwell Publishing, Chichester 2010, ISBN 978-1-4051-9365-8, S. 125–141.



