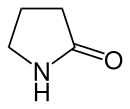
γ-Butyrolactam
γ-Butyrolactam, kurz γ-Lactam oder Butyrolactam, ist eine organisch-chemische Verbindung aus der Stoffgruppe der Lactame. Butyrolactam ist das Lactam der γ-Aminobuttersäure (GABA), einem inhibitorischen Neurotransmitter, und es kann durch Hydrolyse zu GABA umgewandelt werden.[1]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | γ-Butyrolactam | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H7NO | ||||||||||||||||||
| Kurzbeschreibung |
farbloser bis hellgelber Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 85,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,12 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
245 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,4853[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
Die großtechnische Herstellung von γ-Butyrolactam erfolgt heute praktisch ausschließlich durch Umsetzung von γ-Butyrolacton mit Ammoniak bei einer Temperatur von 250–290 °C und einem Druck von 4–14 bar an Magnesiumsilikat-Kontakten in der Gasphase.[4]
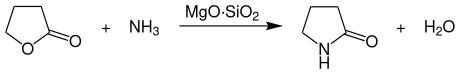
Die Reaktion wird dabei in Rohrreaktoren durchgeführt, in denen der Katalysator (Magnesiumsilikat) in Granulatform als Festbett angeordnet ist. Die Ausbeute liegt bei 75–85 %. Nach einer Destillation kann das gewünschte γ-Butyrolactam in einer Reinheit von mindestens 99,5 % erhalten werden.[4]
Weitere Synthesevarianten, die jedoch aus wirtschaftlichen oder prozesstechnischen Gründen nicht industriell durchgeführt werden, sind die Carbonylierung von Allylamin, die Umsetzung von Malein- oder Bernsteinsäureanhydrid in wässrigem Ammoniak in Gegenwart von Palladium-Ruthenium-Katalysatoren, die katalytische Reduktion von Succinimid oder die Hydrierung von Bernsteinsäuredinitril unter Hydrolysebedingungen.[4]
Im Jahr 2010 lag der geschätzte Bedarf an γ-Butyrolactam bei etwa 32.000 Tonnen. Wichtige Hersteller von γ-Butyrolactam sind BASF und ISP (International Speciality Products, heute Ashland Inc.).[4]
Eigenschaften
Butyrolactam ist ein bei Raumtemperatur zerfließlicher Feststoff, der bei 25 °C schmilzt.
Sicherheitstechnische Kenngrößen
Butyrolactam bildet oberhalb des Flammpunktes von 138 °C entzündliche Dampf-Luft-Gemische.[1] Der Explosionsbereich liegt zwischen 1,8 Vol.-% als untere Explosionsgrenze (UEG) und 16,6 Vol.-% als obere Explosionsgrenze (OEG).[1] Die Zündtemperatur beträgt 390 °C.[1] Der Stoff fällt somit in die Temperaturklasse T1.
Verwendung
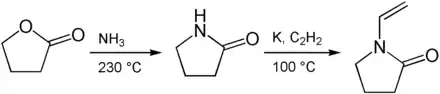
Butyrolactam ist eine Zwischenstufe bei der Herstellung von Polyvinylpyrrolidon. Hierzu wird zunächst γ-Lacton mit Ammoniak bei 230 °C zu Butyrolactam umgesetzt, welches in einem weiteren Schritt mit elementarem Kalium und Acetylen bei 100 °C zu N-Vinylpyrrolidon reagiert.[5][6]
Des Weiteren kann es zur Synthese von N-Methyl-2-Pyrrolidon (NMP) verwendet werden. Hierzu wird es bei 300 °C an Aluminiumoxid mit Methanol zur Reaktion gebracht.[7]
In industriellen Prozessen wird es als hochsiedendes polares Lösungsmittel eingesetzt.
Verschiedene Derivate von Butyrolactam, welche als Racetame bezeichnet werden (z. B. Piracetam, Aniracetam, Oxiracetam, Pramiracetam und andere), werden in der Medizin als Nootropikum eingesetzt.
Siehe auch
Einzelnachweise
- Eintrag zu 2-Pyrrolidon in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- R. Huisgen, H. Brade: Die Basizitätskonstanten Offenkettiger Carbonsäure-Amide in: Chem. Ber., 1957, 90, S. 1432–1436.
- Y. Uosaki, K. Sogo, T. Kunimine, T. Moriyoshi: Excess molar volumes of (a cyclic amide + water) at 298.15 K and 308.15 K, in: J. Chem. Thermodynamics, 1990, 22, S. 257–262, doi:10.1016/0021-9614(90)90196-W.
- Albrecht Ludwig Harreus, R. Backes, J.‐O. Eichler, R. Feuerhake, C. Jäkel, U. Mahn, R. Pinkos, R. Vogelsang: 2‐Pyrrolidone. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 15. October 2011, S. 2, doi:10.1002/14356007.a22_457.pub2.
- W. Reppe: Äthinylierung VI, in: Justus Liebigs Ann. Chem., 1955, 596, S. 158–224.
- W. Reppe: Vinylierung, in: Justus Liebigs Ann. Chem., 1956, 601, S. 81–138.
- Patent BASF: DE 830194, 1951.

